实时荧光定量PCR筛选鸡基因表达最佳内参基因
2021-03-21李毅毅张彦华吴俊锋张晨曦康相涛李文婷
李毅毅 张彦华 吴俊锋 张晨曦 康相涛 李文婷
(河南农业大学 动物科技学院,郑州 450000)
实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)由于其众多的优点,在基因表达研究中得到了广泛的应用,已成为量化基因转录表达、揭示基因表达模式的有效方法[1]。但是qRT-PCR结果的准确性受到内参基因表达量的影响,最终使目的基因表达量与真实值之间存在误差[2]。郑嫩珠等[3]研究内参基因对TYR、MITF和ASIP基因在白绒乌骨鸡各组织表达水平的影响时发现选用不同内参基因会得到不同的试验结果。张蓉等[4]在筛选蛋鸡不同组织中稳定性表达的内参基因时发现,常用的GAPDH基因在不同组织间不是稳定表达的,而RPS2和β-actin基因稳定表达。袁振杰等[5]研究表明在性发育不同阶段的济宁百日鸡下丘脑中,表达最为稳定的是GAPDH基因,而在卵巢中表达最为稳定的是β-actin基因。这些研究都表明不同组织、不同发育时期、不同品种等试验条件下内参基因的表达量并非总是恒定的,而合适的内参基因应当不受品种、组织、发育阶段等影响,维持其稳定的表达水平。
本课题组在前期研究SETDB2、SLIT2、和TAPT1基因在不同品种鸡的组织表达差异分析时,以GAPDH为内参基因通过ΔΔCt法计算3个目的基因相对表达量时,3个基因均表现出胸肌、腿肌表达量较低的现象;进一步分析发现,内参基因GAPDH在胸肌、腿肌中的表达量显著高于其他组织,最终由于内参基因表达量不稳定而影响试验结果。因此,为筛选不同试验条件下稳定表达的内参基因,本研究选取在鸡中常用的5个内参基因:B2M、28S、GAPDH、β-actin和HSP70基因,以地方品种固始鸡和商业品种罗斯308肉鸡为例进行不同品种间比较,以地方品种固始鸡为例进行不同组织和不同发育时期间比较。基于不同分析方法筛选出相对稳定表达的内参基因,旨为研究鸡目的基因转录水平表达量检测的准确性提供保障。
1 材料与方法
1.1 试验材料
试验动物购自河南三高农牧股份有限公司。随机选取固始鸡6周龄5只,14、22和30周龄各3只,及6周龄罗斯308肉鸡3只。所有动物操作程序均得到河南农业大学动物护理和使用委员会(IACUC)的批准,采集6周龄固始鸡的胸肌、腿肌、肝脏、脾脏、十二指肠、空肠、回肠、肌胃和腺胃9种组织样品,14、22和30周龄固始鸡及6周龄罗斯308肉鸡的胸肌组织样品,液氮速冻后于-80 ℃超低温冰箱中保存备用。
1.2 总RNA的提取及cDNA第一条链的合成
采用天根生化科技(北京)有限公司总RNA提取试剂盒说明书提取总RNA,放置于-80 ℃冰箱保存。利用NanoDrop超微量分光光度计检测提取的RNA样品纯度以及浓度,并采用1%琼脂糖凝胶电泳对RNA进行质量检测。使用PrimeScriptTM RT reagent Kit with gDNA Eraser(TAKARA)试剂盒进行cDNA的合成,操作步骤按照试剂盒使用说明进行。使用RNase-Free Water统一稀释至400 ng/μL,置-20 ℃冰箱保存备用。
1.3 引物设计
根据GenBank中公布的鸡基因序列,利用Primer 6.0软件设计28S、B2M、GAPDH、β-actin和HSP70基因的引物,由生工生物工程(上海)股份有限公司合成,引物信息见表1。

表1 候选内参基因引物信息Table 1 Primer information of candidate reference genes
1.4 qRT-PCR检测
利用qRT-PCR检测5 个基因在不同组织中的表达,qRT-PCR反应体系为10 μL:2×TaqPCR Master Mix 5 μL,ddH2O 3 μL,上下游引物各0.5 μL,1 μL cDNA模板(质量浓度为:400 ng/μL)。qRT-PCR 3步法反应程序为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;延伸温度95 ℃ 1 s,65 ℃ 60 s,97 ℃ 1 s,1个循环;37 ℃ 30 s。
1.5 引物标准曲线的绘制
利用不同组织的cDNA样品制作混池,混池原液质量浓度为1 000 ng/ul,然后倍比稀释,设计(50、51、52、53和54)5个浓度梯度,单位为ng/ul,每个质量浓度梯度3个重复,进行实时荧光定量PCR扩增,制作引物标准曲线,检测其回归方程的拟合度R2,以此确定待测基因引物是否可用于定量分析。
1.6 数据处理
采用比较Ct值法检测各基因的表达水平,并保证每个样品的Ct误差≤0.5。在Excel中将5个内参基因中最小Ct值定义为对照组1,其他样品以其为基准应用2-ΔCt计算相对表达量,然后分别利用Vandesompele等[6]编写的geNorm程序和Andersen等[7]编写的NormFinder程序进行内参基因稳定性分析,数据处理及分析程序使用方法参考吴建阳等[8]。另外,本研究还运用SPSS 22.0对Ct值、ΔCt和2-ΔΔCt进行统计性分析。
2 结果与分析
2.1 总RNA质检
利用1%的琼脂糖凝胶电泳检测总RNA质量,结果可见28S和18S条带清晰(图1)。核酸浓度仪检测其OD260/OD280值均在1.9~2.1,OD260/OD230值均>1.90。说明RNA完整性良好,纯度较高。

M: DL2 000;1~2:胸肌;3~4:肝脏;5~6:脾脏; 7~8:十二指肠M: DL2 000 Marker; 1-2: chest muscle; 3-4: liver; 5-6: spleen; 7-8: duodenum图1 部分组织总RNA琼脂糖凝胶电泳质检Fig.1 Detection of partial tissue total RNA by agarose gel electrophoresis
2.2 候选基因引物的扩增效率
如表2所示,28S、B2M、GAPDH、β-actin和HSP705个候选内参基因的标准曲线回归方程的拟合度R2均在0.99左右,表明各内参基因Ct值和起始模板浓度对数值均呈良好的线性关系,扩增效率高,因此可判定各引物可用于qRT-PCR扩增且定量结果可靠。

表2 5个候选内参基因标准曲线的回归方程、回归方程拟合度R2和扩增效率Table 2 Regression equation, fitting degree R2 and amplification efficiency offive internal candidate reference gene standard curve
2.3 qRT-PCR数据分析
2.3.1Ct值比较候选内参基因稳定性
基因的表达水平可通过Ct值的大小反映,Ct值越低说明基因的表达丰度越高。5个候选基因的Ct值比较表明,在不同组织,不同时期,不同品种比较下各个样品的Ct值均有不同的变化。理论上,内参基因的Ct值是恒定不变的,因此用Ct值波动范围大小作为内参基因的稳定性评价的参考依据,即ΔCt=MaxCt-MinCt,ΔCt越大则说明基因越不稳定,越小则说明基因越稳定。如图2所示,在鸡不同组织,不同时期,不同品种间,28S的Ct值波动最小,表达丰度最高且较稳定,而其他候选基因在不同试验分组下的样品中的表达水平均有很大差异。因此,有必要对基因表达的稳定性进行分析,确定不同试验分组下合适的内参基因及数目,以便在鸡不同组织、不同时期、不同品种中进行准确的基因表达谱分析。

图2 5个候选内参基因在不同分组中的Ct值Fig.2 Comparison of Ct values of five candidate reference genes in different groups
2.3.2geNorm软件分析候选内参基因稳定性
应用geNorm进行内参稳定性检测,将qRT-PCR得到的Ct值转换为2-ΔCt相对表达量的值输入分析软件中,通过候选内参基因的表达稳定值M的大小来比较不同候选基因的稳定性,M值越小说明该基因的稳定性越好。由图3(a)可以看出鸡不同组织间5个内参基因的M值在1.258 0~2.398 6,M值最小的基因是28S和HSP70,M值最大的基因是GAPDH,因此在不同组织间最适内参基因是28S和HSP70。图3(b)结果显示,β-actin和GAPDH的M值最小,28S的M值最大,故在鸡不同时期间最稳定表达的内参基因是β-actin和GAPDH,而最不稳定表达的内参基因是28S。由图3(c)可知,在鸡不同品种间5个候选基因的M值分别是:HSP70>β-actin>B2M>28S和GAPDH,表明在鸡不同品种间最稳定表达的内参基因是28S和GAPDH。
通常单一内参基因对目的基因进行矫正,不足以解决样品处理过程中的所有细微变化。因此,利用geNorm来评估候选内参基因的最适数目。可通过geNorm计算结果中的配对变异V值,利用Vn/Vn+1 值的大小来确定所需内参基因的最适数目。如果Vn/Vn+1<0.15,则n为所需内参基因的最适数目。由图3(d)可知,在3个不同试验分组下,Vn/Vn+1值在0.138~0.655,其中只有鸡不同品种间内参基因的V2/3<0.15,为0.138,表明鸡不同品种间只需要GAPDH和28S2个内参基因就能为基因表达分析矫正。
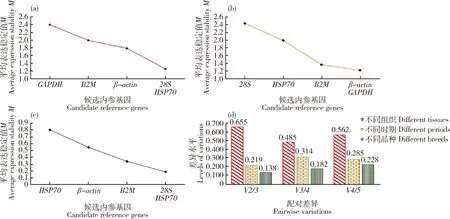
(a)不同组织;(b)不同时期;(c)不同品种;(d)geNorm分析候选基因的配对差异值。(a) Different tissues; (b) Different periods; (c) Different breeds; (d) Candidate internal candidate reference gene pairing difference value by geNorm software.图3 geNorm软件分析5个候选内参基因的稳定性Fig.3 Stability analysis of five internal candidate reference genes by geNorm software
2.3.3NormFinder软件分析候选内参基因稳定性
利用NormFinder计算5个候选基因表达稳定性值(Stability value,SV),进而利用SV值对基因进行稳定性排序。SV值越小,基因越稳定。由表3结果可知,在鸡不同组织间筛选最适内参基因时,候选基因的SV值依次为:GAPDH(1.421)>β-actin(1.180)>B2M(1.110)>HSP70(0.760)>28S(0.582),即最稳定的内参基因为28S。在筛选鸡不同时期间最适内参基因时,GAPDH的稳定性最低(SV=0.315),因此是不同时期间所有样本中最稳定的内参基因。在比较鸡不同品种间候选基因的稳定性值时发现,GAPDH是SV值最低的候选基因,HSP70是SV值最高的候选基因,表明在检测不同品种间组织样本中GAPDH的稳定性最好,为最适内参基因。
2.3.4SPSS统计软件分析候选内参基因稳定性
用Ct值波动范围大小来作为内参基因稳定性评价的参考依据。每个候选基因中ΔCt=MaxCt-MinCt,ΔΔCt=各样本ΔCt-ΔCt平均值,再计算各组合中2-ΔΔCt的标准差,最终得到平均SD2-ΔΔCt值标准差,以Mean SD2-ΔΔCt值最低来选择最适内参基因。如表4所示,在鸡不同组织间候选基因平均标准差排序28S(0.414 52) 表3 NormFinder软件分析5个候选内参基因稳定性Table 3 Stability analysis of five internal candidate reference genes by NormFinder software 表4 5个候选内参基因及其组合的表达稳定性Table 4 Expression stability of 5 candidate reference genes and their combinations 内参基因在严格意义上能够在不同品种、不同组织及不同发育时期恒定表达,不受环境因素的影响。但是,研究表明,目前还没有能够适用于各种细胞类型、不同组织内的内参基因[9]。冯焱等[10]在研究脂多糖(LPS)诱导的免疫应激对肉鸡组织内参基因稳定性的影响中发现在不同组织中稳定表达的内参基因不尽相同,18SrRNA、β-actin和GAPDH适用于肝脏中目的基因表达量的校正;B2M和GAPDH适用于心脏中目的基因表达量的校正;18SrRNA和β-actin适于回肠中目的基因表达量的校正。王彦平等[11]使用qRT-PCR在筛选大蒲莲猪不同发育阶段组织中适宜内参基因时也发现不同体组织中最适宜内参基因组合和数量不同。本研究针对不同候选内参基因的系统验证表明,同一内参基因在所有样品类型中的表达水平也是不同的,在不同试验分组下的研究结果存在差异。因此本研究对鸡不同组织、不同发育时期、不同品种中最佳内参基因进行筛选,以期为地方鸡和商品肉鸡中基因表达相关研究提供参考依据。 目前,针对鸡生长发育基因表达的研究中,多以GAPDH和β-actin作为内参基因[12-17]。王佳洁等[18]研究不同饲养模式对罗斯308肉鸡腿肌中PHGDH基因表达的影响时以GAPDH为内参基因;莫先艇等[19]研究不同生长阶段对乌蒙凤鸡不同组织中QDPR基因的表达影响时以GAPDH为内参基因;李丰耘等[20]研究不同品种盐津乌骨鸡和大围山微型鸡中胸肌、腿肌、肝脏等不同组织中对MyoG和IGF-1基因的表达差异时以β-actin为内参基因;屠云洁等[21]研究灵山香鸡不同发育阶段中不同组织对CPT1B基因表达的影响时以β-actin为内参基因。综上可知,在对鸡进行生长发育基因表达的研究中,使用的内参基因并不是唯一的,有必要对内参基因在不同组织,不同发育时期,不同品种中的表达稳定性进行系统分析,从而规范内参基因在不同试验条件下的使用,进而得出更真实可靠的试验结果。而本研究发现,通过4种算法(Ct值分析法、geNorm、NormFinder、SPSS)对候选内参基因(28S、B2M、HSP70、GAPDH和β-actin)在胸肌、腿肌、肝脏、脾脏、十二指肠、空肠、回肠、肌胃和腺胃9个鸡不同组织中的稳定性分析结果表明28S在不同组织中的表达水平最稳定。对候选内参基因在不同发育时期中(6、14、22和30 W)的稳定性综合分析结果表明GAPDH更适合作为研究目的基因在不同发育时期中的内参基因。在以地方品种固始鸡和商业品种罗斯308肉鸡为例的不同品种的候选内参基因研究中分析结果表明GAPDH在不同品种中表达水平最稳定,其次是28S。现有研究表明,利用单一内参基因对目的基因进行矫正,不足以解决样品处理过程中的所有细微变化,尤其是对不同组织或品种之间进行比较时[22]。因此强烈建议使用2个或多个内参基因。使用geNorm进行的配对差异分析时,当Vn/Vn+1<0.15时,n为最佳内参基因数目。本研究在筛选鸡不同品种间稳定表达内参基因时,V2/3为0.138,表明2个参考基因足以矫正qRT-PCR分析中的数据。因此,在鸡不同品种间建议同时使用GAPDH和28S为内参基因。本研究的结果为不同试验条件下内参基因适用的规范化提供了参考依据。 本研究运用Ct值分析法、独立评价软件geNorm,NormFinder和SPSS 4种分析方法得出以地方鸡固始鸡为例的不同组织,不同时期间最适内参基因分别为28S和GAPDH;以地方品种固始鸡和商业品种罗斯308肉鸡为例的不同品种间最适内参基因为GAPDH和28S基因,为规范鸡相关基因定量表达分析中内参基因的使用提供参考依据。

3 讨 论
4 结 论
