运用高频超声对肝硬化所致大鼠心肌损害及颈部血管病变的评估价值研究
2021-03-19徐晓申郭萌杨
徐晓申郭 萌杨 青
(郑州大学第五附属医院超声诊断科,郑州 450000)
肝硬化由多种病因长时间作用最终导致弥漫性肝损害的一种慢性进行性疾病,是多种肝疾病发展晚期的不可逆阶段[1]。肝硬化早期主要表现为乏力、腹胀、呕吐等症状,后期表现为肝功能损害及门脉高压,组织病理学上表现为肝细胞坏死、残存肝细胞再生以及结缔组织增生、纤维隔形成,使肝小叶正常结构遭到破坏形成假小叶,继而肝变形、变硬,发展为肝硬化[2-3]。心肌损害及颈部血管病变是肝硬化重要并发症之一,心肌损害引起心室代偿性反应,发生心室重构,影响心肌收缩和舒张功能[4-5],并引起外周血管功能及血流动力学改变[6],严重者可导致心功能减退。由于心肌活检创伤性较大,故选择灵敏准确的手段及时评估肝硬化对心肌造成的损伤,对疾病的临床预后有重要意义。超声诊断具有非侵入性、成像快、准确率高等优点,临床通过超声诊断肝硬化可以提供清晰图像和血流动力学变化,故本研究通过建立肝硬化大鼠模型,采用高频超声评估心脏功能及颈部血管改变,了解肝硬化与心肌损害及颈部血管病变的关系,旨在为临床准确快速评估肝硬化对心肌及颈部血管造成的损害提供理论参考。
1 材料和方法
1.1 实验动物
SPF 级雄性SD 大鼠40 只,7 周龄,体重200~210 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],在郑州大学(药物研究院)实验室饲养[SYXK(豫)2018-0005],保持温度23℃~25℃,相对湿度55%~65%,12 h/12 h 明暗周期循环,购入后适应性饲养1 周。本研究经郑州大学动物伦理委员会审核通过(2018060319),动物实验符合3R 原则。
1.2 主要试剂与仪器
四氯化碳(CCl4),德州润昕实验仪器有限公司,批号:20 150107;苯巴比妥那注射液,天津金耀药业有限公司,批号:20 180306;Vivid7 全数字彩色多普勒超声诊断仪,美国GE 公司。
1.3 实验方法
1.3.1 建模及分组
随机选取25 只大鼠诱导肝硬化模型[7]:用橄榄油将CCl4稀释成终浓度40%、50%的橄榄油CCl4溶液备用,用蒸馏水将苯巴比妥注射液稀释成0.35 g/L 浓度备用。实验开始后,大鼠饲喂正常饲料,给予苯巴比妥溶液饮水,连续1 周;第2~5 周,饮水改为10%乙醇溶液,同时按5 mL/kg 体重腹腔注射40%橄榄油CCl4溶液,2 次/周;第6 周开始,饮水改为30%乙醇溶液,同时按5 mL/kg 体重腹腔注射50%橄榄油CCl4溶液,2 次/周,连续4 周。剩余15只为对照组,给予正常进食饮水,从实验开始,按5 mL/kg 体重腹腔注射生理盐水,2 次/周,至实验结束。整个实验过程观察所有大鼠进食饮水及日常活动等一般情况。实验过程中剔除模型组死亡大鼠6 只,以肝组织切片观察到假小叶形成视为建模成功[8],后续HE 染色剔除无假小叶形成的3 只大鼠实验数据,本研究模型组建模成功大鼠共16 只。
1.3.2 检查心脏
大鼠麻醉后仰卧位固定于木板上,并向左侧倾斜30°,胸前备皮,连接导联心电图,对心脏进行扫查,检测频率为11.4 MHz,多普勒检测频率为6.0 MHz,图像深度调至2 cm。探头置于左侧胸骨上,显示左胸骨旁左心室长轴切面、左心室短轴切面,二维心动超声图像引导行M 型进行测量,连续测量5个心动周期,取平均值。
测量指标:①左心室舒张期末内径(left ventricular end diastolic diameter,LVEDD)、左心室收缩期末内径(left ventricular end systolic diameter,LVESD);②左心室前壁舒张末期厚度(left ventricular anterior wall end-diastolic thickness,LVAWT)、左心室后壁收缩末期厚度(left ventricular posterior wall end diastolic thickness,LVPWT);③左心室长轴切面通过单平面面积-长度法测量左心室舒张末期容积(left ventricular end diastolic volume,LVEDV)、收缩末期容积(left ventricular end systolic volume,LVESV);④心率(heart rate,HR);⑤左心室重量(left ventricular mass,LVM),LVM=1.05 ×[(LVEDD+LVAWT+LVPWT)3—LVEDD3];⑥左心室射血分数(left ventricular ejection fraction,LVEF),LVEF=(LVEDV—LVESV)/LVEDV×100%;⑦左心室轴缩短率(fraction shortening,FS),FS=(LVEDD—LVESD)/LVEDD×100%。
1.3.3 检查颈部血管
对双侧颈部皮肤备皮后进行超声扫查,检测颈总动脉管壁随心动周期的运动轨迹,测量血管内径、管壁厚度、血流速度、脉动指数(pulsation index,PI)、阻力指数(resistance index,RI),结果取双侧平均值。
1.3.4 左心室称重及病理学检查
高频超声检查完毕后,处死大鼠,摘取心脏,分离双侧颈总动脉及左肝,颈总动脉置于4%多聚甲醛中固定,肉眼观察肝大体病变情况,之后置于多聚甲醛进行固定。取心脏沿房室沟和室间沟处,切除左心房及右心室,保留室间隔,用过滤纸擦干表面血迹,对左心室进行称重。
称重后,对左心室、双侧颈总动脉损伤处、左肝进行包埋、切片,行常规HE 染色,置于显微镜下观察各组织病理形态学变化,测量颈总动脉切片内膜厚度。
1.4 统计学方法
采用SPSS 25.0 统计学软件进行数据分析,计量资料以平均数±标准差()表示,两样本比较采用独立样本t检验。采用Pearson 相关系数法计算超声测量LVM 与实测LVM 及超声颈总动脉管壁厚度与HE 染色颈总动脉内膜厚度测量值的相关系数。P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况及LVM 比较
对照组大鼠皮光毛亮,触之手感顺滑,反应灵敏,进食饮水及日常活动正常;模型组大鼠皮毛杂乱无光,脱毛,精神萎靡不振,拒食拒水,嗜睡,活动量减少。
对照组、模型组实测LVM 分别为:(723.68±79.49)mg、(867.45±85.21)mg,2 组实测LVM 比较,差异有统计学意义(F=4.849,P=0.000)。
2.2 肝病理形态学
肉眼观察:对照组肝颜色红润,表面光滑,质地柔软;模型组肝颜色呈棕黄色,表面粗糙不平,质地较硬,体积减小,表面分布有大小不一的增生结节,可见黄色颗粒。
镜检:对照组肝小叶结构正常,中央静脉周围肝细胞呈放射状,排列整齐规则。模型组正常肝小叶结构消失,出现假小叶,肝细胞排列紊乱,中央静脉消失或偏向边缘,肝细胞有不同程度的变性及炎性细胞浸润。见图1。
2.3 心肌及颈总动脉病理形态学
对照组心肌纤维结构清晰,排列整齐,肌纤维走向规律;模型组心肌细胞结构松散、肿胀,排列紊乱,肌纤维走向混乱,出现断裂及炎性细胞浸润,细胞外间质增多。对照组颈总动脉层次清晰、结构完整,血管壁厚度均匀;模型组颈总动脉血管内壁有不同程度增厚,管腔变窄,管腔面积变小,层次不清,结构混乱。见图2、图3。
对照组和模型组颈总动脉组HE 染色内膜厚度的测量值分别为:(13.01±0.45)μm,(60.34±0.58)μm,模型组HE 染色内膜厚度的测量值大于对照组,差异有统计学意义(F=252.621,P=0.000)。
2.4 心脏超声测值比较
模型组大鼠LVEDD、LVESD、LVEDV、LVM、HR高于对照组,FS 低于对照组,差异有统计学意义(P<0.05),两组大鼠LVAWT、LVPWT、LVESV、LVEF比较,差异无统计学意义(P>0.05)。见表1、图4。

图1 肝病理形态学观察Figure 1 Observation of pathological morphology of liver

图2 心肌病理形态学观察Figure 2 Observation of pathological morphology of myocardium
表1 心脏高频超声测值比较()Table 1 Comparison of cardiac high-frequency ultrasound measurements
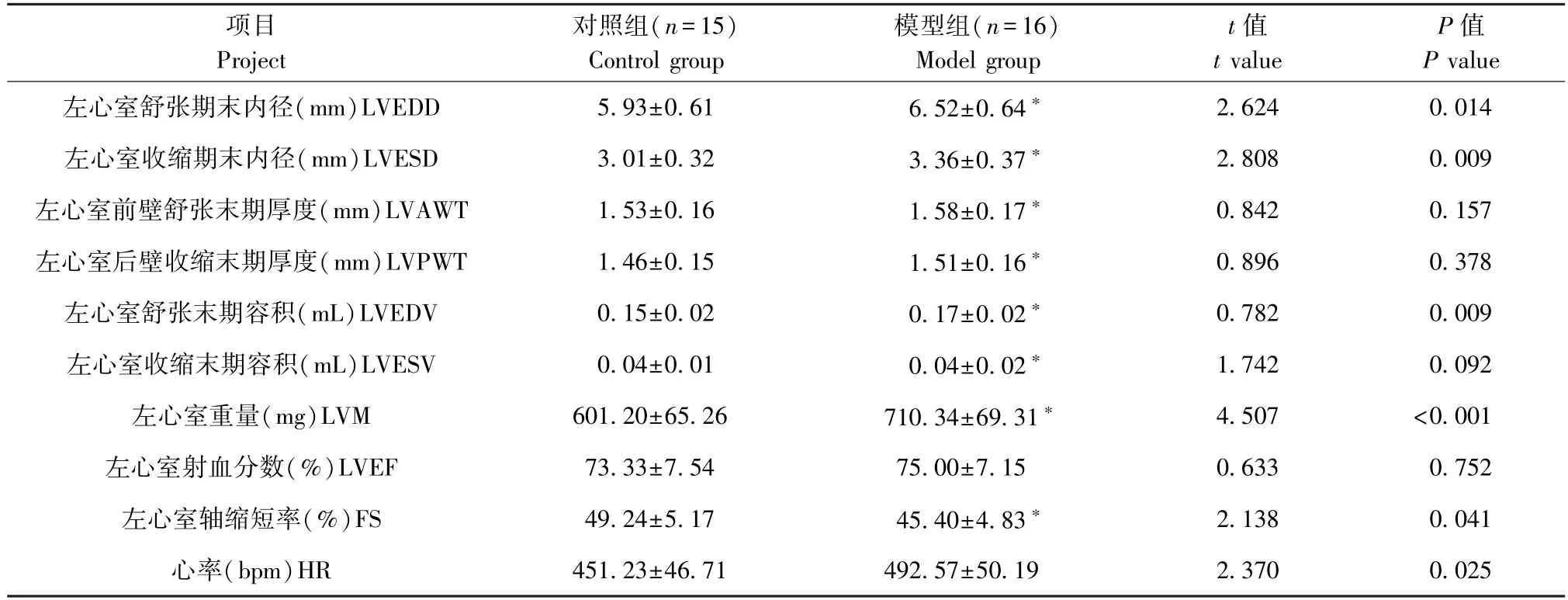
表1 心脏高频超声测值比较()Table 1 Comparison of cardiac high-frequency ultrasound measurements
注:与对照组比较,∗P<0.05。Note.Compared with the control group,∗P<0.05.
2.5 颈总动脉超声测值比较
模型组大鼠血管内径、血流速度小于对照组,管壁厚度、PI、RI 大于对照组,差异有统计学意义(P<0.05)。见表2、图5。
2.6 心脏及颈总动脉超声数值与测量数值相关性分析
经Pearson 相关性分析,超声LVM 与实测LVM呈正相关(r=0.875,P<0.001);超声颈总动脉管壁厚度与HE 染色颈总动脉内膜厚度的测量值呈正相关(r=0.821,P<0.001)。
3 讨论

图3 颈总动脉组织形态学观察Note.A1,Control group .A2,Control group .B1,Model group .B2,Model group .Figure 3 Observation of histomorphology of common carotid artery
表2 颈总动脉超声测值比较()Table 2 Comparison of ultrasound measurements of common carotid artery

表2 颈总动脉超声测值比较()Table 2 Comparison of ultrasound measurements of common carotid artery
注:与对照组比较,∗P<0.05。Note.Compared with the control group,∗P<0.05.

图4 心功能超声检测Figure 4 Heart function ultrasound

图5 颈总动脉超声图Figure 5 Carotid ultrasound
肝硬化是肝实质病变的终末结果,随着肝纤维化不断发展,可导致多器官并发症,累及消化系统、心血管系统、泌尿系统等多个系统,晚期继发感染,出现腹水、癌变等并发症,严重危害人类健康,对于肝硬化患者应当早发现早治疗,阻止疾病进展,从而减少并发症[9-10]。肝硬化患者心功能存在异常现象,长期高动力循环,使心室负荷加重,造成钠水潴留,从而引起心肌相对供血不足,最终导致心肌细胞肥大以及心肌间质纤维化,即心室重构,包括心室厚度、容积及结构等方面的改变[11-12]。本研究通过建立肝硬化大鼠模型,模拟心脏损伤,研究肝硬化心肌损伤过程,以期为改善心功能状态,降低肝硬化心脏并发症发生率提供参考。
本研究镜检模型组肝正常肝小叶结构破坏,出现假小叶,门静脉消失或偏向边缘,成功建立肝硬化大鼠模型。肝硬化患者心肌功能减退,出现心室重构,通过超声观察心脏结构和功能改变是一种理想的无创检查方式,随着超声技术的发展及高频探头的应用,图像清晰度和分辨率在一定程度上得到提高[13]。近年来,研究者通过不断改进方法方式,运用高频超声在观察大鼠心脏方面获得长足进步,为研究心血管系统疾病奠定了基础。本研究运用高频超声检测大鼠心脏功能,可观察到清晰左心室长轴切面及左心室短轴切面,模型组大鼠模型组大鼠LVEDD、LVESD、LVEDV、LVM、HR 显著高于对照组,FS 低于对照组,提示模型组大鼠左心室心腔增大,心室肥厚,发生重构,与临床患者超声结果一致[14]。肝硬化患者尸检结果显示,肝硬化伴有心脏损害,包括心室扩张或肥厚,心肌纤维结构改变、心肌间质水肿或出等结构和功能改变[15]。本研究HE染色结果显示,模型组大鼠心肌纤维走向混乱,心肌细胞结构松散,排列紊乱,出现断裂、肿胀及炎性浸润,细胞外间质增多,提示肝硬化发生后伴有明显心肌损伤,与患者尸检结果一致,表明该模型可在一定程度模拟肝硬化患者心肌损伤过程。肝硬化可累及心肌损伤,导致一系列心功能障碍,本研究中高频超声结果与病理学变化一致,组织病理学心肌纤维形态改变心功能改变的病理基础,表明运用高频超声可用于检测大鼠肝硬化引起的心肌损伤。
肝硬化患者循环系统呈高血流动力状态,引起血管肥厚、血管内皮受损,RI 升高,血流速度变慢,导致血管弹性降低,对患者颈总动脉进行超声检测,显示回声增强,内膜增厚,管腔变窄,严重者可引起动脉粥样硬化[16-17]。本研究通过超声对大鼠颈总动脉进行检测,结果显示模型组血管内径变窄、血流速度变慢,PI 及RI 升高,提示肝硬化大鼠伴有颈总动脉结构及功能改变,与临床患者超声结果一致[18];HE 染色显示颈总动脉管腔血管内壁有不同程度增厚,管腔变窄,管腔面积变小,且结构混乱层次不清,与超声结果相符,提示高频超声可用于检测肝硬化大鼠颈总动脉形态和功能的改变。颈总动脉血管结构改变与心室重构密切相关,颈动脉管腔和厚度随左心室改变而发生变化[19]。患者发生左心室肥厚,引起颈总动脉内膜中层厚度增加,管腔变窄,血流变慢[20]。本研究高频超声结果显示,肝硬化伴有颈总动脉血管结构和功能改变,表明运用高频超声可用于检测肝硬化颈总动脉的改变。
本研究经Pearson 相关性分析,超声LVM 与实称LVM 呈正相关,提示超声检测与实际检测具有相关性,通过高频超声检测肝硬化大鼠心脏及颈总动脉形态功能的改变,结果准确可靠,值得临床推广,为进一步研究肝硬化发病机制,及早改善心功能状态提供理论参考。
