H2A.X 和NPM1 哺乳动物双杂交表达载体的构建及其在MCF-7 细胞中的表达
2021-03-19高秀丽段文博
高秀丽 段文博 王 婧 王 涛 任 珊
(1.齐齐哈尔医学院医药科学研究院,黑龙江齐齐哈尔 161006;2.齐齐哈尔医学院医学技术学院,黑龙江齐齐哈尔 161006)
组蛋白H2A.X(histone H2A.X,H2A.X)是组蛋白H2A 的一个变体,在DNA 损伤应答过程中发挥关键作用。在DNA 损伤诱导的肿瘤形成过程中,H2A.X 发生139 位丝氨酸的磷酸化,同时招募一些DNA 损伤修复蛋白及一些信号蛋白,在DNA 损伤位点附近形成复合物,进而启动细胞对DNA 损伤的应答、修复等过程[1]。核仁磷蛋白(nucleophosmin,NPM1)是一种组蛋白伴侣蛋白,其可同组蛋白相互结合,负责调解不同的细胞功能,例如组蛋白转运、基因组稳定及转录调控等[2]。研究表明,在放射线诱导的条件下,H2A.X 会在DNA 损伤及修复的不同的时期形成动态复合物,而NPM1 是整个过程的常驻成员[3]。DNA 损伤的积累是癌症发生的主要原因,而诱导癌细胞发生DNA 损伤又是癌症放化疗的主要手段[4],因此研究DNA 损伤对癌症的病因和治疗靶点的筛选具有重要意义,而H2A.X 与NPM1的相互结合有望成为连接DNA 损伤与癌症之间的关键桥梁。哺乳动物双杂交能够有效地检测蛋白质之间在体内条件下的相互作用,弥补了体外研究蛋白质相互作用的不足。本研究分别构建了H2A.X 及NPM1 哺乳动物双杂交表达载体,并实现了其在人乳腺癌MCF-7 细胞中的表达,以期为深入研究乳腺癌中H2A.X 同NPM1 的结合及其功能提供实验基础。
1 材料和方法
1.1 实验细胞
MCF-7 细胞购自中国科学院上海细胞库。
1.2 主要试剂与仪器
MEM 培养液(HyClone,SH30024.01B,美国);Opti-MEM 培养液(Gibgo,31985070,美国);胎牛血清(Clark,FB25015,美国);Lip3000 转染试剂(Invitrogen,美国);限制性内切酶(TaKaRa,日本);TRIzol(Invitrogen,15596-026,美国);逆转录试剂盒(全式金,AE301-02,中国);Ex Taq HS 聚合酶(TaKaRa,RR006,日本);凝胶回收试剂盒(全式金,EG101 -01,中国);T5 Zero 载体(全式金,CT501,中国);质粒小量提取试剂盒(康为,CW2016,中国);T4 DNA 连接酶(全式金,FL101-01,中国)。
PCR 仪(Bio-Rad,C1000 Touch,美国);台式冷冻离心机(Eppendorf,5804R,德国);紫外可见分光光度计(岛津,Biospec-nano,日本);凝胶成像分析系统(Bio-Rad,ChemiDoc1708280,美国);正置显微镜(尼康,E100 Eclipse,日本);二氧化碳培养箱(Thermo,3111,美国);暗箱式紫外分析仪(上海驰唐,WFH-203B)。
1.3 实验方法
1.3.1 细胞及培养方法
MCF-7 细胞培养于MEM 培养液,添加10%胎牛血清,0.11 g/L 丙酮酸钠及0.01 mg/mL 牛胰岛素,培养于37℃含5% CO2的细胞培养箱中。
1.3.2 细胞转染
MCF-7 细胞采用Lip3000 转染试剂进行瞬时转染:将7.5 μL Lip3000 转染试剂和2.5 μg 质粒DNA分别加至125 μL Opti-MEM 培养液中,之后将含DNA 的Opti-MEM 培养液转移至含转染试剂的培养液中,混匀并静止20 min 后滴加至细胞中。转染约36 h 后利用RT-PCR 方法检测基因转染效率。
1.3.3 H2A.X 及NPM1 表达载体的构建
根据人源H2A.X(GeneBank accession:NM_002105.3) 及 NPM1 (GeneBank accession:NM _002520.6)基因序列在编码区上游和下游设计并合成扩增引物:H2A.X(上游5’-GCTCTAGAGCTA GCATGTCGGGCCGCGGCAAG-3’,下游 5’-GGGG TACCTTAGTACTCCTGGGAGGCCTGGGT-3’);NPM1(上游5’-GCTCTAGACACCCGATGGAAGATTCGAT GGA-3’,下游5’-GGGGTACCTTAAAGAGACTTCC TCCACTGCCAG-3’),并在引物两端引入限制性酶切位点(上游:XbalⅠ,下游:KpnⅠ)。常规TRIzol法提取MCF-7 细胞总RNA 并将RNA 逆转录成cDNA。以获得的cDNA 为模板,由Ex Taq HS 聚合酶扩增H2A.X 及NPM1 mRNA 全长序列,扩增条件:94℃变性30 s,55℃退火30 s,72℃延伸1 min,以上过程重复30 循环,最后执行72℃10 min。PCR产物经1%琼脂糖凝胶电泳鉴定后由凝胶回收试剂盒按说明书纯化回收并与T5 Zero 载体在37℃条件下连接2 h,连接产物转化大肠杆菌DH5a 感受态细胞,转化产物经37℃孵育16 h 后挑取平板上生长饱满的单克隆菌落培养14 h,提取细菌质粒DNA 并进行电泳及双酶切验证(酶切体系:XbalⅠ0.5 μL,KpnⅠ0.5 μL,M buffer 2 μL,质粒DNA 1 μg,双蒸水补充至20 μL;酶切条件:37℃,2 h),经酶切验证正确的产物分别由T4 DNA 连接酶连接至线性p-BIND及PACT 表达载体(连接体系:线性目的片段17 μL,线性载体2 μL,T4 DNA 连接酶1 μL,5×DNA 连接酶缓冲液5 μL;连接条件:16℃,14 h),获得的连接产物通过电泳及双酶切验证后送至上海生工生物工程有限公司进行测序验证。
1.3.4 RT-PCR 检测H2A.X 及NPM1 mRNA 表达水平
MCF-7 细胞采用常规TRIzol 法提取RNA 并逆转录成cDNA。以获得的cDNA 为模板,以H2A.X、NPM1 及GAPDH RT-PCR 引物进行PCR 扩增,扩增条件:94℃变性30 s,55℃退火30 s,72℃延伸1 min,以上过程重复30 循环。H2A.X 引物序列:上游5’-TACCTCGCTAGCATGTCGGG-3’,下游5’-TTAGTACTCCTGGGAGGCCTGGGTG-3’;NPM1 引物序列:上游5’-TGTGAACTAAAGGCCGACAAAGATT-3’,下游5’-CACTAATATGCACTGGCCCTGAACC-3’,GAPDH 引物序列:上游5’-GGACCTGACCTG CCGTCTA-3’,下游5’-GAGTGGGTGTCGCTGTTGA-3’。将获得的PCR 产物进行1%琼脂糖凝胶电泳,并通过Bio-Rad 凝胶成像仪进行凝胶成像。
2 结果
2.1 H2A.X-pBind 表达载体的构建
电泳结果表明,获得的H2A.X PCR 产物同NCBI 上报道的H2A.X 编码序列大小相一致(图1 A),将纯化后的PCR 产物进行TA 克隆及酶切验证后,获得预期大小的DNA 片段(图1B、1C)。将验证正确的酶切产物与p-BIND 线性载体连接并酶切验证后,同样获得预期DNA 片段(图1D、1E)。选取验证结果正确的连接产物进行测序,测序结果与NCBI 中H2A.X 编码序列比对验证,插入片段匹配率为100%(图1F)。以上结果说明H2A.X-pBIND表达载体构建成功。
2.2 NPM1-PACT 表达载体的构建
电泳结果表明,获得的NPM1 PCR 产物同NCBI 上报道的NPM1 编码序列大小相一致(图2 A),将纯化后的PCR 产物进行TA 克隆及酶切验证后,获得预期大小的DNA 片段(图2B、2C)。将验证正确的酶切产物与PACT 线性载体连接并酶切验证后,同样获得预期DNA 片段(图2D、2E)。选取验证结果正确的连接产物进行测序,测序结果与NCBI 中NPM1 编码序列比对验证,插入片段匹配率为100%(图2F)。以上结果说明NPM1-PACT 表达载体构建成功。
2.3 H2A.X 及NPM1 在MCF-7 细胞中表达效果
将构建好的H2A.X-pBIND 及NPM1-PACT 表达载体及其对照空载体分别转染至MCF-7 细胞中,并利用RT-PCR 方法检测两种基因的表达水平。结果表明,同对照组相比,实验组中H2A.X 及NPM1 mRNA 表达水平均明显增加(图3),说明构建的H2A.X 及NPM1 表达载体可成功在MCF-7 细胞中表达。
3 讨论
女性乳腺癌因其高发病率、难治愈性以及发病群体的年轻化而成为癌症领域急需攻克的难题之一。众多研究结果表明,DNA 损伤的积累是乳腺癌发生的主要原因,而诱导癌细胞发生DNA 损伤又是乳腺癌放化疗的主要途径,因此研究DNA 损伤应答对乳腺癌的病因和治疗靶点的筛选具有重要的意义。H2A.X 因其同DNA 损伤应答的密切关系而成为研究热点。目前,ATM-H2A.X-p53 已成为经典的DNA 损伤信号途径:ATM 是DNA 损伤的感受器并磷酸化H2A.X,激活p53,进而启动细胞周期阻滞、DNA 修复及细胞凋亡[5-7]。然而,除以上经典途径外,H2A.X 可在DNA 损伤应答的不同时期招募不同蛋白形成动态变化的复合物,Du 等[3]研究表明NPM1 是多种动态复合物中的常驻成员,而其在H2A.X 介导的DNA 损伤应答过程中的作用尚不清楚。目前,针对NPM1 的研究主要集中NPM1 的突变、过表达及其翻译后修饰同癌症之间的关系[8]。研究表明,NPM1 突变已成为急性髓性白血病的标志之一[9-11],而在胃癌[12]、结肠癌[13]、卵巢癌[14]等癌中NPM1 则呈高表达,并通过促进细胞增殖和抑制细胞凋亡发挥其促癌作用[15-16]。另外,NPM1 是一种可发生多种翻译后修饰的蛋白,翻译后修饰会直接调控NPM1 的功能,且同多种癌症的发生发展密切相关[17-18]。近年来,NPM1 的组蛋白伴侣功能也逐渐受到人们的重视,其同组蛋白结合后对组蛋白的转运、染色质转录的调控功能逐渐为人们所揭示[19]。这提示我们,NPM1 可能因其组蛋白伴侣蛋白的特性同H2A.X 结合,并以DNA 损伤为桥梁在乳腺癌的发生发展过程中扮演重要角色。
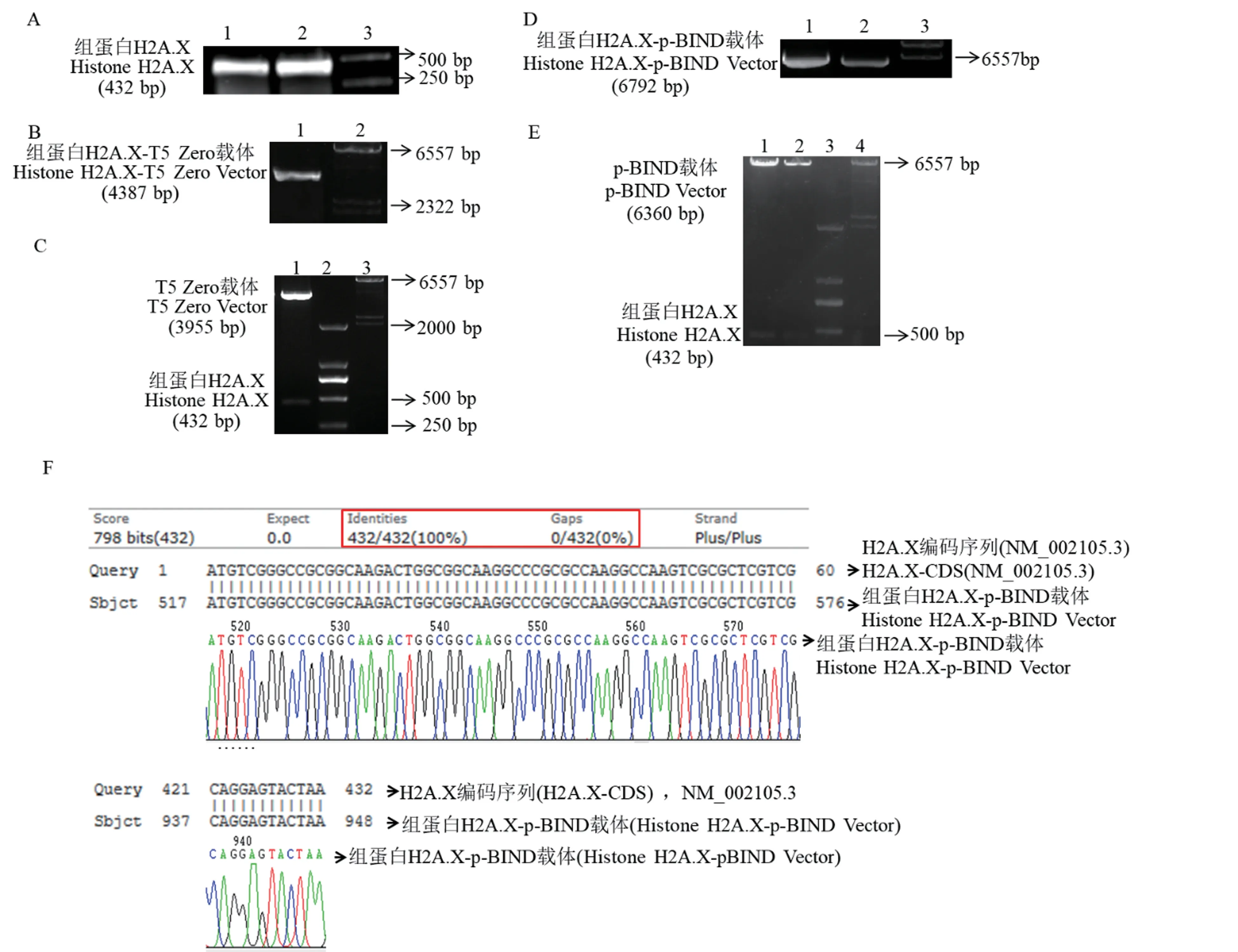
图1 H2A.X-pBIND 表达载体的构建Note.A,Amplification of H2A.X gene expression sequence by PCR method.1/2,Replication experiments for increasing PCR products;3,DL2000 DNA Marker.B,TA clone of H2A.X PCR products.1,TA clone products of H2A.X-T5 Zero;2,λ-Hind ⅢDNA Marker.C,Double enzyme validation of H2A.X TA clone.1,H2A.X-T5 Zero double enzyme products by Xbal Ⅰand Kpn Ⅰ;2,DL2000 DNA Marker;3,λ HindⅢDNA Marker.D,Clone between H2A.X and target vector p-BIND.1/2,Clone products of H2A.X-pBIND;3,λ-HindⅢDNA Marker.E,Double enzyme validation of H2A.X-pBIND clone.1/2,H2A.X-pBIND double enzyme products by Xbal Ⅰand Kpn Ⅰ;3,DL2000 DNA Marker;4,λ-Hind ⅢDNA Marker.F,Sequencing results of H2A.X-pBIND.Figure 1 Construction of H2.X-pBIND expression vector
蛋白质是生物功能的最终执行者,几乎每一项功能的完成都需要不同蛋白之间的协同合作。因此,研究蛋白质与蛋白质之间的相互作用是解析各种调控机制的关键。哺乳动物双杂交方法衍生于酵母双杂交[20-21],该方法分别将两种目标蛋白与转录因子的DNA 结合结构域与转录激活结构域相融合,利用目标蛋白的相互结合,使转录因子的两种结构域在空间上相互靠近,进而启动报告基因的转录,最终利用报告基因的活性指示两种目标蛋白的结合情况,是研究蛋白质-蛋白质相互作用的经典方法[22-23]。同目前主流的蛋白质免疫共沉淀方法相比,哺乳动物双杂交的优点在于可最大程度地模拟体内蛋白质-蛋白质的相互作用,也常作为蛋白质免疫共沉淀的互补方法;同GST pull-down 实验及组学方法相比,哺乳动物双杂交具有操作简单、成本低的优势。因此,哺乳动物双杂交是研究蛋白质互作中不可缺少的主要方法。
本研究以哺乳动物双杂交实验为基础,构建了H2A.X 和NPM1 相应表达载体,同时实现了两种表达载体在乳腺癌MCF-7 细胞中的表达,为后续研究乳腺癌中H2A.X 同NPM1 的结合及功能提供了实验基础。但二者在乳腺癌中的相互作用模式以及在乳腺癌DNA 损伤应答过程中扮演的角色仍需进一步的研究。

图2 NPM1-PACT 表达载体的构建Note.A,Amplification of NPM1 gene expression sequence by PCR method.1/2,Replication experiments for increasing PCR products;3,DL2000 DNA Marker.B,TA clone of NPM1 PCR products.1,TA clone products of NPM1-T5 Zero;2,λ-Hind ⅢDNA Marker;C,Double enzyme validation of NPM1 TA clone.1,H2A.X-T5 Zero double enzyme products by Xbal Ⅰand Kpn Ⅰ;2,DL2000 DNA Marker;3,λ HindⅢDNA Marker.D,Clone between NPM1 and target vector PACT.1/2,Clone products of NPM1-PACT;3,λ-Hind ⅢDNA Marker.E,Double enzyme validation of NPM1-ACT clone.1/2,NPM1-PACT double enzyme products by Xbal Ⅰand Kpn Ⅰ;3,DL2000 DNA Marker.F,Sequencing results of NPM1-PACT.Figure 2 Construction of NPM1-PACT expression vector

图3 H2A.X-pBIND 和NPM1-PACT 在MCF-7 细胞中的表达Note.1,MCF-7 cells transfected with pBIND (control group);2,MCF-7 cells transfected with H2A.X-pBIND (experiment group);3,MCF-7 cells transfected with PACT(control group);4,MCF-7 cells transfected with NPM1-PACT (experiment group);5,DL2000 DNA Marker.Figure 3 Expression of H2A.X-pBIND and NPM1-PACT in MCF-7 cells
