NaHCO3和Na2CO3胁迫对碱茅和披碱草种子萌发、幼苗生长和生理指标的影响*
2021-03-18郑译儒赵俊超龚束芳王金刚
郑译儒,赵俊超,龚束芳,王金刚
(东北农业大学园艺园林学院, 哈尔滨 150030)
目前,全球共有盐碱土面积8.31×108hm2,而中国大约有9.2×106hm2农田遭受盐碱毒害,其中松嫩平原是最主要的苏打盐碱分布区,主要盐分是NaHCO3和Na2CO3[1-4]。 自然环境中的盐碱胁迫通常是中性盐胁迫和碱胁迫伴随发生的,前期的研究主要集中于以NaCl和Na2SO4为主的中性盐胁迫,而对碱性盐胁迫(NaHCO3和Na2CO3)的研究还较少[5-6]。一般盐碱胁迫下,植物细胞膜遭到破坏,可利用植物叶片的相对电导率和丙二醛(MDA)含量来反映细胞膜损害程度和植物对逆境条件抗性强弱[7-8]。盐碱胁迫会对植物光合系统造成伤害,常表现在影响植物光合速率及叶绿素荧光参数[9-10]。植物在长期适应盐碱胁迫过程中,进化出自身适应盐碱胁迫的生理机制。遭受逆境条件时,植物体内积累的活性氧严重影响植物的正常生长,而植物防御系统中的抗氧化酶,如超氧化物歧化酶(SOD),可以清除活性氧[11]。由于盐碱胁迫下植物细胞内水势显著高于细胞外水势,从而造成植物细胞内水分失衡,而植物通过无机渗透调节,从外界环境中吸收大量的无机离子,如Na+和K+,来降低细胞水势而保证自身的生理活动正常进行[12]。然而,一般的植物仅耐受较低盐碱胁迫能力,却无法在高浓度的盐碱环境下生存。因此筛选耐盐碱能力较强的植物材料并研究其抗逆机制是未来研究的重点。
碱茅和披碱草,均属于禾本科多年生草本,可用于放牧和饲用,同时也是潜在的优良草坪草资源[13-14]。由于它们常年生活在碱斑土壤上,具有耐盐碱能力,因此可以作为潜在的耐盐碱胁迫研究材料。前人研究发现中性盐(NaCl和Na2SO4)胁迫抑制碱茅和披碱草正常生长并影响其生理特征。张海南[15]通过对5种碱茅材料的种子萌发的盐胁迫和幼苗期盐胁迫处理,对生长指标和生理指标的测定后进行方差分析和相关性分析,利用隶属函数法进行耐盐性综合评价后得出各项指标所占比重。任小青和冀宏[16]用不同浓度NaCl、Na2CO3溶液对碱茅进行处理,发现随着盐溶液浓度的增加,发芽率逐渐降低,平均发芽时间逐渐延长;且相同溶液浓度下,Na2CO3胁迫比NaCl胁迫更为明显。通过设置不同盐浓度对披碱草幼苗进行胁迫,检测叶片细胞膜透性和游离脯氨酸含量等指标,研究者发现不同地区披碱草的耐盐性存在差异[17-18]。用中性混合盐(NaCl和Na2SO4)和碱性混合盐(NaHCO3和Na2CO3)对披碱草种子萌发进行胁迫处理,显示碱性胁迫明显高于中性胁迫[19]。除具有高浓度盐胁迫,碱性盐与中性盐相比,其高pH也会对植物造成伤害。采用不同浓度NaCl和Na2CO3处理盐地碱蓬和小花碱茅,检测种子萌发率及萌发阶段幼苗的生长状况、幼苗的生理特性、活性氧清除系统、光合特性以及PSⅡ光化学特性等指标,发现盐地碱蓬和小花碱茅种子萌发率主要受到渗透胁迫的抑制,pH值对二者种子萌发的影响很小[20]。目前已知混合碱胁迫影响披碱草生理指标和碱茅种子萌发,然而对于来自同一地区的碱茅和披碱草生长及生理指标如何响应混合碱胁迫还不得而知[21]。
本研究采用不同浓度NaHCO3和Na2CO3混合物对碱茅和披碱草进行处理,调查碱茅和披碱草种子萌发及生理特征对碱性盐胁迫的响应,通过种子发芽率、幼苗干重、叶片细胞膜透性、光合气体交换参数、叶绿素荧光参数、叶片超氧化物歧化酶活性和丙二醛含量,以及叶片和根系Na+、K+离子含量,明确碱茅和披碱草适应碱性盐胁迫的生理机制。本研究对二者的盐碱耐受性分析,旨在筛选抗性更强的植物材料并研究抗逆机制,可为盐碱土壤的开发利用以及作物的种植提供理论依据。
1 材料与方法
1.1 种子萌发的测定
以采自中国黑龙江省安达盐碱土(pH>9)的碱茅(Puccineliachinampoensis)和披碱草(Elymusdahuricus)为实验材料。配制NaHCO3和Na2CO3的混合溶液(摩尔比为2∶1),设浓度分别为0(对照)、25、50、75和100 mmol/L的5个处理(pH分别为6.90、9.15、9.54、9.66、9.76)。每个处理3次重复,每个重复10个皿,共计150个皿。取干净的培养皿,内放3层滤纸,用5 mL不同浓度的混合溶液充分浸湿。选取饱满的碱茅和披碱草各100粒,先用0.5%次氯酸钠处理10 min进行表面消毒,然后用超纯水冲洗,最后将种子均匀铺在培养皿里。在光照培养箱在进行萌发率的实验(16 h白天/8 h夜间,11 540 lx,25 ℃/21 ℃)。每天抽取培养皿中剩余溶液,并注入与之浓度相对应的等量溶液。以培养根长达到种子长度的1/2为发芽标准,每天记录发芽的种子数,连续观察10 d。发芽率=发芽种子数/供试种子数×100%。
1.2 幼苗干重的测定
选取籽粒饱满的碱茅和披碱草种子各60粒,分别播种于装有1 kg洗净细沙的花盆中,用Hoagland营养液浇灌,待长至4~5片真叶时进行间苗,每盆留30株。培养30 d后进行盐处理,每盆浇灌100 mL的0、25、50、75和100 mmol/L的碱性盐混合物(混合物配比同1.1节)的Hoagland营养液。处理3 d后,选取长势相同的10株幼苗,分别取地上部和地下部,洗净擦干后,进行105 ℃杀青30 min,80 ℃烘干至恒重,记录植株地上部和地下部干重。每个处理3次重复,每个重复10盆,共计150盆。
1.3 叶片细胞膜透性的测定
采用电导率法测定叶片细胞膜透性,取碱性盐混合物处理3 d后的碱茅和披碱草幼苗叶片各0.2 g,清水洗净后再用蒸馏水冲洗3遍,剪碎后置于玻璃管中加10 mL蒸馏水进行充分震荡后静置,用电导率仪测定其电导率初始值,每隔30 min检测1次,待2 h后沸水煮10 min,冷却后测定电导率终值。每个处理3次重复。细胞膜透性=电导率初值/煮沸后的测定值[22]。
1.4 光合气体交换参数的测定
采用LI-6400便携式光合作用测量系统测定碱性盐混合物处理3 d后的叶片净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)和蒸腾速率(Tr)。每个处理测定3次,每次测定5株。
1.5 叶绿素荧光参数的测定
碱性盐混合物处理4 d后,将叶片暗处理30 min后,采用便携式荧光仪IMAGING-PAM测定暗适应后的最小荧光(Fo)、最大荧光(Fm)和可变荧光(Fv)以及光适应后的最小荧光(F′o)、最大荧光(F′m)和可变荧光(F′v)。PSⅡ的最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学淬灭(qP)和非光化学淬灭(qN)由仪器自动给出。每个处理测定3次,每次测定5株。
1.6 叶片超氧化物歧化酶活性和丙二醛含量的测定
碱性盐混合物处理3 d后,取叶片0.5 g,经液氮速冻后,采用NBT(氮蓝四唑)光化还原法测定叶片超氧化物歧化酶活性[22]。取叶片0.5 g,采用硫代巴比妥酸(TBA)法测定叶片丙二醛含量[19]。每个处理3次重复,每个重复5株。
1.7 碱茅和披碱草幼苗Na+和K+离子含量的测定
碱性盐混合物处理3 d后,将两种草本的叶片或根系分别置于105 ℃烘箱中进行30 min杀青,85 ℃烘干至恒重后取出进行研磨,过60目筛,分别取0.1 g,用HNO3∶HClO4(体积比5∶1)消煮至澄清透明,用去离子水定容至20 mL后,采用离子吸收分光光度计测定Na+和K+含量[23],计算植物限Na+能力。限Na+能力=根系Na+含量/叶片Na+含量[24]。
1.8 数据处理与分析
利用Excel 2010进行数据整理,利用Prism软件做图,利用SPSS 17.0结合Tukey分析方法对数据进行差异显著性分析(p<0.05)。
2 实验结果
2.1 NaHCO3和Na2CO3胁迫对碱茅和披碱草种子萌发率和干重的影响
种子的发芽率是检验种子在萌发过程中受到逆境影响的一个重要指标。由图1可知,不同浓度的NaHCO3和Na2CO3混合物处理均抑制碱茅和披碱草种子的萌发。在第10天时,与0 mmol/L处理相比,随着混合物浓度的升高,碱茅种子的发芽率分别为56.60%、38.20%、14.64%和13.35%,见图1(a),而披碱草的发芽率分别为70.12%、53.44%、24.57%和19.10%,见图1(b)。碱茅和披碱草地上部和地下部干重也均表现出随混合物浓度增加而逐渐下降的趋势,见图2。与对照相比,各浓度处理的碱茅和披碱草均显著下降,见图2。进一步分析发现,相同混合物浓度处理时,碱茅与披碱草的地上部和地下部干重差异均达到显著水平,见表1。结果说明,NaHCO3和Na2CO3混合物处理随时间的增加均抑制碱茅和披碱草种子的萌发,且随混合物浓度的增加碱茅和披碱草幼苗的生长受抑制严重。

图1 NaHCO3和Na2CO3混合物对碱茅(a)和披碱草(b)种子发芽率的影响Fig.1 Effects of NaHCO3 and Na2CO3 mixture on germination rate of P. Chinampoensis (a) and E. dahuricus (b)

表1 不同浓度的NaHCO3和Na2CO3混合物处理下碱茅和披碱草干重的方差分析Table 1 Variance analysis on plant dry weight under different concentrations of NaHCO3 and Na2CO3 mixture
2.2 NaHCO3和Na2CO3胁迫对碱茅和披碱草叶片相对电导率的影响
由图3(具体说明同图2图注,其后各图亦然)可知,在同一时间下,碱茅和披碱草叶片相对电导率随NaHCO3和Na2CO3混合物浓度的增加而增加,说明碱茅和披碱草相对电导率变化与混合物浓度有关。在4个检测时间点,25和50 mmol/L浓度处理的披碱草叶片相对电导率与未处理(0 mmol/L)相比均没有差异,而75和100 mmol/L处理的披碱草叶片相对电导率显著高于未处理组。除60 min外,其他时间段中50、75和100 mmol/L处理的碱茅叶片相对电导率均显著高于未处理组。同时,在相同混合物浓度处理下,碱茅与披碱草不同时段的相对电导率差异均分别达到显著水平,见表2;另外,高浓度混合物处理(75和100 mmol/L)的碱茅叶片在90和120 min的相对电导率都高于披碱草。结果说明,NaHCO3和Na2CO3混合物处理损害碱茅和披碱草叶片质膜,且碱茅叶片质膜的受损程度大于披碱草。
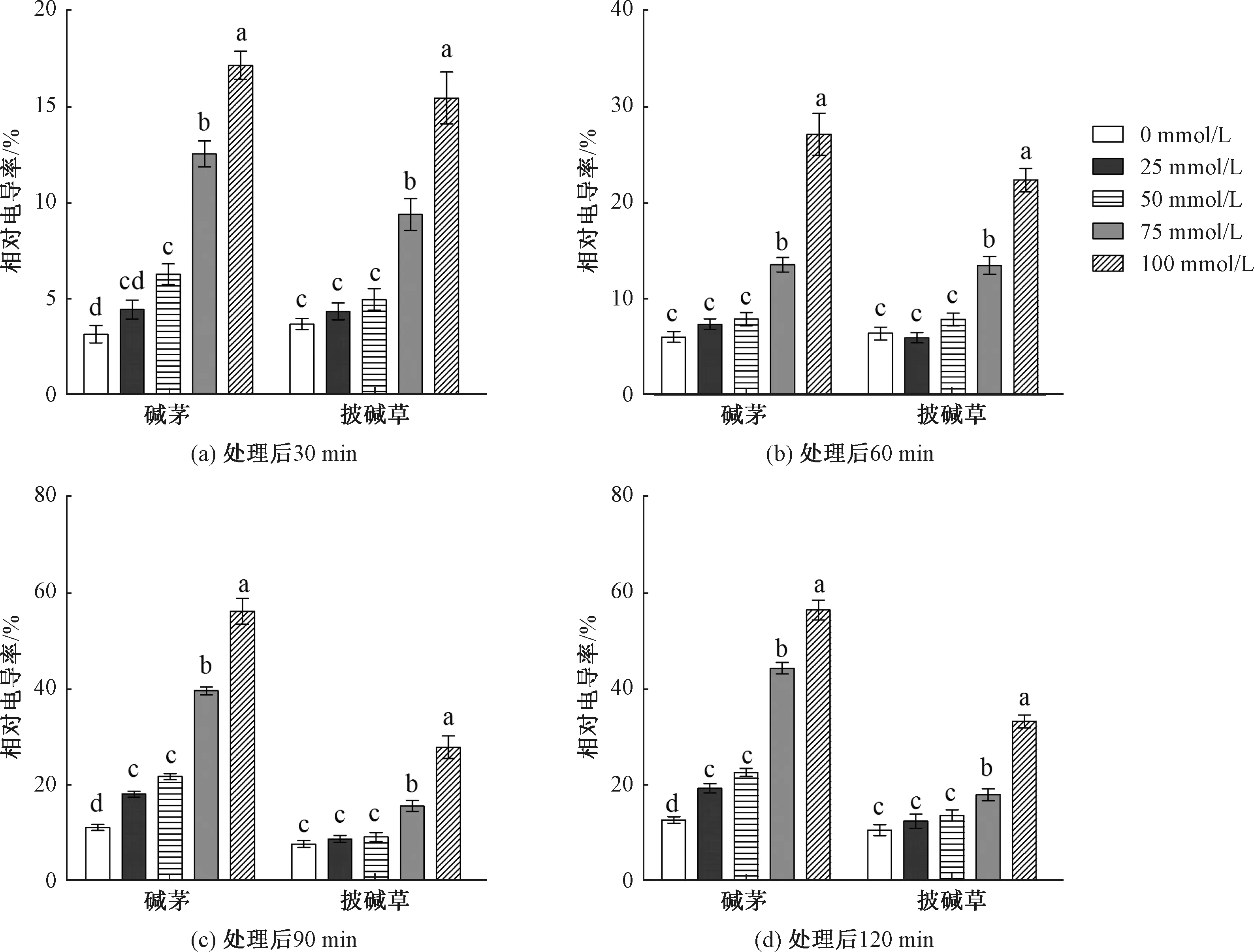
图3 NaHCO3和Na2CO3混合物处理后碱茅和披碱草叶片相对电导率的变化Fig.3 Changes in leaf relative conductivity (%) of P. Chinampoensis and E. dahuricus under NaHCO3 and Na2CO3 mixture treatments
2.3 NaHCO3和Na2CO3胁迫对碱茅和披碱草叶片SOD活性和MDA含量的影响
如图4(a)所示,随NaHCO3和Na2CO3混合物浓度的增加,碱茅和披碱草叶片SOD活性均表现出先升高后下降趋势。在25 mmol/L浓度时,碱茅和披碱草叶片的SOD活性显著高于未处理组。在50 mmol/L浓度下,碱茅和对照处理有显著差异,而披碱草未发生显著下降(p<0.05)。在75和100 mmol/L浓度处理时,与对照处理相比,碱茅叶片SOD活性显著下降(p<0.05),而披碱草叶片SOD活性仅在100 mmol/L处理时才显著低于0 mmol/L,说明在NaHCO3和Na2CO3混合物胁迫下,披碱草更能维持SOD活性。如图4(b)所示,随处理浓度的增加,碱茅和披碱草叶片MDA含量均呈现出升高趋势。同时,在相同混合物浓度处理下,碱茅与披碱草叶片内的SOD活性和MDA含量差异均达到显著水平,见表3;另外,与对照组相比,100 mmol/L处理时的碱茅和披碱草叶片MDA含量与各自的对照组相比分别增加115.68%和95.14%,说明碱茅叶片积累的MDA含量更多。结果表明通过SOD活性和MDA含量分析发现披碱草在NaHCO3和Na2CO3混合物处理下的抗逆性好于碱茅。
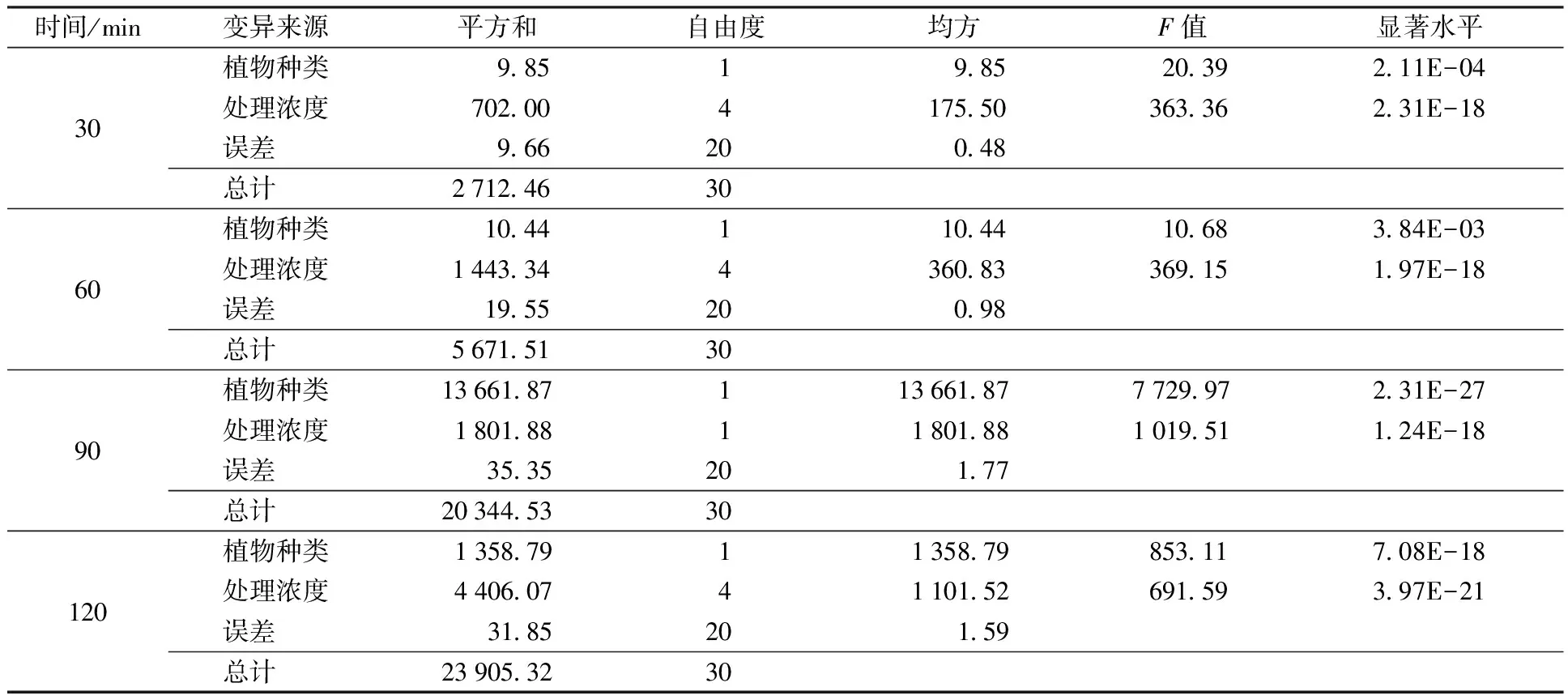
表2 不同浓度的NaHCO3和Na2CO3混合物处理下碱茅和披碱草相对电导率的方差分析Table 2 Variance analysis on leaf relative conductivity under different concentrations of NaHCO3and Na2CO3 mixture treatment

图4 NaHCO3和Na2CO3混合物胁迫下碱茅和披碱草叶片SOD活性和丙二醛含量的变化Fig.4 Changes in leaf SOD activity (a) and MDA content (b) of P. Chinampoensis and E. dahuricus under NaHCO3 and Na2CO3 mixture

表3 不同浓度的NaHCO3和Na2CO3混合物处理下碱茅和披碱草的SOD活性和MDA含量方差分析Table 3 Variance analysis on leaf SOD activity and MDA content of selected materials at NaHCO3and Na2CO3 mixture
2.4 NaHCO3和Na2CO3胁迫对碱茅和披碱草幼苗叶片光合气体交换参数和叶绿素荧光参数的影响
由图5(a)可知,碱茅叶片Pn随混合物浓度的升高而降低,而披碱草叶片Pn仅在75和100 mmol/L时显著低于对照。高浓度的混合物处理(75和100 mmol/L)碱茅和披碱草叶片Gs和Tr显著降低,而碱茅叶片Ci提高;另外,披碱草的Ci只在100 mmol/L处理时才显著高于未处理组,见图5。进一步分析表明,在相同混合物浓度处理下,碱茅与披碱草叶片的4个光合气体交换参数差异分别达到显著水平,见表4。结果说明碱茅叶片光合气体交换参数与披碱草相比更易受NaHCO3和Na2CO3混合物处理的影响。
不同浓度混合物处理对碱茅和披碱草的Fv/Fm没有影响,见图6(a);碱茅与披碱草叶片的Fv/Fm在相同浓度下没有显著差异,见表5。100 mmol/L混合物处理的碱茅和披碱草的ΦPSⅡ均显著低于未处理组,见图6(b)。随着NaHCO3和Na2CO3混合物浓度的增加,披碱草的qP有下降趋势,碱茅的qN呈先下降后升高趋势,而披碱草的qN呈上升趋势,见图6。同时,在相同混合物浓度处理下,碱茅与披碱草叶片的ΦPSⅡ、qP和qN3个叶绿素荧光参数差异都分别达到显著水平,见表5。

图5 NaHCO3和Na2CO3混合物胁迫下碱茅和披碱草叶片光合气体交换参数的变化Fig.5 Changes in leaf photosynthetic gas exchange of P. Chinampoensis and E. dahuricus under NaHCO3 and Na2CO3 mixture
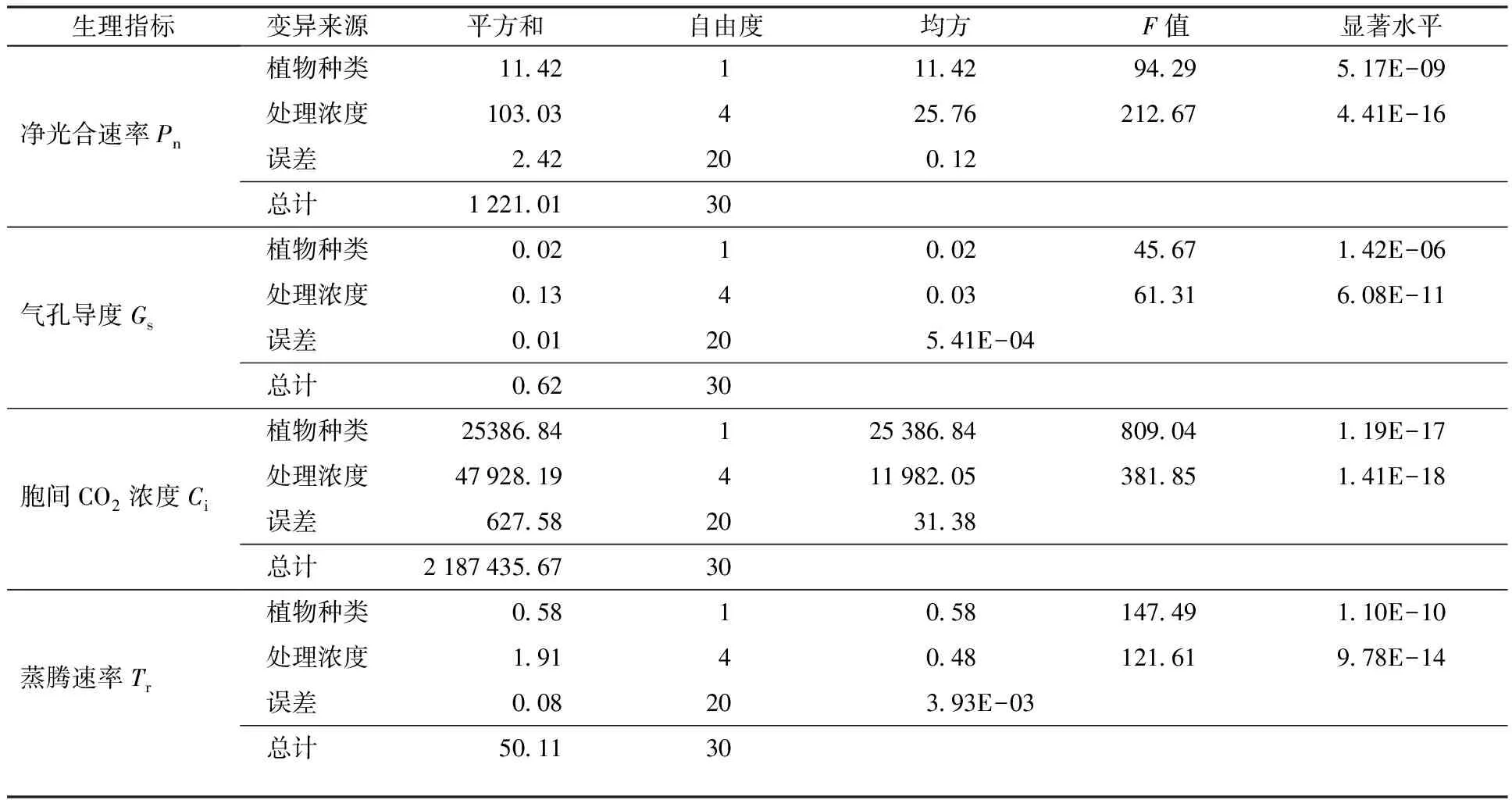
表4 不同浓度的NaHCO3和Na2CO3混合物处理下碱茅和披碱草叶片光合气体交换参数的方差分析Table 4 Variance analysis on leaf photosynthetic gas exchange under different concentrations of NaHCO3 and Na2CO3 mixture treatment
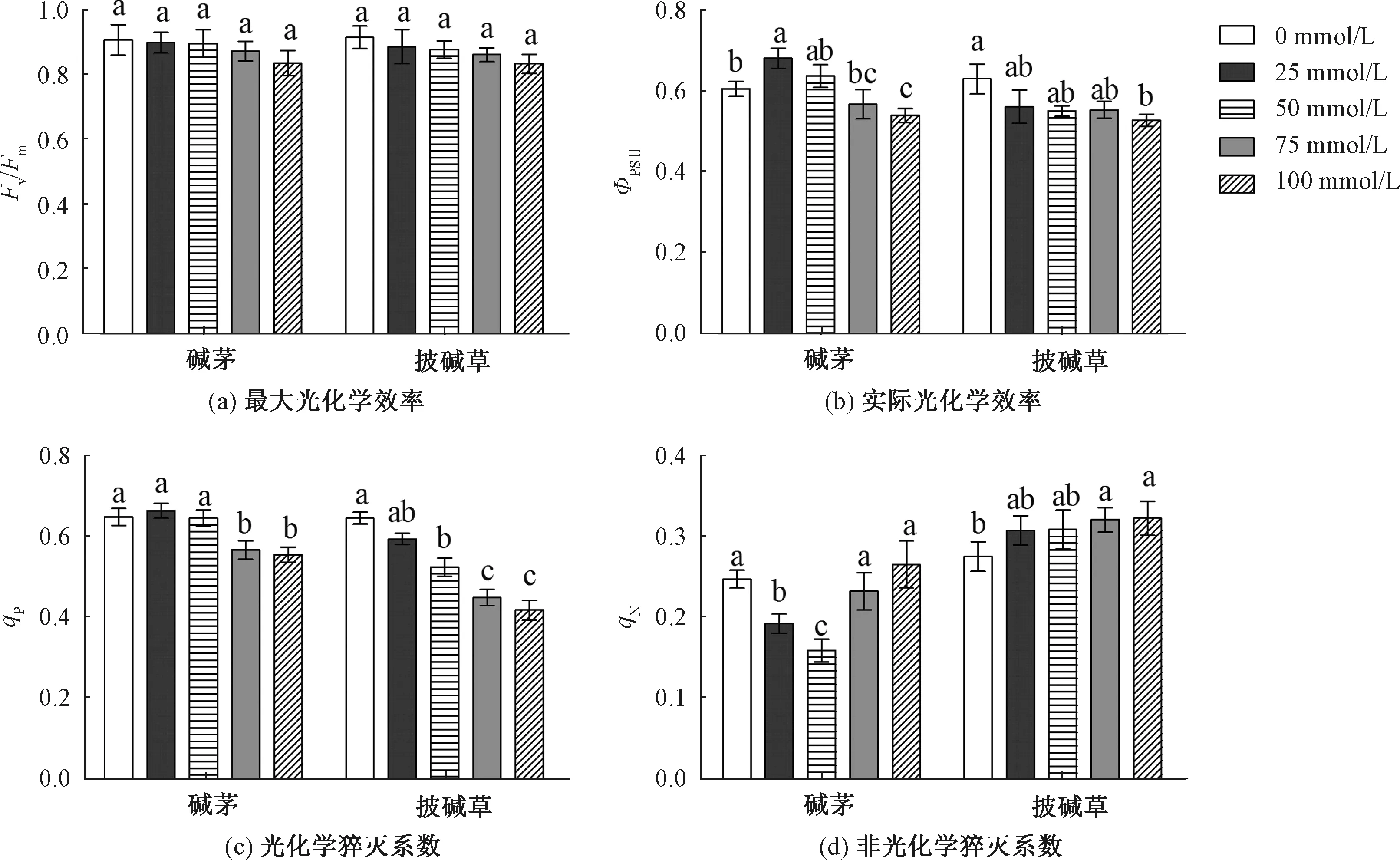
图6 NaHCO3和Na2CO3混合物胁迫下碱茅和披碱草叶片叶绿素荧光参数的变化Fig.6 Changes in leaf chlorophyll fluorescence parameters of P. Chinampoensis and E. dahuricus under NaHCO3and Na2CO3 mixture

表5 不同浓度的NaHCO3和Na2CO3混合物处理下碱茅和披碱草叶绿素荧光参数的方差分析Table 5 Variance analysis of leaf chlorophyll fluorescence parameters under different concentrations of NaHCO3 and Na2CO3 mixture treatment
2.5 NaHCO3和Na2CO3胁迫对碱茅和披碱草幼苗Na+和K+离子含量的影响
与未处理相比,4种浓度NaHCO3和Na2CO3混合物处理显著提高碱茅和披碱草叶片Na+含量,降低叶片K+含量和K+/Na+,见图7;方差分析表明,在相同混合物浓度处理下,碱茅与披碱草叶片的Na+含量差异达到显著水平,见表6。从图7可以看出,高浓度混合物(75和100 mmol/L)处理显著提高碱茅根系Na+含量,降低碱茅和披碱草根系K+含量和K+/Na+;进一步分析发现,在相同混合物浓度处理下,碱茅与披碱草的根中K+含量和K+/Na+差异都分别达到显著水平,见表6。同时,随着混合物浓度的升高,碱茅的限Na+能力升高,而25 mmol/L的混合物处理显著降低披碱草的限Na+能力,见图7(g)。说明NaHCO3和Na2CO3混合物处理均影响碱茅和披碱草叶片和根系的钾钠离子平衡,激活碱茅的限Na+能力。
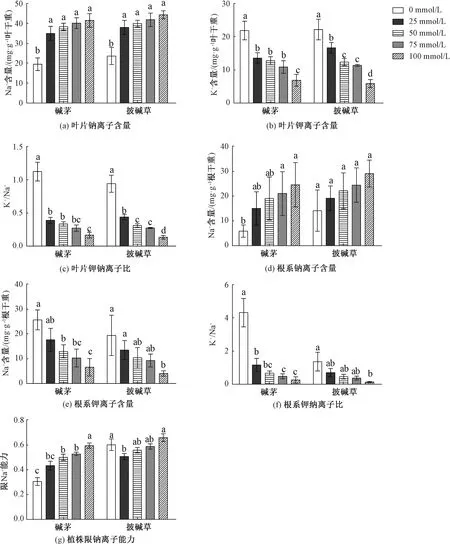
图7 NaHCO3和Na2CO3混合物胁迫下碱茅和披碱草Na+和K+离子含量的变化Fig.7 Changes in contents of Na+ and K+ of P. Chinampoensis and E. dahuricus under NaHCO3 and Na2CO3 mixture
3 讨论
盐碱胁迫是影响植物生长和发育的一个重要环境因子,虽然盐碱胁迫会抑制植物的生长发育,但是其抑制作用的大小取决于植物对盐碱的耐受程度[19]。一般而言,渗透效应是盐碱抑制植物种子萌发的主要原因,随着盐浓度的升高,种子萌发受到的抑制程度加重[25-26]。幼苗期是植物生长的关键时期,也是对盐碱胁迫较为敏感的时期,幼苗期的营养物质积累直接关系到植物后期对胁迫环境的适应性[27]。种子发芽率随盐浓度升高而降低外,本研究还发现,在不同浓度NaHCO3和Na2CO3混合物胁迫下均能调查到碱茅和披碱草种子萌发,说明碱茅和披碱草均具有潜在的耐盐碱能力[19]。前人研究发现NaCl、NaHCO3、Na2SO4和Na2CO3能抑制植物干物质的积累[28],在本研究中,不同浓度的NaHCO3和Na2CO3混合物处理均造成碱茅和披碱草地上部和地下部干重的降低,说明碱茅和披碱草光合同化物的积累受到碱性盐的抑制。
植物生物膜结构的稳定性与抗逆性密切相关。丙二醛(MDA)是膜脂过氧化的产物,膜脂过氧化造成细胞水解加速,膜的透性增加,从而导致电导率增加[29]。前人发现,随着盐碱浓度的提高,大麦和小麦幼苗叶片的电解质外渗率和MDA含量增加,盐分浓度越大,细胞膜透性越大,最终导致膜系统破碎[30-31]。本实验中,碱茅和披碱草叶片的相对电导率和MDA含量随NaHCO3和Na2CO3混合物浓度的增加而升高,说明NaHCO3和Na2CO3混合物破坏碱茅和披碱草叶片质膜的稳定性,损害膜结构,造成细胞内电解质渗漏,加重膜脂过氧化。其中随着处理浓度的增加,碱茅的叶片相对电导率和MDA上升趋势均大于披碱草,说明披碱草抗性好于碱茅。
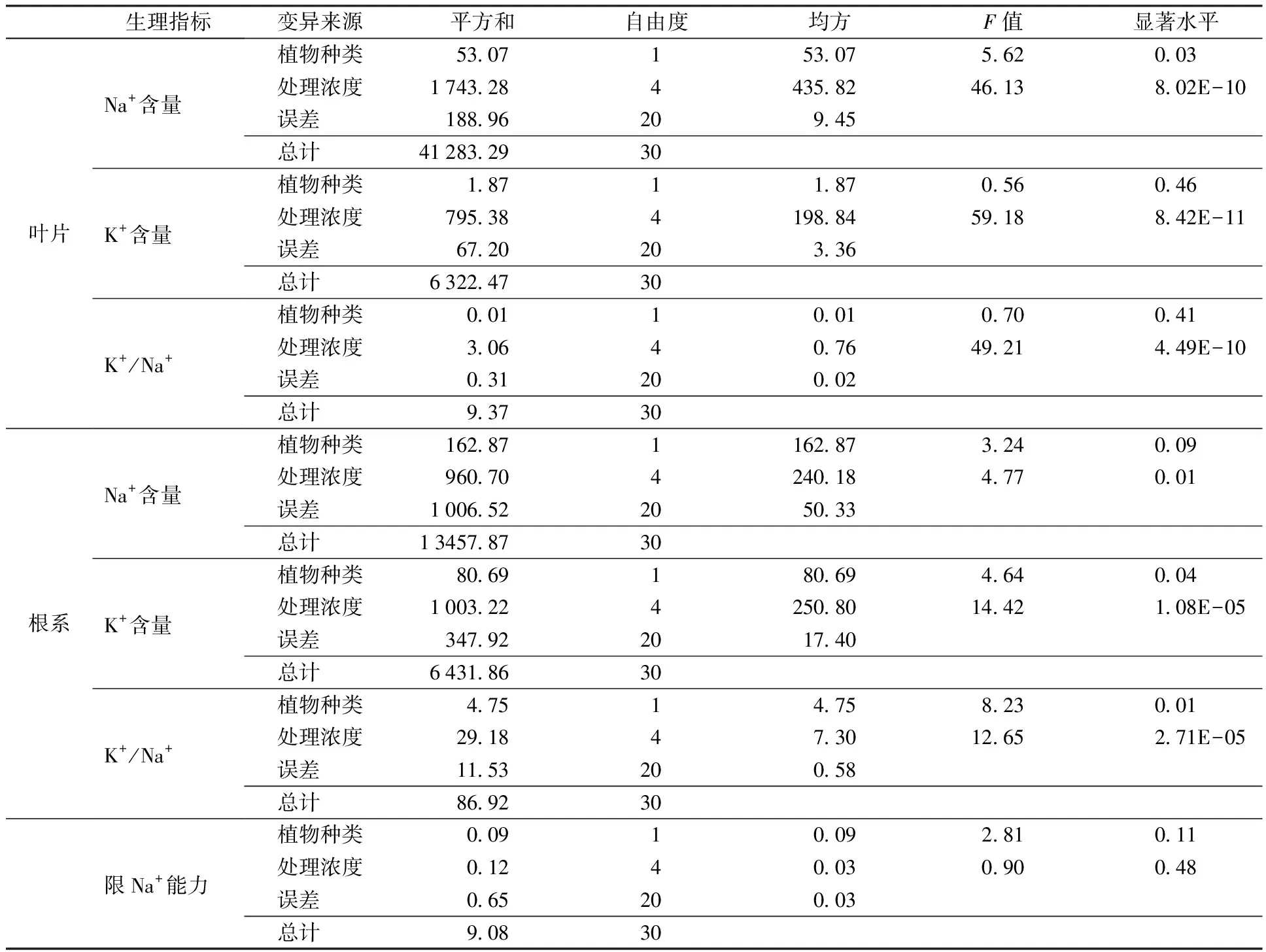
表6 不同浓度NaHCO3和Na2CO3混合物处理下碱茅和披碱草Na+和K+离子的方差分析Table 6 Variance analysis of Na+ and K+ contents under different concentrations of NaHCO3 and Na2CO3 mixture treatment
净光合速率(Pn)反映单位叶面积的碳同化能力,前人研究表明,净光合速率的降低与植物受碱性盐胁迫的伤害程度有关[32]。叶片气孔部分关闭导致的气孔限制和叶肉细胞光合活性下降导致的非气孔限制均会造成Pn降低,且盐碱胁迫程度较低时Pn下降多为气孔因素影响,而当盐碱胁迫程度较高时Pn下降受非气孔因素以及气孔因素和非气孔因素协同影响[33]。本研究发现,高浓度的碱性盐(75和100 mmol/L)对碱茅和披碱草叶片的Pn抑制作用明显,同时伴随着气孔导度(Gs)、蒸腾速率(Tr)的降低和胞间二氧化碳浓度(Ci)的升高,说明高浓度碱性盐胁迫造成的净光合速率下降是由气孔因素和非气孔因素共同造成的,这与前人研究结果一致[34]。此外,过量浓度处理破坏了碱茅和披碱草叶片碳同化能力。
PSII原初反应的最大量子效率Fv/Fm和电子传递量子效率(ΦPSⅡ)是调查植物对逆境胁迫响应的重要参数和判断植物是否受到光抑制的重要指标[35]。本研究中,虽然披碱草和碱茅的Fv/Fm没有受混合物影响,但是ΦPSⅡ和qP在100 mmol/L混合物处理时均显著降低,说明高浓度的碱性盐胁迫抑制光系统Ⅱ反应中心的潜在活性。非光化学淬灭系数(qN)可用来衡量植物过剩激发能耗散[36]。虽然碱茅的qN随着混合物浓度的增加先下降后上升,但是没有高于对照处理,而披碱草的qN在高浓度时显著高于对照处理,表明披碱草更能提高热耗散消耗来适应碱性盐胁迫。前人研究发现,高浓度碱性盐胁迫通过抑制光系统II反应的中心活性最终导致植物净光合速率的降低[27]。本研究中,100 mmol/L混合物处理显著降低了碱茅和披碱草ΦPSII,这可能是两种植物Pn下降的原因。
超氧化物歧化酶(SOD)是最主要的一种抗氧化酶,是植物体内清除活性氧的第一道防线,当植物处于盐碱胁迫时,SOD对维持活性氧的平衡起到重要作用,其活性大小与植物抗逆性密切相关[37]。有研究发现,SOD活性随着盐碱胁迫度的增加而增加[38-39]。本研究中,低浓度混合(25和50 mmol/L)处理时,碱茅和披碱草的SOD活性升高趋势,说明碱茅和披碱草的抗氧化酶发挥了清除活性氧的功能。而当100 mmol/L混合物处理时,碱茅和披碱草的SOD活性显著降低,说明混合物的胁迫程度已经超出两种植物的抗氧化能力。披碱草在75 mmol/L混合物处理没有抑制披碱草SOD活性,碱茅在50 mmol/L处理下SOD受抑制。披碱草的MDA含量在50 mmol/L浓度下含量与对照相比无明显差异,而碱茅在这个浓度下显著高于对照,这里说明披碱草抗性强于碱茅。
植物Na+和K+代谢是其适应盐渍环境最为重要的生理代谢活动,当环境中Na+含量增高时,会拮抗植物对K+的吸收,从而限制植物生长[40-41]。本研究发现,碱茅和披碱草的叶片和根系Na+离子含量随着碱性盐浓度的升高而升高,而K+离子含量和K+/Na+则呈现出相反趋势。植物限制根向叶片转运Na+的能力是其耐受盐碱胁迫的机制之一[42]。本研究中,碱茅限Na+能力随着NaHCO3和Na2CO3混合物浓度的升高而升高,NaHCO3和Na2CO3混合物对披碱草限Na+能力影响不大,说明NaHCO3和Na2CO3胁迫激活了碱茅的限Na+能力,碱茅好于披碱草的限Na+能力。
综上,NaHCO3和Na2CO3胁迫抑制碱茅和披碱草种子萌发和幼苗干物质积累,提高叶片相对电导率和丙二醛含量,降低叶片净光合速率和电子传递量子效率,对两种植物的正常生长造成伤害。同时,不同浓度混合物处理下,披碱草与碱茅相比更能维持SOD酶活性,且MDA含量以及质膜损伤程度均低于碱茅。因此实验结果揭示披碱草在碱性盐混合物胁迫下的抗逆性好于碱茅。本实验丰富了我们对碱茅和披碱草响应NaHCO3和Na2CO3胁迫机制的理解,对于今后在中国东北盐碱土地区的生物修复及推广种植披碱草具有理论指导意义。
猜你喜欢
杂志排行
中国科学院大学学报的其它文章
- Heterogeneous oceanographic exploration system based on USV and AUV:a survey of developments and challenges
- 衬垫与箱壁间空隙对苹果预冷效果的影响*
- 水足迹视角下的农业生产空间布局
——以天山北麓农产品主产区为例* - 多用户毫米波大规模MIMO系统中收发端联合的混合波束成形设计*
- 随机介质背景下的空频TR-MUSIC成像方法*
- Stochastic Poisson integrators based on Padé approximations for linear stochastic Poisson systems*
