6种园林树木对持续性淹水胁迫的生理响应及其比较
2021-03-16张文豹周忠胜王津宁金雅琴
张文豹,周忠胜,曾 雷,王津宁,金雅琴
(1.南京滨江公园管理有限公司,江苏南京210019;2.金陵科技学院园艺学院,江苏南京210038)
植物生长过程中需要大量水分,但土壤水分过多反而会阻碍植物与大气环境间的气体交换,造成植物组织缺氧和生理伤害,严重影响植物的生长发育[1]。据报道,淹水胁迫通过减缓叶片和根系生长、降低水分与矿质营养吸收、改变叶绿素含量和组分、破坏光合机构的结构与性能等,降低植物光合同化能力,进而抑制其生长和生物量积累[2-3]。大量研究表明,林木在遭遇水涝胁迫下自身往往会产生一定的形态和生理反应,以适应水涝对自身生理生长的不良影响[4-5]。但是,不同树木对水涝胁迫的生理反应有所不同,表现的抗水涝能力也不尽相同。如方贵荣[6]的研究表明,枫香树(Liquidambar formosana)幼苗在胁迫60 d的情况下仍生长良好,长势显著优于对照,表现出很强的耐涝性,表明枫香树可以作为耐水湿树种应用;陈桂芳等[7]的研究表明,持续淹水胁迫对水松(Glyptostrobus pensilis)生理生化指标产生了明显的影响,水松表现出较强的适应水生环境的能力,可在水库库岸、河岸及湖岸等水位容易波动的湿地种植;胡燕莉等[8]对油用牡丹‘凤丹’(Paeonia ostii)的研究表明,水淹后油用牡丹‘凤丹’叶片净光合速率、蒸腾速率、气孔导度及根系活力均较对照组显著下降,且下降幅度随着水淹时间的延长而增大,油用牡丹‘凤丹’对水淹胁迫的应答迅速且灵敏,但不耐水淹[8]。因此,深刻认识树木的的耐涝性,了解不同树种在遭遇胁迫条件的生理适应性,对于河岸带园林功能植物的选择和景观配置十分有用,不仅有利于提高水岸带园林植物选配的科学性、合理性,而且对丰富城市水岸带植物的多样性,改善城市园林建设的施工质量具有重要意义。本文以6种常见园林乔木树种为研究对象,对不同树种受涝后外部形态及生理特征进行观察,比较了不同树种对水涝胁迫的应答,为城市园林耐水涝树种的选择提供基本理论依据。
1 材料与方法
1.1 试验材料
试验材料为榔榆(Ulmus parvifolia)、榉树(Zelkova papyrifera)、朴树 (Celtis sinensis)、女贞(Ligustrum lucidum)、枇杷(Eriobotrya japonica)、珊瑚树(Viburnum odoratissimum)。苗源来自江苏省林业科学研究院实验林场,均为2年生实生苗。春季上盆栽培,盆径15 cm,园土作基质,于2019年7月1日开始水淹处理。每天定期观察耐水淹情况,记录叶片受损及胁迫情况。
1.2 测定方法
试验地点在金陵科技学院园艺学院实验站,试验时间为2019年7~9月。淹水期间,观察6种不同树木的形态变化,分阶段测定样本的生理指标。每次采样均取0.5 g生长一致的叶片指标测定。游离脯氨酸采用磺基水杨酸法提取,并用茚三酮比色法测定其含量[9];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法[10];相对电导率的测定应用DDS0-11A型直读电导仪测定。上述指标测定时均设3次重复,以作统计分析。
1.3 数据处理与评价
不同处理用SPSS17.0软件进行方差分析,多重比较采用t检验法;抗性评价采用隶属函数法(Method of subordination function)[11-12]。
2 结果与分析
2.1 淹水条件不同树种的外观形态变化
淹水条件下6种不同树木的形态变化记录见表1。
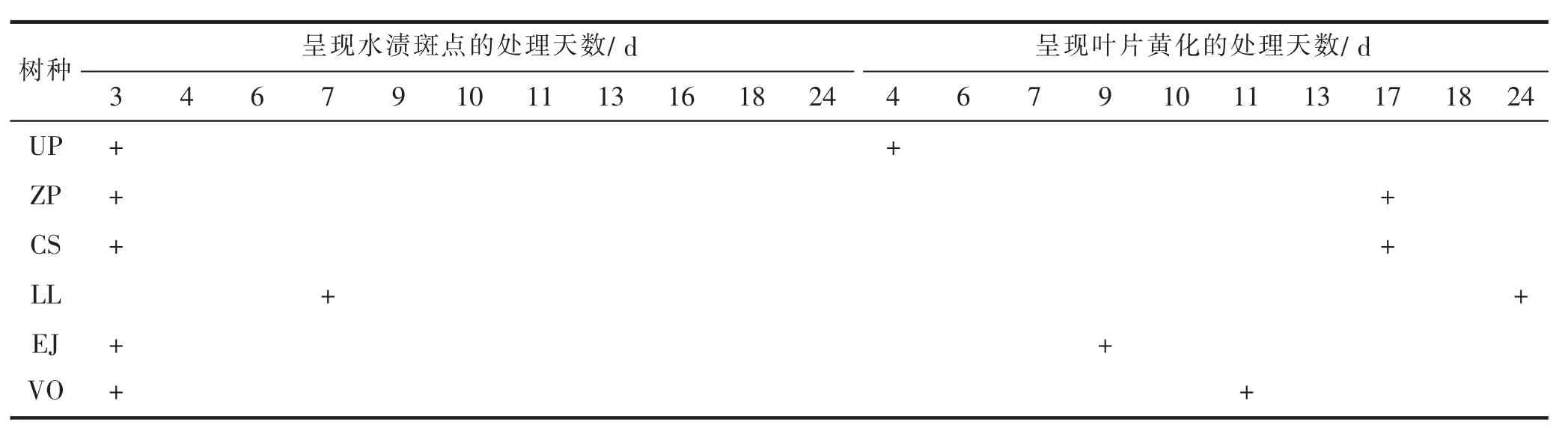
表1 淹水条件下不同树种呈现水渍斑点及叶片黄化的处理天数Tab.1 Days showed water stains spots and leaves yellowing of different tree species under flooding stress
水淹第3天时,榔榆、榉树、朴树、枇杷、珊瑚树均开 始呈现不同程度的受涝症状,叶缘、叶背面中脉或者侧脉不同程度的褐斑点,生长开始受到影响。常绿树种女贞开始呈现症状较晚,直到处理第7天时才出现了水渍斑点。就不同树种出现黄化的时间来看,榔榆出现症状最早(第4天),枇杷为第9天,珊瑚树为第11天;出现叶片黄化症状较晚的树种是榉树、朴树,两者出现的天数均为第17天;常绿树种女贞处理期几乎未出现黄化症状。观察发现,不同树种尽管早期呈现一定的水涝受害症状,但一般短期内不会立刻死亡,表现出一定的耐水性。
2.2 淹水条件下不同树种生理指标的变化
2.2.1 淹水条件不同树种叶片游离脯氨酸含量的变化
研究表明,植物叶片在逆境条件下游离脯氨酸含量增加是一种普遍的生理现象,对植物自身来说是一种生理适应,对植物起到缓冲保护作用[12]。因此,分析植物在淹水胁迫下叶片游离脯氨酸含量的变化趋势对比较不同植物的耐水性具有一定参考意义。
水淹条件下,不同树种叶片中的游离脯氨酸含量变化见图1。结果表明,水淹胁迫下,6树种叶片的游离脯氨酸含量存在显著差异。榉树、朴树的游离脯氨酸含量变化呈现几乎一致的变化态势,即前期游离脯氨酸略有下降,但随着淹水持续时间的延长其测定值则缓慢上升,并于试验终期(24 d)出现极值(分别为906.93、521.20μg·g-1),不同处理期游离脯氨酸含量存在显著差异(P<0.05);榔榆在整个淹水期间其游离脯氨酸含量测定值始终是上升的;珊瑚树在整个淹水期间其游离脯氨酸含量变化很小,几乎呈现一直线型变化,不同处理期游离脯氨酸含量差异不显著(P>0.05);女贞、枇杷两树种的游离脯氨酸含量变化尽管数值大小变化大,但趋势基本一致,即先期呈现高值,随着淹水时间的延长,其值开始下降,直至整株死亡。
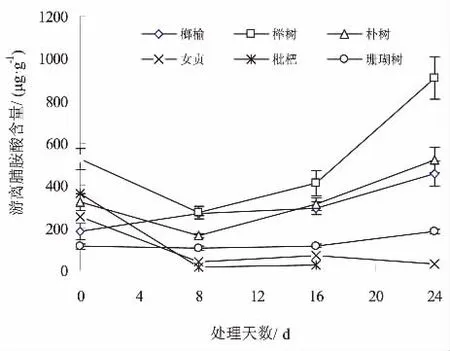
图1 淹水条件下不同树种叶片游离脯氨酸含量的变化Fig.1 Changes of free proline content in leaves of different tree species under flooding
2.2.2 淹水条件不同树种叶片丙二醛(MDA)含量的变化
MDA是膜脂过氧化的最终产物,通常将其作为脂质过氧化指标,用于表明细胞膜脂过氧化程度和植物对逆境胁迫反应的强弱[1]。MDA含量的多少可以间接地表示植物膜的受损状况,并兼有反馈作用[12]。水淹条件下,不同树种叶片中MDA含量的变化见图2。从图2可以看出,榔榆在淹水期间的MDA含量一直高于处理开始期的测定值,并于淹水第13天时MDA含量最高(0.009 μmol·g-1),但在处理末期(24 d)其值略有下滑(0.006 μmol·g-1),不同处理期MDA含量存在显著差异(P<0.05);。而榉树和朴树的MDA含量变化则呈现先期下降后期缓慢上升的钩型变化态势,尤以朴树的MDA含量上升态势较为明显(淹水第24天时MDA含量为0.013μmol·g-1);淹水试验期间枇杷的MDA含量变化很小,整体呈现下降的态势;女贞的MDA含量变化前期几乎呈一直线,但试验后期却急剧抬升,并达到极值(0.021μmol·g-1)。方差分析表明,不同树种在同一处理时间点叶片MDA含量均存在显著差异(P<0.05)。
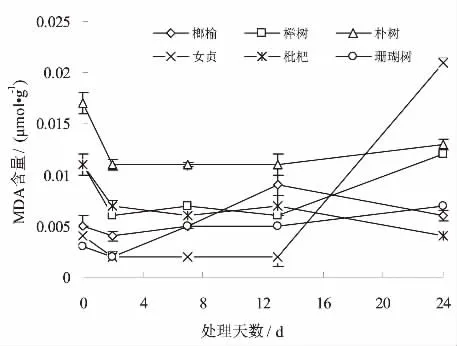
图2 淹水条件下不同树种叶片MDA含量的变化Fig.2 Changes of content of malondialdehyde in leaves of different tree species under flooding
2.2.3 淹水条件不同树种叶片超氧化物歧化酶(SOD)活性的变化
为抵御淹水胁迫条件下活性氧自由基的毒害作用,植物经过长期的进化与适应,形成了相应的抗氧化防御系统[13]。超氧化物歧化酶(SOD)是植物抗氧化保护系统的第一道防线,对植物遭受逆境状态下的反应较为敏感,主要功能是清除O2-,是防护氧自由基对细胞膜伤害的一种主要保护酶[14]。不同树种叶片中超氧化物歧化酶(SOD)活性的变化见图3A。
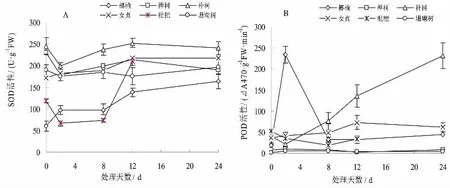
图3 淹水条件下不同树种叶片SOD及POD活性的变化Fig.3 Changes of SOD and POD activity of different tree species under flooding
从图3A中曲线变化的来看,不同树种叶片中SOD活性的变化态势存在显著不同。尽管有一定的波动,但是榔榆在整个淹水期间SOD活性明显上升,其淹水第22天时叶片中SOD活性为163.32 U·g-1FW,为淹水始期SOD活性(60.56 U·g-1FW)的2.69倍,表明淹水胁迫下榔榆叶片抗氧化保护酶的活性反应极为敏感;榉树、朴树两树种在整个淹水期SOD活性存在波动变化,淹水早期SOD活性下降,但后期随着淹水时间的延长,淹水末期的SOD活性仍高于试验始期;淹水期间枇杷的SOD活性变化较为剧烈,淹水初期(第2天)SOD活性微降(66.43 U·g-1FW),但处理第12天时SOD活性则显著增加(209.91 U·g-1FW),并显著高于淹水初期的SOD活性(P<0.05);女贞、珊瑚树在整个淹水期SOD活性变化较为平缓,差异不显著,且两树种的SOD活性前期较为接近,但在后期整体上其活性仍然是趋于上升的。
2.2.4 淹水条件不同树种叶片过氧化物酶(POD)活性的变化
过氧化物酶(POD)的作用具有双重性,一方面是在逆境中清除O2-,表现为保护效应,为细胞活性氧保护酶系统的成员之一;另一方面,POD也在逆境中参与活性氧的生成、叶绿素的降解,并引发膜脂过氧化作用,表现为伤害效应[12,15]。
从图3B可以看出,在淹水条件下不同树种的POD活性(△A470·g-1FW·min-1)变化曲线显著不同。淹水条件下朴树叶片POD活性均显著的增加趋势,淹水第24天其POD活性为231.50,为淹水初期(第2天)的10.68倍。淹水条件下POD活性增加以有效地清除O2-,体现了朴树自身的自我保护。方差分析表明,不同处理期朴树叶片POD活性呈现极显著差异(P<0.01)。榔榆叶片中POD活性变化最为剧烈,不同处理期朴树叶片POD活性呈现极显著差异(P<0.01)。淹水始期,叶片中POD活性为19.33,但处理后第2天叶片中POD活性快速上升至为233.83,为淹水处理期的最高值,但随着淹水处理的延续,POD活性剧烈下降,处理末期(第24天)POD活性略高于处理开始期。女贞在淹水后POD活性缓慢上升,并在第12天时POD活性最大(217.29),但在后期淹水处理期间叶片的POD活性始终变化很小。在整个处理期,枇杷、榉树和珊瑚树3树种POD活性差异不显著(P>0.05)。
2.2.5 淹水条件下不同树种叶片叶绿素含量的变化
叶绿素是植物光合作用的载体,叶绿素含量的多少在一定程度上反映了植物光合作用强度的高低,从而影响植物的生长。近年研究表明,逆境胁迫可能破坏植物组织的叶绿体结构,使得叶绿素含量下降,引起植物光合作用能力降低[1],但树种不同其影响效应有所不同,体现出不同树种对逆境胁迫的适应能力有不同。
淹水条件下不同树种叶片中叶绿素含量(a+b)的变化见表2。表中可见,淹水条件下所有树种叶片中叶绿素含量均随淹水时间的延长而有所下降,但是下降的幅度和下降速度有所不同,说明淹水对处理树种的叶片组织内叶绿体的合成造成一定的影响。榔榆是叶片中叶绿素变化幅度最大的树种,淹水第2天叶绿素含量为0.940 mg·g-1FW,但第8天其值降至0.374 mg·g-1FW,淹水条件下不同处理时期绿素含量呈现极显著差异(P<0.01)。榉树和枇杷2树种在不同处理时期叶绿素含量变化不大,但不同处理时期叶绿素含量仍呈现显著差异(P<0.05),所以淹水对榉树和枇杷两树种的光合色素仍然存在一定的影响。淹水对朴树和女贞叶片叶绿素含量的初期影响较小,不同处理时间叶绿素含量无显著差异(P>0.05),但随着处理时间的延长,叶绿素含量显著下降。淹水初期,珊瑚树叶片中叶绿素含量呈现短期上升,但随着淹水时间的延长其含量下降,但下降幅度不大。
就同一时期不同树种叶绿素含量绝对值来看,不同树种的叶绿素测定值存在显著差异(P<0.05),这是不同树种之间的生物学特性所决定的,体现了遗传因素对植物色素的形成客观上存在决定性作用。
2.3 淹水胁迫条件下不同树种的抗性比较
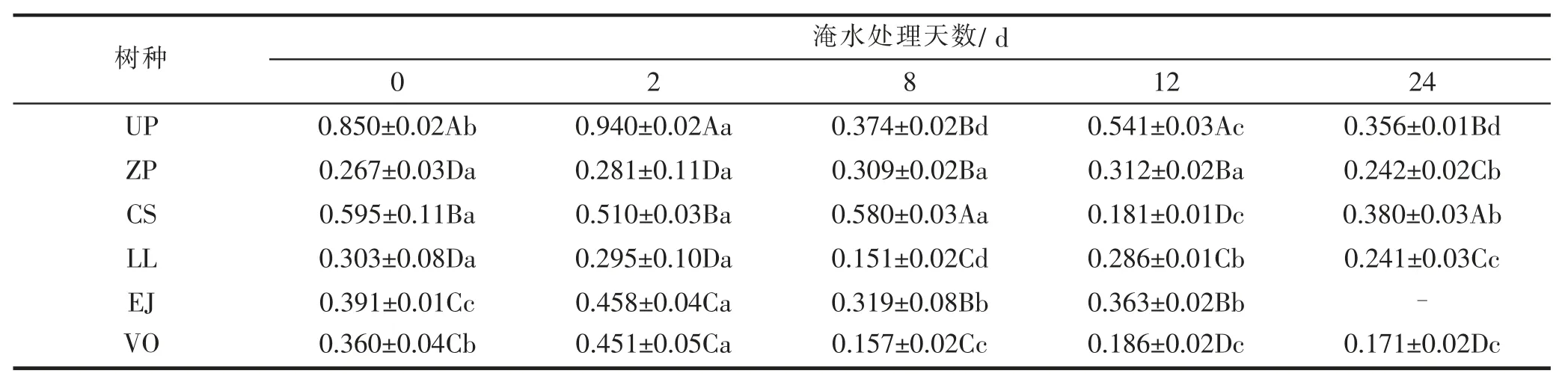
表2 淹水条件下不同树种叶片叶绿素含量(a+b)的变化Tab.2 Changes of chlorophyll content(a+b)in leaves of different species under flooding(mg·g-1 FW)
在淹水胁迫条件下,不同树种各种生理指标的变化存在差异,这反映了不同树种对淹水胁迫适应途径的多样性和复杂性。因此,单一的任何指标都很难准确地评判不同树种抗性的强弱。而运用数学方法将多项指标进行综合考虑,才能客观地比较不同树种在淹水胁迫下的抗性差异。依据文献资料,本研究采用Fuzzy隶属函数法对淹水条件下不同树种耐涝性的测定指标进行综合评判,其评判结果见表3。就本试验测得的5项生理参数进行隶属函数判断,6种树木的耐涝性排序大致为:女贞、枇杷、珊瑚树、朴树、榉树、榔榆。
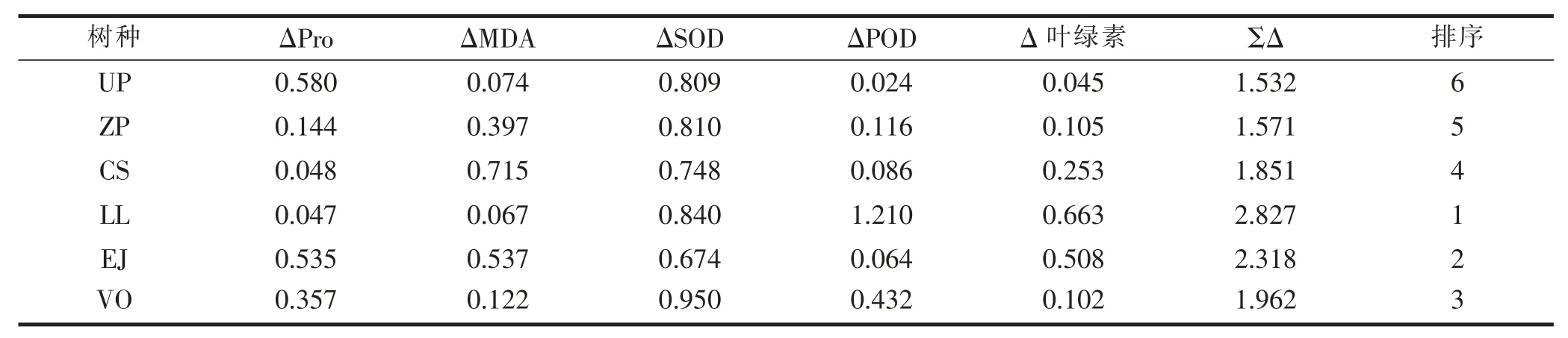
表3 淹水胁迫下不同树种耐涝性的综合评判指标Tab.3 Comprehensive evaluation of waterlogging tolerance of different species under flooding
3 结论与讨论
1)植物在长期的自然选择过程中,一定的生态环境必然会留下选择的烙印,加上其分布区生境的复杂性,促进了植物不同群体间的生物学特性的分化[12]。植物应对淹水胁迫的伤害会涉及形态、解剖和生理代谢等多个方面[16-17],但形态变化是最直观最明显的特征。Schmull等[18]认为,相对于生理适应,形态的变化对植物抵御长时间淹水胁迫的意义更大。本研究表明,持续淹水条件下不同树种对逆境的反应特性存在一定的差异,表现为呈现水渍斑点出现的早晚和黄化叶落的时间有所不同,表明不同树种对抵御涝泽所呈现的反应特征和生理伤害程度有所不同,这些特征可以作为野外判定耐涝性最简单的形态依据。
2)淹水胁迫引起的植物伤害大多数与组织内的活性氧伤害有关,而植物体往往通过提高自身SOD、POD等酶的活性来清除由胁迫而产生的大量自由基,以增强其抗逆性[19]。植物在遭受逆境胁迫时往往通过改变自身SOD、POD、CAT等酶的活性抵御外界对自身的伤害[12],但不同植物其酶活性的改变态势不完全相同。一般认为,淹水情况下,缺氧使植物体内积累了较多的活性氧自由基,抗氧化酶活性的提高将有利于清除自由基,减轻细胞受到伤害,这是多数植物对淹水胁迫的一种适应性表现[20]。但试验表明,淹水胁迫下不同树种两种保护酶(SOD和POD)活性呈现出不同的变化态势。其中,榔榆叶片抗氧化保护酶的活性反应最为敏感,表现为淹水初期SOD活性的显著上升和POD活性的剧烈增加,这与秋茄(Kandelia obovata)[21]、银杏(Ginkgo biloba)[22]的研究结果基本一致。但是,后期两种保护酶活性趋于平缓变化,在长期淹水胁迫时这种结果可能源于涝害的持续导致靠活性氧的清除对植物的抗涝机能可能已经无法发挥作用。
一般来说,耐淹能力强的植物在遭受水涝时,体内的SOD、POD活性会显著升高,以清除植物在淹水胁迫下积累的活性氧[20-21]。女贞、珊瑚树在整个淹水期SOD、POD活性的变化相对较为平缓,不同处理期的测定值差异均不显著,说明淹水胁迫下女贞、珊瑚树两树种清除活性氧的自我调节能力不强。植物在长期与当地水热和土壤等环境条件的适应过程中,不同树种已经形成了各自比较稳定的抗逆适应机理,不同生理参数的相互协调,保证了植物个体在逆境中的存活生长。
3)脯氨酸为植物生存提供足够的自由水和化学生理活动物质,在植物自我调节中表现异常活跃。尽管对于不同植物来说,脯氨酸积累在逆境中的生理作用及机理还不完全清楚,但脯氨酸含量的增加可以增强细胞的渗透调节能力,这对提高植物的逆境抗性是有益的[22]。本试验中,榉树、朴树的游离脯氨酸含量变化呈现几乎一致的变化态势,即前期游离脯氨酸略有下降,但随着淹水持续时间的延长其测定值则缓慢上升,说明短期的水涝胁迫未对榉树、朴树的生理造成大的影响,但淹水持续一段后游离脯氨酸含量则明显上升,脯氨酸含量增加,说明2植物在持续淹水条件下叶肉细胞具有一定的渗透调节能力,客观上增强了其对淹水逆境的适应性。而女贞、枇杷叶片中游离脯氨酸含量变化尽管数值大小变化大,但趋势基本一致,即先期下降,随着淹水时间的延长,其游离脯氨酸含量一直处于低度变化,直至整株死亡,说明2树种在淹水胁迫下细胞的渗透调节能力偏弱。
4)细胞膜是植物细胞与外界的第一道防线,它的稳定性直接影响到植物细胞的代谢功能[12]。榔榆在淹水初期MDA含量明显上升,并于淹水第13天时MDA含量最高,榉树和朴树的MDA含量变化则呈现先期下降后期缓慢上升的变化,而枇杷和女贞的MDA含量变化几乎呈一直线变化,说明不同树种在淹水胁迫条件下,其细胞膜的受伤害程度不同,对逆境胁迫的脂膜反应不同,这种不同的反应在一定程度上可作为不同植物耐涝性的指标依据[23]。
5)淹水条件下所有树种叶片叶绿素含量均随淹水时间的延长而下降,说明淹水对6树种的叶片组织内叶绿体的合成均造成一定的生理影响,淹水胁迫加速了受淹植物叶片叶绿素的降解,进而影响植物的光合作用效率,导致植物叶片黄化、凋落、枯萎。根据不同树种在持续淹水条件下的外部形态表现,并结合生理指标测试结果可以看出,不同树种的耐涝能力还是存在显著差异的,这是由于不同树种自身生物学特性的差异造成的。综合以上指标进行隶属函数分析,主要木本植物耐涝性排序大致为:女贞、枇杷、珊瑚树、朴树、榉树、榔榆。如此研究结果可以为城市生态环境建设中园林树种的选择提供基本的理论参考。
