TACE联合CT-RFA序贯治疗膈顶部肝癌的疗效及安全性
2021-03-13天津市第二人民医院放射科导管室300192
徐 静 天津市第二人民医院放射科导管室 300192
原发性肝癌是临床常见恶性肿瘤之一,是威胁中老年人群生命安全的癌性死亡重要原因。目前,影像学引导下经导管动脉化疗栓塞术(TACE)、经皮射频消融术(RFA)以及外科手术切除等是治疗原发性肝癌的主要手段,均能起到灭活或消除肿瘤病灶,延长患者生存时间及提高预后的作用[1-2]。由于超声对大部分肝硬化结节与肝癌的鉴别难度大,同时受到肝周围包绕组织的影响,选用CT扫描能更清楚显示膈顶部肝癌病灶[3]。因此,笔者选取我院2018年1月—2019年1月期间收治的膈顶部肝细胞癌患者82例,采用TACE联合CT引导下RFA(CT-RFA)对患者进行序贯治疗,获得满意的疗效。现报道如下。
1 资料与方法
1.1 一般资料 选取我院2018年1月—2019年1月期间收治的膈顶部肝细胞癌患者82例(病灶数共107枚)为观察对象。纳入标准:经B超、CT 或 MRI 等检查符合《原发性肝癌诊疗规范(2017年版)》[4]中原发性肝癌相关诊断标准,患有肝硬化、乙型肝炎、丙型肝炎病史,血清甲胎蛋白进行性升高,单个肿瘤直径<5cm或多发肿瘤最大直径<3cm,研究经我院伦理会批准,患者及家属均知情并签署同意书。排除标准:有淋巴结或肝外转移,明显胆管浸润,TACE或RFA手术禁忌,无法进行手术切除或不愿手术者。其中,男52例,女30例;年龄44~75岁,平均年龄(57.56±5.37)岁;肝功能Child-pugh分级:A级55例,B级27例;单发病灶48例,多发病灶34例;单个肿瘤直径0.9~5.0cm,平均直径(3.11±1.02)cm;其中,45枚直径3.0~5.0cm,62枚直径<3.0cm。
1.2 治疗方法
1.2.1 TACE治疗:术前完善影像学及相关血液学检查,明确肿瘤准确位置及大小。患者取仰卧位,在数字减影血管造影(DSA)引导下,采用Seldinger穿刺技术行右侧股动脉穿刺并插入导管进入肝总动脉,依据肿瘤大小及门脉直径情况,选择常规碘化油造影,注射速率4~6ml/s,总量20ml。根据DSA对肿瘤的显影情况,明确肿瘤病灶大小、数量、供血血管走向以及是否存在动静脉瘘等,选择适量超乳化碘化油混合表阿霉素30~40mg,表柔比星15mg,奥沙利铂50~80mg,替加氟500mg进行栓塞治疗,完成后使用明胶海绵栓塞病灶近端血管。术后重复造影了解各病灶栓塞范围及碘化油沉积情况,对于栓塞不彻底或无肿瘤染色情况者给予必要的栓塞补充治疗,术后4周复查,如若残留,重复进行1次TACE治疗,如残留活性病灶,给予CT-RFA治疗。
1.2.2 CT-RFA治疗:采用美国Olympus RFA系统,常规心电监护,术前肌内注射哌替啶100mg及盐酸异丙嗪25mg,取仰卧或侧卧位,根据增强 CT扫描结果确定进针方向、角度及深度,常规消毒铺巾及2%利多卡因局部麻醉后,CT引导下将17G射频消融针经皮穿刺至肿瘤病灶中心部位,根据活性病灶大小和位置,设置消融范围、消融功率、消融温度、消融次数及消融时间等,结束后对针道一并消融,防止病灶针道转移及出血。术后即刻 CT复扫描病灶消融情况,术后腹带加压固定,给予止血,常规预防感染,观察患者是否有气胸、腹腔出血等并发症并积极进行对症处理。
1.3 疗效评价 术后即刻行CT扫描,根据低密度灶范围覆盖病灶情况(完全覆盖)及消融边缘至病灶距离(5~10mm)即评为消融成功;术后3、6、12个月,根据CT或超声复查结果评价疗效情况,其中,肿瘤所在区域CT结果为低密度或超声结果为高回声,动脉期未见强化为完全消融,否则为不完全消融;根据 CT 测量结果,以公式V=πabc/6cm3(V:体积,a:长径,b:短径,c:高径)计算肿瘤体积变化[5]。
1.4 安全性评价 观察术后患者有无气胸、腹腔内出血、周围脏器受累等并发症。

2 结果
2.1 TACE治疗结果 82例患者经DSA检查后共发现107枚病灶,其中,单发病灶位于肝左叶12例,均位于Ⅳ段;单发于肝右叶36例,Ⅴ段4例,Ⅵ段11例,Ⅶ段13例,Ⅷ段8例,多发病灶34例,共59枚;TACE首次治疗4周后,64枚病灶内碘油密实完全充填,43枚病灶内部分碘油沉积;再次经TACE治疗后,57例病灶内碘油密实完全充填,50枚病灶内部分碘油沉积。复查可见36例出现残留,间隔4周后进行CT-RFA治疗。
2.2 CT-RFA治疗结果 36例存在残留的患者进行CT-RFA治疗,单发11例(11枚病灶),多发25例(39枚病灶),消融时间为(20.29±4.46)min,治疗后4周复查,可见消融区域为低密度灶,消融病灶内部及边缘无强化,同正常组织界限清晰(见图1)。本次治疗共107枚病灶中,98枚完全坏死,坏死率为91.59%。
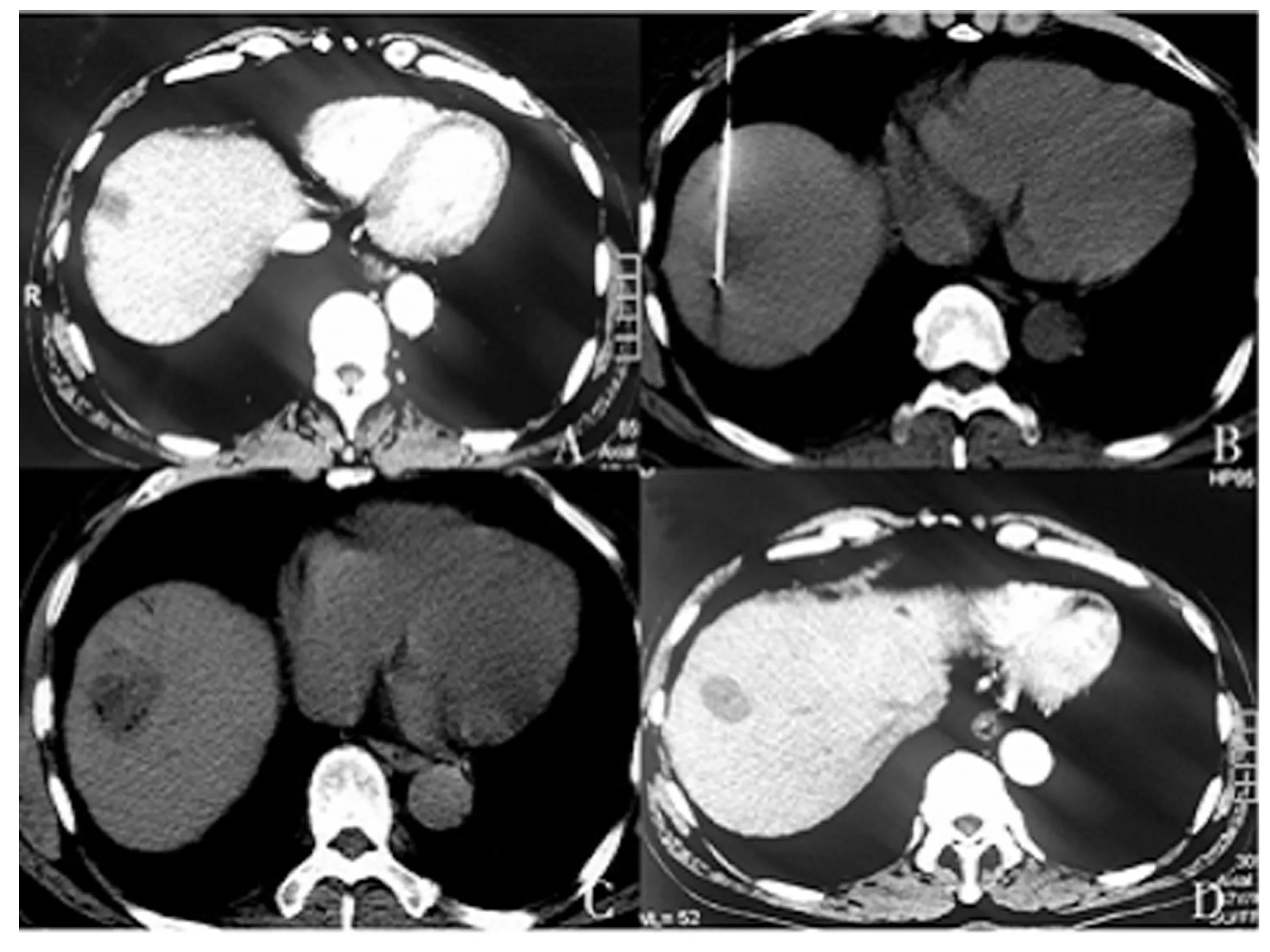
图1 CT-RFA治疗A.CT-RFA前可见边缘强化 B.CT-RFA穿刺、治疗过程C.CT-RFA后即刻扫描 D.CT-RFA治疗4周后CT扫描结果:病灶无增强,与正常组织界限清晰
2.3 治疗后肿瘤体积变化 术前及术后 3、6、12 个月的肿瘤体积分别为(14.25±9.44)cm3、(20.17±16.50)cm3、(16.78±11.24)cm3、(10.55±7.67)cm3,相较于术前,术后12个月肿瘤体积明显缩小,差异有统计学意义(t=2.788,P=0.006)。
2.4 临床并发症情况 治疗期间出现气胸6例,肝包膜下出血10例,发热7例,上腹疼痛8例,所有并发症经对症处理后明显缓解或消失。
3 讨论
RFA是近年来临床上治疗局部性小肝癌的有效手段,由于其操作简单、微创,且可进行反复治疗的特点,新一期肝癌治疗指南已将其作为局部性肝癌、中晚期肝癌的一线治疗手段,其疗效几乎与手术切除相当。报道显示,超声及CT引导下RFA在临床较为常见,超声可实时成像,使用起来简单方便,但对于膈顶、尾状叶等特殊部位的显现效果较差,而通过CT进行断层扫描,可清楚显示上述特殊部位的肿瘤病灶[6]。近年来,CT引导下RFA在小肝癌的临床治疗中具有广泛应用,其疗效已被广泛认可。目前,临床上对于无法手术切除或RFA治疗的大肝癌均首选TACE进行治疗,在DSA技术引导下,通过碘油栓塞肿瘤主要供血血管,从而造成大部分肿瘤缺血性坏死,起到消灭肿瘤细胞的作用,但同时由于双重供血及侧支循环的存在,往往需多次 TACE治疗方可提高治疗效果[7]。有文献指出[8-9],由于DSA对原发性小肝癌的诊断灵敏度高于CT,故在DSA引导下,先行TACE治疗,可消除大部分病灶及以往未发现的微小病灶,术后再应用RFA可起到很好的补充作用。两者联合能提高临床治疗效果。
本文中,82例(107枚病灶)膈顶部肝癌患者经TACE治疗后大部分坏死,但仍有残留情况。首次TACE治疗后,64枚病灶内碘油密实完全充填,43枚病灶内部分碘油沉积;再次TACE治疗后,57例病灶内碘油密实完全充填,50枚病灶内部分碘油沉积,复查可见36例出现残留。在TACE治疗4周后经CT-RFA治疗,病灶消融完全,107枚病灶中,98枚完全坏死,坏死率为91.59%。术后12个月肿瘤体积明显缩小,与术前比较差异有统计学意义(P<0.05)。结果提示,TACE联合CT-RFA治疗膈顶部肝癌的近期疗效显著。同扈鑫荣等[10]相关报道结果基本一致。安全性方面,由于术中的反复穿刺,易造成气胸及肝包膜出血,故穿刺时需尽量减少穿刺次数,提高穿刺质量,可有效减少气胸及肝包膜出血发生[11]。此外,术后有发热及上腹疼痛发生,但对症处理后均缓解或消失。
综上所述,TACE联合CT-RFA序贯治疗膈顶部肝癌的近期疗效满意,并发症少,安全性高,值得临床推广和应用。
