镉对体外培养鸡骨髓基质细胞成骨分化的毒性作用
2021-03-12赵玉田王果帅张雪晴李赛慧闵雯嫣刘宗平顾建红
赵玉田,王果帅,张雪晴,李赛慧,闵雯嫣,刘宗平,顾建红*
(1. 扬州大学兽医学院,江苏 扬州 225009;2. 江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
镉是一种不易分解的重金属环境污染物,其生物半衰期为10~30年,进入环境后不能被微生物降解,并可通过食物链蓄积在体内[1-2]。急性或慢性镉暴露能引起肝肾及骨骼等多种器官和组织的损伤。因此,镉的研究愈来愈广泛。骨作为镉毒性作用的主要靶器官之一,接触高浓度镉会降低骨密度(bone mineral density,BMD),通常表现为骨质疏松、关节炎等症状[3]。近年来,由于工业的快速发展,大气和饲料中的镉污染日益严重,对动物健康造成了极大的威胁[4]。
骨髓基质细胞(bone marrow stromal cells,BMSCs)是一种骨髓多能细胞,在体内处于相对静止状态,当受到各种生理或病理刺激时能分化为成骨细胞(osteoblast,OB)、软骨细胞、脂肪细胞、心肌细胞和骨骼肌细胞等[5-6]。BMSCs纯化需时短,并可在体外迅速扩增,作为骨髓微环境的重要组成成分,对于维持正常的骨代谢具有极其重要的作用[7-8]。镉引起骨质疏松的确切机制尚不清楚[9]。有文献报道,氯化镉可促进人BMSCs的成脂分化、抑制其成骨分化[10]。大鼠试验结果表明,低剂量的镉可以通过RANKL/OPG信号下调BMSCs的成骨分化基因[11],也可通过Wnt/β-catenin通路抑制BMSCs的成骨分化[12]。然而,人和大鼠属于哺乳类动物,其骨骼与家禽存在差异。禽类骨骼中空,壁薄而轻,不仅在支撑机体中发挥重要作用,在蛋壳形成中亦发挥重要作用。目前,镉对禽类BMSCs成骨分化的研究未见报道。本研究将在诱导鸡胚来源BMSCs成骨分化基础上,加入不同浓度的醋酸镉,观察其对鸡体外培养BMSCs成骨分化的影响,为禽类骨代谢失衡疾病的研究奠定基础。
1 材料与方法
1.1 实验动物
SPF鸡蛋由山东济南鑫盛达科技有限公司购入,在扬州大学兽医学院内科实验室孵化至18日龄。
1.2 鸡胚BMSCs的分离与培养
无菌条件下,分离鸡胚股骨、胫骨,用不含血清的α-MEM培养基冲出骨髓,冲至发白,300目滤网过滤,离心留沉淀于管底的细胞,用α-MEM培养基(含10%FBS)重悬,以3×106个/mL密度接种于细胞瓶,37 ℃、5%CO2,饱和湿度的培养箱中培养。
BMSCs在24 h完全贴壁,换液去除未贴壁细胞,待细胞长至80%~90%时,进行传代培养。α-MEM培养基先于37 ℃水浴加热15 min,取出细胞瓶,在超净台内缓慢弃去培养基,用磷酸盐缓冲液(phosphate buffered solution,PBS)清洗2次,再用预热的0.25%胰酶37 ℃消化,在显微镜下观察至细胞间连接消失时,加入含有10%胎牛血清的α-MEM培养基终止消化,用胶头滴管缓慢吹下贴壁细胞,PBS清洗后用含10%胎牛血清的α-MEM培养基重悬细胞,计数,以3×106个/mL接种于细胞瓶,置于37 ℃,5%CO2,饱和湿度的培养箱中培养。
1.3 鸡BMSCs的形态学观察及成骨分化能力检测
取第二代鸡BMSCs,以每孔3×105个接种于六孔板,待长至75%左右改为成骨诱导液(10%FBS、地塞米松10 nmol/L、β-甘油磷酸钠10 mmol/L、抗坏血酸50 μg/mL的DMEM),诱导7 d时,进行碱性磷酸酶(alkaline phosphatase,ALP)染色,诱导21 d时进行矿化结节茜素红染色并拍照记录。
1.4 流式细胞仪检测BMSCs特异性表面标志物
第二代细胞长至约80%时,弃去培养基,PBS洗2次,加入2 mL胰蛋白酶消化30 s,含10% FBS的α-MEM培养基终止消化,收集细胞,1 000 r/min,离心10 min,PBS洗2次,用100 μL PBS重悬。对照组不加任何抗体,实验组分别加入2 μL 抗体(CD44-FITC、CD45-PE、CD44-FITC和CD45-PE),冰上孵育30 min后加入1 mL PBS清洗2次,用300 μL PBS重悬细胞转移至流式管,FACS LSRFortessa流式细胞分析仪检测。
1.5 CCK-8法检测增殖率
取第二代细胞,按照上述方法传至96孔板(接种密度7 500个/孔),待其长至75%左右,改为成骨诱导培养基(10%FBS、地塞米松10 nmol/L、β-甘油磷酸钠10 mmol/L、抗坏血酸50 μg/mL的DMEM),并加入0,1,2,5,10和20 μmol/L的醋酸镉处理72 h,按照CCK-8试剂盒说明书,在450 nm处采用酶标仪测定吸光度值。
1.6 ALP染色测定ALP活性
取第二代细胞以每孔3×105个细胞接种至6孔板,待长至75%左右改为成骨诱导培养基(10%FBS、地塞米松10 nmol/L、β-甘油磷酸钠10 mmol/L、抗坏血酸50 μg/mL的DMEM),并加入0和5 μmol/L的醋酸镉,处理72 h,按BCIP®/NBT液体底物系统试剂盒操作。
1.7 实时荧光定量PCR
取第二代细胞以每孔3×105个细胞接种至6孔板,待长至75%左右改为成骨诱导培养基(10%FBS、地塞米松10 nmol/L、β-甘油磷酸钠10 mmol/L、抗坏血酸50 μg/mL的DMEM),并加入0、5、10和20 μmol/L的醋酸镉,处理72 h,TRizol裂解法提取各组总RNA。使用qPCR仪检测成骨相关标志分子:Runt相关转录因子2(Runx2)、ALP、成骨细胞特异性转录因子(osterix,OSX)、骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)、Ⅰ型胶原(type Ⅰ collagen,COL1);破骨细胞生成和抑制因子:核因子κB受体活化因子配体(RANKL)和骨保护素(osteoprotegerin,OPG)mRNA表达水平。以GAPDH为参照,按照RT-PCR Kit进行qRT-PCR反应。引物序列见如表1。

表1 成骨相关基因引物序列
1.8 数据分析
所有数值均使用GraphPad Prism软件分析作图,数据用“平均值±标准差”表示。P<0.05表示组间差异显著,P<0.01表示组间差异极显著。
2 结果
2.1 BMSCs形态观察及成骨分化能力检测
刚接种的原代BMSCs呈圆形,24 h后开始贴壁,贴壁细胞呈梭形,体积增大但混有大量红细胞、白细胞等不贴壁椭圆形或圆形细胞。传至第一代,细胞形态趋于均一,纺锤形细胞增多,圆形细胞减少。传至第二代细胞形态更加均一,纺锤形细胞占80%以上(图1)。成骨诱导培养基培养7 d ALP染色结果显示,细胞呈紫黑色(图2)。成骨诱导至21 d时,茜素红染色可见橘红色的矿化结节形成(图3)。

图1 鸡BMSCs形态(100×)

图2 鸡BMSCs ALP 染色(100×)
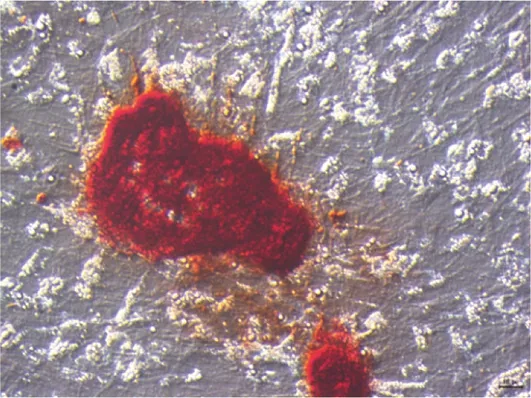
图3 矿化结节茜素红染色(100×)
2.2 流式检测特异性标志物
流式细胞术检测第二代BMSCs,结果显示,CD44(64.9%)为阳性(图4),CD45(0.5%)为阴性(图5),符合基质细胞表型特征。
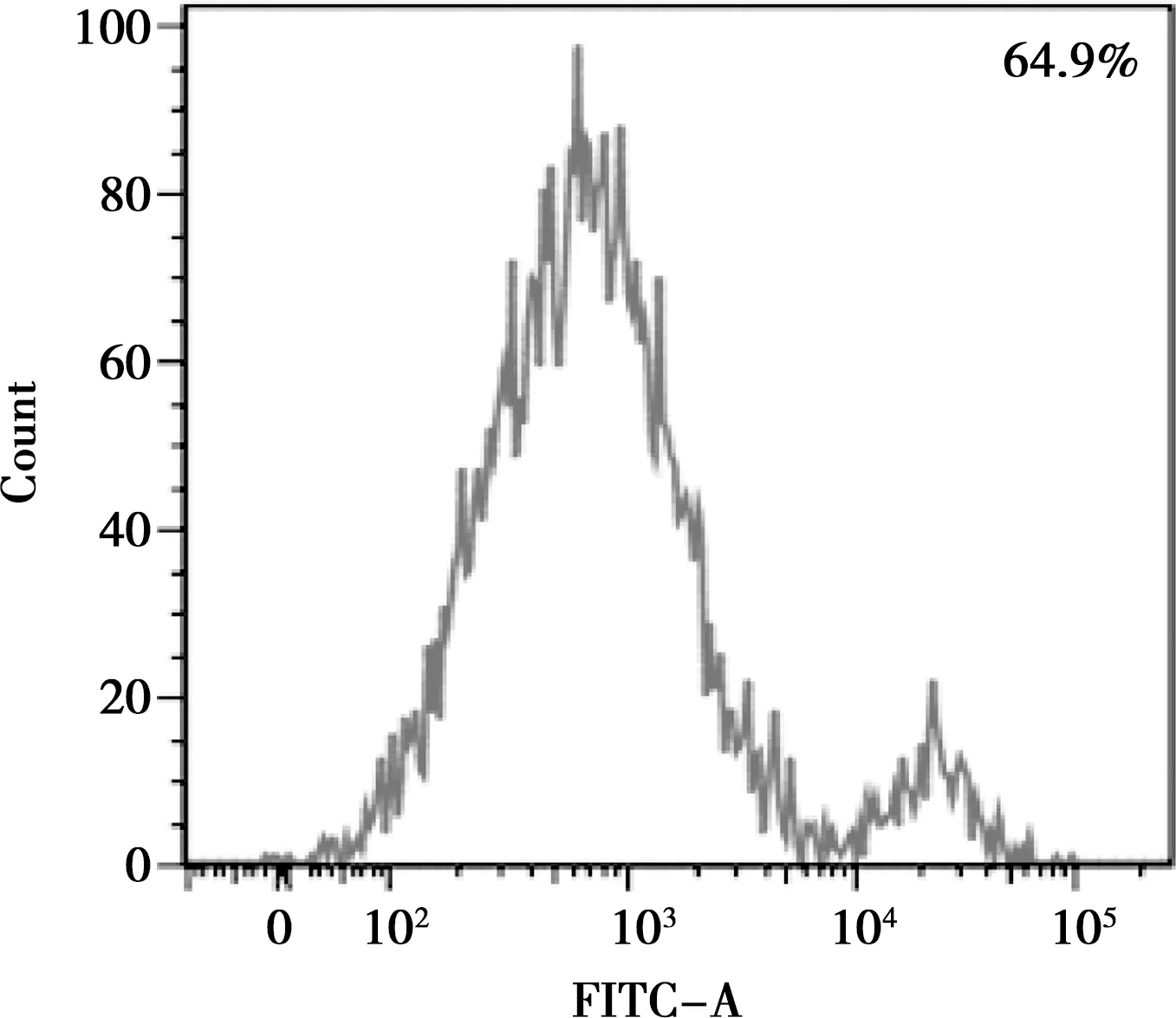
图4 CD44-FITC
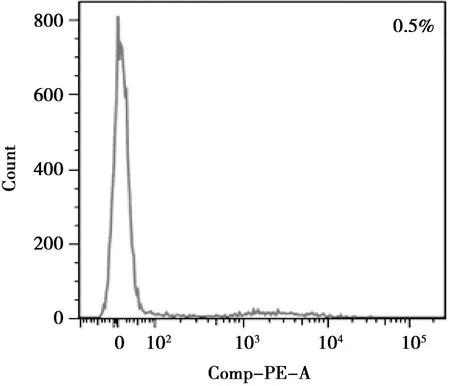
图5 CD45-PE
2.3 镉对BMSCs增殖率的影响
CCK-8法检测不同浓度醋酸镉处理72 h的细胞增殖率,以确定醋酸镉的细胞毒性。结果显示,低浓度的镉对细胞的存活率有显著的促进作用(P<0.05),当醋酸镉浓度达到20 μmol/L时,可显著抑制细胞活力(P<0.05)(图6)。
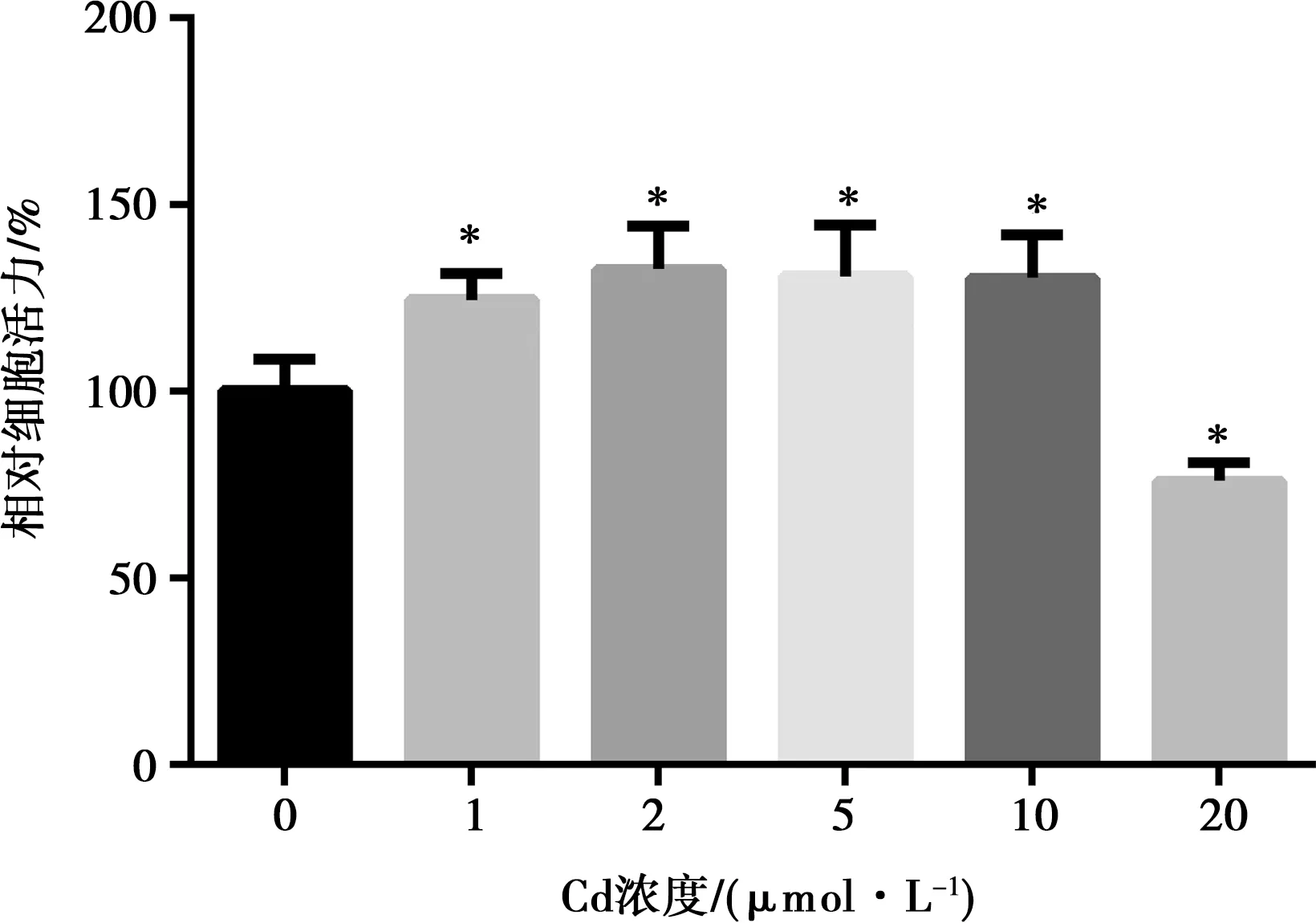
注:*表示与空白对照组比较,差异显著(P<0.05)
2.4 镉对BMSCs成骨分化过程中ALP活性的影响
ALP染色法检测细胞碱性磷酸酶的活性,结果显示,空白对照组细胞存在大量紫黑色的染色颗粒(图7A),醋酸镉处理组紫黑色面积较少(图7B),说明镉处理组ALP活性明显降低。
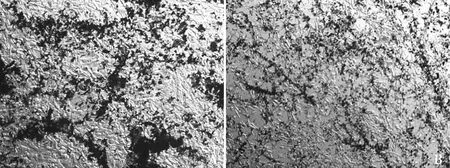
A. 空白组;B. 镉处理组
2.5 RT-PCR检测OB相关基因
荧光定量PCR结果显示,OPN、COL1、Runx2、OSX、ALP、OCN和OPG mRNA的表达量随着镉浓度的升高剂量依赖性降低,除了5 μmol/L镉组OPN差异不显著外,其余各组差异均极显著(P<0.01)(图8A-H)。RANKL mRNA的表达量呈浓度依赖性升高,差异均极显著(P<0.01)(图8A~H)。

A. OPN mRNA的相对表达;B. COL1 mRNA的相对表达;C. Runx2 mRNA的相对表达;D. OSX mRNA的相对表达;E. ALP mRNA的相对表达;F. OCN mRNA的相对表达;G. OPG mRNA的相对表达;H. RANKL mRNA的相对表达。**表示与对照组比较差异极显著(P<0.01)
3 讨论
目前报道BMSCs分离的方法不止一种,包括差速贴壁分离法、密度梯度离心和流式细胞术分离法等[13]。王翔毅等[14]发现体外密度梯度离心法和贴壁静置可以获得大量高度均一、表型符合BMSCs的细胞。根据BMSCs与其他细胞贴壁能力、沉降速度的差异,首次换液时间格外重要,接种后24 h通过首次全量换液以防止杂细胞贴壁,传代时控制胰酶消化时间为30 s[15]。目前还没发现BMSCs的特异表面标志,主要根据其可表达CD44、CD54、CD106等间质内皮细胞标志,但不表达CD34、CD45等造血细胞标志进行鉴定[16-18]。本试验采用全骨髓差速贴壁法,接种后24 h全量换液,待其长至80%时,传代培养。原代细胞可见大量圆形或椭圆形杂细胞,传至第一代时圆形细胞减少,细胞呈典型的纺锤形,体积较大,边缘光亮,可稳定传代培养。成骨诱导培养基培养第二代BMSCs 7 d细胞ALP染色阳性,培养21 d可形成矿化结节。流式细胞术检测显示第二代细胞CD44阳性,CD45阴性,符合BMSCs特征。表明本试验获得的细胞为鸡BMSCs,可用于下一步试验。
镉作为重要的环境重金属污染物,可增加人和动物骨质疏松的风险[19]。高剂量的镉可明显损害大鼠胫骨骨微结构[20]。早期研究表明,镉的骨毒性继发于肾损伤,尤其肾小管损伤可致肾小管钙、磷重吸收障碍;同时维生素D活化受损,继发钙、磷代谢异常,引发骨丢失和骨质疏松症状[21]。最近研究表明,镉可直接作用于OB,引起骨损伤[22]。然而,镉是否影响禽BMSCs成骨分化,从而导致骨骼疾病仍不清楚。OB发育包括活化增殖期、细胞外基质成熟期和基质矿化期3个阶段。ALP是OB成熟及活性的标志[23]。Runx2是促进骨形成的关键调控因子,为成骨分化早期标志物。OSX是Runx2在成骨过程中的下游靶点,激活COL1A1和OCN的转录,实现骨形成[24]。OCN由成熟的矿化OB合成,是OB分化中晚期标志物,其可通过与钙及羟基磷灰石结合促进骨形成[25]。OPN主要表达于骨形成晚期,调控矿化组织的重建[26];此外,表达于OB或BMSCs的RANKL/OPG信号是近20年发现的调控破骨细胞生成和骨溶解的关键信号轴[27]。因此ALP、RUNX2、OSX、COL1A1、OCN、OPN的表达水平反映着BMSCs的成骨分化能力,RANKL和OPG表示骨吸收能力。本研究在体外诱导鸡BMSCs成骨分化过程中用不同浓度醋酸镉处理,观察了镉对BMSCs增殖及上述成骨标志物表达的影响。结果显示,低浓度(≤10 μmol/L)镉显著促进BMSCs增殖,高浓度(大于10 μmol/L)镉显著抑制BMSCs增殖;然而,5 μmol/L镉暴露均可显著或极显著下调成骨相关指标(COL1、OSX、RUNX2、ALP、OCN、OPN)以及OPG的表达,上调RANKL基因的表达,且呈剂量依赖效应。研究表明,镉能够抑制体外培养鸡BMSCs向OB的分化,低浓度镉对BMSCs增殖的促进作用主要是反馈调节引起。
