蟹味菇原生质体高压电晕电场诱变的初步研究*
2021-03-12冯婷婷郭九峰宋天磊刘超雄
冯婷婷,刘 利,郭九峰,宋天磊,刘超雄
(内蒙古大学物理科学与技术学院,内蒙古 呼和浩特 010021)
蟹味菇(Hypsizygus marmoreus)属担子菌亚门(Basidiomycotina)伞菌目 (Agaricales)白蘑科(Tricholomataceae)玉蕈属(Hypsizigus),又名真姬菇、玉蕈等,是外形美观、口感独特的食药兼用的珍稀食用菌,具有高营养价值和保健价值,在市场上颇受欢迎。其子实体含有丰富的维生素、多糖、多肽、17种氨基酸和多种人体必需的矿物质[1]。工厂化规模生产中,蟹味菇菌丝发菌缓慢,后熟期时间较长,整个生长周期较常见食用菌长两倍左右,同时对外界环境要求较为严格[2]。原生质体电致诱变研究有望筛选出提高菌株生长速度的优质突变菌种,同时可为蟹味菇菌种改良和选育技术提供新的思路和方法,具有重要的实际应用价值。
原生质体诱变技术是菌种选育和改良的重要方法之一,具有方法简便、周期短、一次诱变就能获得大量突变菌株的特点。利用原生质体诱变选育优良菌株的研究已有很多较全面的报道,在微生物食用菌菌种改良和育种领域已广泛应用[3-9]。诱变机理为通过对底物进行物理或化学诱变剂处理,常采用紫外线、电场、离子束等方法进行诱变,使生物体细胞内的遗传物质发生变异,从而筛选出变异菌株,培育出新的优质高产菌株。采用更为安全环保的物理诱变方法[10]。菌株原生质体为诱变材料具有诱变率高、敏感性强等优点,利于增加其开发利用价值及优质菌株的筛选[11]。同时,用电场诱变可以拟发基因突变,当给予不同的外加电场作用,会使菌株细胞表面所带电荷发生变化,对细胞生长带来不同程度的影响,进而可以筛选出良性诱变菌株及其诱变参数。
目前,国内外研究多为对蟹味菇子实体、菌丝体诱变育种,原生质体制备技术探究的研究报道,以及以微生物为材料,利用高压电晕电场(交流高压电源装置和针、板电极组成高压电晕电场装置,加上高压后,在场强最大的针尖尖端处会产生局部放电-电晕现象),以此进行诱变处理。装置进行诱变处理方面的探究[12-13],如董先茹[14]对蟹味菇菌株离子束诱变选育进行了研究,筛选出综合营养价值最高的诱变菌株。袁丽丽等[15]通过对北虫草菌分生孢子进行高压电晕电场诱变处理,获得了北虫草新的突变菌株。在蟹味菇原生质体高压电晕电场诱变方面的研究目前尚未见报道。
试验选取高压电晕电场装置,以蟹味菇原生质体为材料,通过电场诱变处理,探寻对菌株生长速度的影响及获得优质突变菌株的新途径。通过筛选出菌丝体生长速度快的突变菌株,为选育蟹味菇优质突变菌株及菌种的后续研究提供参考。
1 材料与方法
1.1 菌株
蟹味菇(Hypsizygus marmoreus)菌株,内蒙古大学离子束实验室保存。
1.2 培养基
1.2.1 加强 PDA 培养基
去皮马铃薯 200.0 g、蔗糖 10.0 g、琼脂 10.0 g、葡萄糖 10.0 g、细菌学蛋白胨 1.6 g、酵母提取粉 1.6 g、KH2PO41.0 g、MgSO40.5 g、水 1.0 L。
1.2.2 液体培养基
去掉上述培养基中的琼脂,其余成分相同。
1.2.3 原生质体再生培养基
马铃薯 200.0 g、蔗糖 10.0 g、琼脂 10.0 g、葡萄糖 10.0 g、细菌学蛋白胨 1.6 g、酵母提取粉 1.6 g、KH2PO41.0g、MgSO40.5g、抗生素 100.0mg、水 1.0L。
1.2.4 二级培养基
柠条:水:甘草粉质量比为1∶2∶0.05。
1.3 溶液的配制
1.3.1 0.6 mol·L-1甘露醇稳渗剂
称取10.93 g甘露醇,定容于100.00 mL容量瓶中,经微孔过滤器过滤灭菌后备用。
1.3.2 1%溶壁酶
称取0.1 g溶壁酶溶于10.0 mL稳渗剂中,待完全溶解,经微孔过滤器过滤灭菌后备用。
1.4 试验方法
1.4.1 菌丝培养
取小块菌种接种于固体平板PDA培养基中,24℃避光培养。
1.4.2 原生质体的制备
将PDA培养所得菌丝体转接至液体培养基中,置于恒温摇床150 r·min-1,暗培养7 d可得适于原生质体制备的菌丝。以0.6 mol·L-1甘露醇作为稳渗剂,取过滤后的菌丝0.3 g,将菌丝收集于离心管中,用无菌水反复洗涤,3 500 r·min-1离心330 s,弃上清,再加入稳渗剂洗涤3次,用滤纸吸去多余水分。加入200 μL溶壁酶,置于25℃恒温摇床上酶解,210 min后加入300 μL稳渗剂,3 500 r·min-1离心5 min,取上清液用无菌脱脂棉过滤,得原生质体悬浮液。取10 μL原生质体悬浮液于显微镜下用过血球计数板观察计数,用稳渗剂将原生质体悬液浓度稀释至106个/mL。
1.4.3 原生质体电晕电场诱变及再生
置高压电晕放电装置于超净台中,诱变处理前打开紫外灯灭菌30 min,诱变时打开超净台风扇,避免水蒸气对针尖放电产生影响[11-13]。取稀释后原生质体悬液2 mL于直径3.5 cm的一次性培养皿内,轻轻摇匀,置于电晕电场,处理过程中针尖与液面间距离保持在0.7 mm,分别设置低电压长时间、高电压短时间组合进行处理,见表1。

表1 电晕电场诱变参数Tab.1 Mutagenesis parameter of corona electric field
如表1所示的每个处理重复3次。将诱变处理后的各组原生质体液分别取200 mL凃板于再生培养基中,每个处理涂3个PDA再生平板,并取未经电场处理的原生质体液为对照组进行凃板。于24℃暗培养,待平板长出菌落后,计数再生菌落个数、原生质体再生率及致死率,每个试验3个重复,取平均值。原生质体再生率(Yz,%)计算公式为:
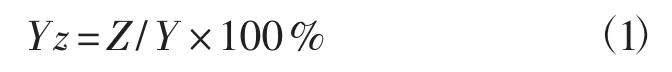
式中:Z为再生菌落数(个);Y为原生质体总数(个)。
致死率(S,%)计算公式为:

式中:Z为再生菌落数(个);Y为原生质体总数(个)。
1.4.5 突变菌株的筛选
从不同电场条件处理诱变得到的突变再生菌株中挑选出9个生长较快、菌落饱满的单个再生菌株,转接于PDA培养基中,继续培养观察。同时培养3个未经诱变处理的菌株作为对照组。
1.4.6 柠条固体培养
转接后的单个菌株培养至1个平皿,选取30支20 mm×200 mm试管,按照柠条:水:甘草粉质量比为1∶2∶0.05的比例,装满柠条粉压紧,灭菌后接入菌种,包括未经原生质体诱变处理的原始菌,每个菌接3支试管,编号、观察并记录各自生长速度以及菌丝体形态变化等。
2 结果与分析
2.1 原生质体的制备
通过血球计数板观察计数,菌龄7 d、溶壁酶酶解3.5 h,获得蟹味菇菌丝体的原生质体制备率为2.5×108个/mL。
2.2 电晕电场诱变处理蟹味菇原生质体的致死效应
经电晕电场不同电压、时间条件处理后蟹味菇菌丝体原生质体的再生菌落个数及致死率见表2,菌落个数对比见图1。
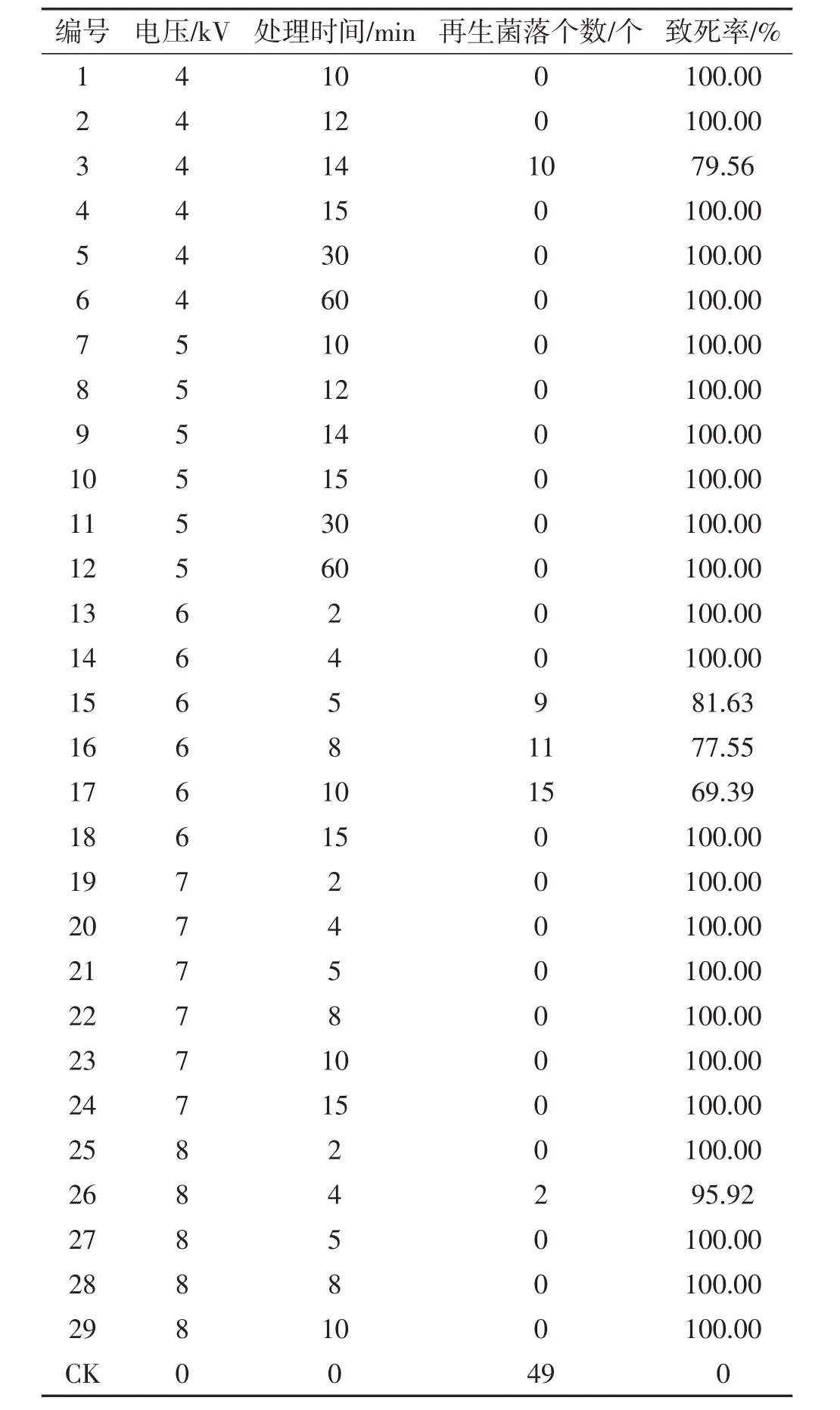
表2 不同诱变条件下原生质体致死率的比较Tab.2 Comparison of the lethal rate of protoplasts under different mutagenesis conditions
由表2和图1可知,未经电场处理的对照组再生菌落个数明显多于诱变处理后。当处理条件为4 kV诱变14 min、6 kV诱变5 min、6 kV诱变8 min、6 kV诱变10 min、8 kV诱变4min时可获得再生菌落,致死率69.39%~95.92%;随着电压增大,致死率不断增加。其余处理条件下致死率100%。从整体上看,高电压短时间处理组更易获得突变菌株,在处理条件为 8kV诱变4 min时致死率达最高95.92%。单个菌落生长速度对比见图2。
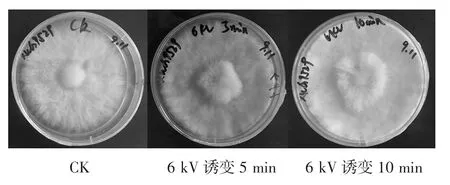
图2 单个菌落生长速度对比Fig.2 Comparison of single colony growth rate
由图2可知,电压为6 kV时,处理时间越长菌丝体越密集,菌丝生长越快,直径越大。说明蟹味菇原生质体对于电致诱变条件的变化较为敏感。
2.3 诱变处理后再生菌株生长量变化情况
经柠条固体培养试验,各再生菌株菌丝体长至2.5 cm所需天数见图3,菌丝体生长速度变化见图4。
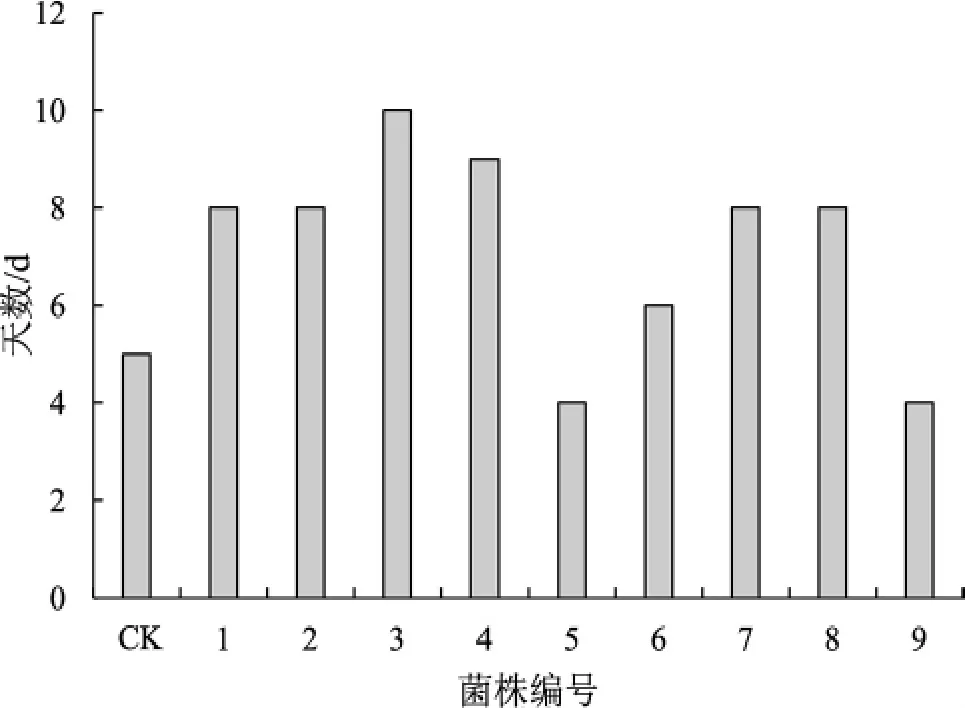
图3 菌丝体生长至2.5 cm所需天数Fig.3 The number of days required for Mycelium to grow to 2.5 cm

图4 生长量变化对比Fig.4 Comparison of the growth
由图3、图4可知,与CK组相比,9株突变株中,5号、9号均缩短了菌丝体生长至2.5 cm所需时间,所需天数为4 d,比出发菌株缩短了20%的时间;1号、2号、3号、4号、6号、7号、8号均增加了所需天数,其中,3号经6 kV诱变8 min处理后的再生菌落菌丝体所需时间最长为10 d。负向突变率占77.78%。通过对比第10天、第20天、第30天的菌丝体生长量变化情况发现,5号突变株生长量较CK组相比显著提高。
2.4 诱变处理后再生菌株生长速度变化情况
电晕电场诱变对原生质体再生菌株生长速度的影响见表3,30 d内菌株生长速度变化见图5。

表3 电晕电场诱变对原生质体再生菌株生长速度的影响Tab.3 Effect of Corona field mutation on protoplast mycelium growth speed
由表3和图5可以看知,30 d内,9株突变体较CK组,负变株有8株,占88.89%,正变株有1株,占11.11%,其中,5号正向突变菌株,生长速度提高了13.83%。生长过程中,1号突变株菌丝生长较CK组密集,其余各组较稀疏。说明蟹味菇原生质体经电晕电场8 kV诱变4 min处理可获得有效提高菌丝体生长速度的再生菌株。

图5 30 d内菌株生长速度变化Fig.5 Change of protoplast mycelium growth speed in 30 d
3 结论与讨论
电场是一种较常用的物理诱变方式,选用高压电晕电场诱变技术对蟹味菇原生质体进行处理。通过不同诱变条件处理原生质体发现,4 kV诱变14 min、6 kV诱变5 min、6 kV诱变8 min、6 kV诱变10 min、8 kV诱变4 min条件下可获得再生菌落,致死率69.39%~95.92%,经比较,高电压短时间处理组更易获得突变菌株。原生质体经8 kV诱变4 min后致死率最高,为95.92%。处理电压为6 kV时,在试验范围内处理时间越长菌丝生长速度越快。
从中筛选出的9株突变菌株,经出菇试验发现,电晕电场诱变对再生菌株的生长速度产生了不同的影响,生长速度提升的正向突变再生菌株为经8 kV诱变4 min的5号菌株,生长速度比出发菌株提高13.83%,获得了较好的诱变效果。
综上所述,对蟹味菇原生质体进行电致诱变处理可行,可以获得生长速度较高的良性诱变菌株,可为蟹味菇菌种的诱变育种提供新方法。后续可以进行诱变后营养成分优化,提高子实体产量的相关研究。
