苦皮藤中两个新的β-二氢沉香呋喃型化合物的NMR数据解析
2021-03-12廖怀玉韩红园张海艳赵天增
廖怀玉,韩红园,陈 飞,张海艳,杨 静,赵天增
苦皮藤中两个新的-二氢沉香呋喃型化合物的NMR数据解析
廖怀玉1,2,韩红园2,陈 飞2,张海艳2*,杨 静1#,赵天增2
1. 河南中医药大学,河南 郑州 450046;2. 河南省科学院 天然产物重点实验室,河南 郑州 450002
从南蛇藤属植物苦皮藤中分离出两个新的-二氢沉香呋喃型化合物:1,2,15-三乙酰氧基-8-(-甲基)-丁酰氧基-9-苯甲酰氧基-4,6-二羟基--二氢沉香呋喃(化合物I)和1,15-二乙酰氧基-8-(-甲基)-丙酰氧基-2,9-二苯甲酰氧基-4,6-二羟基--二氢沉香呋喃(化合物II).通过核磁共振(NMR,包括1H NMR、13C NMR、DEPT、1H-1H COSY、NOESY、HSQC、HMBC)技术对化合物所有的1H和13C NMR信号进行了全归属和详细解析.
核磁共振(NMR);南蛇藤属;-二氢沉香呋喃;苦皮藤
引 言
苦皮藤(Maxim)是卫矛科南蛇藤属植物,别名马断肠、苦树皮、老虎麻等,以根或根皮入药,性苦、平、有小毒,具有清热利湿,杀虫之功效[1].苦皮藤中含有倍半萜、三萜、黄酮、生物碱、皂苷等化学成分[2-5],其中-二氢沉香呋喃型化合物是南蛇藤属植物的特征化合物.现代研究表明,该类化合物具有抗阿尔兹海默症、抗肿瘤、抗结核、抗炎、抗HIV、杀虫等多种功效[6-13].苦皮藤不仅具有药用价值,还可作为纸张、人造棉、工业油的原材料,亦具有较高的观赏价值.
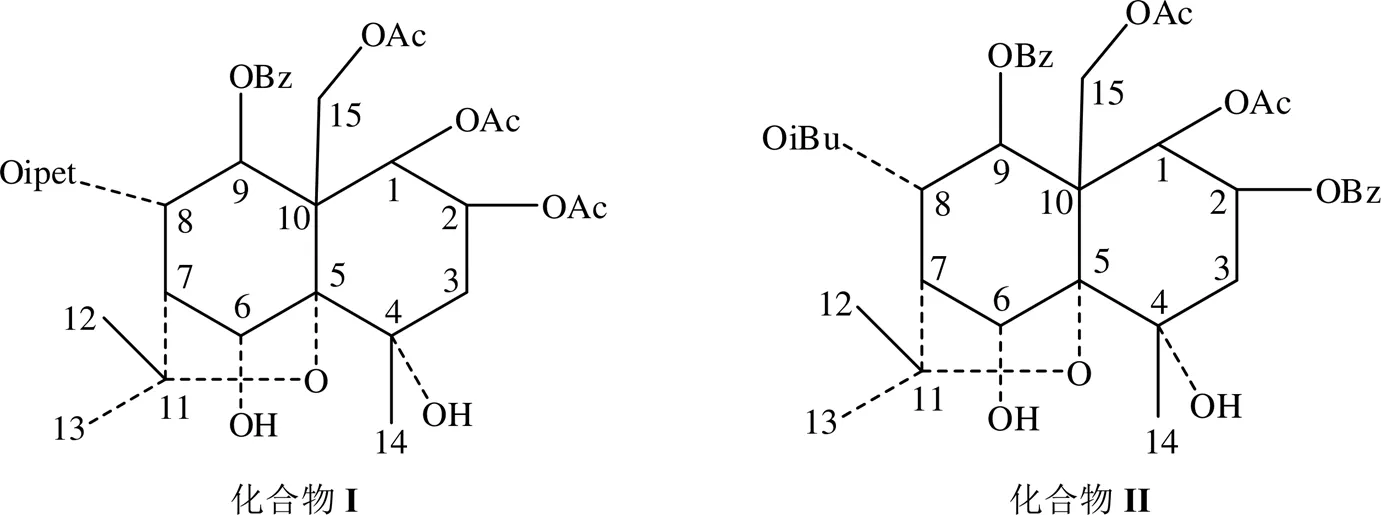
本研究从苦皮藤中分离得到两个新的-二氢沉香呋喃型化合物,分别是1,2,15-三乙酰氧基-8-(-甲基)-丁酰氧基-9-苯甲酰氧基-4,6-二羟基--二氢沉香呋喃(化合物I)和1,15-二乙酰氧基-8-(-甲基)-丙酰氧基-2,9-二苯甲酰氧基-4,6-二羟基--二氢沉香呋喃(化合物II),均为首次从自然界中分离得到.本文对化合物I和化合物II的核磁共振(NMR)谱图进行了测定,通过1D NMR和2D NMR技术[14-21]对该化合物所有的1H NMR和13C NMR信号进行了归属和解析.化合物I和化合物II的化学结构如图1所示.
1 实验部分
1.1 仪器与试剂
1H NMR、13C NMR、DEPT、1H-1H COSY、HSQC和HMBC谱图均在Bruker DPX 400型NMR谱仪上测定,使用5 mm正向检测探头;Waters 600型高效液相色谱仪,Waters 2489检测器;Anton Paar MCP200型全自动控温型旋光仪;Agilent 1290 Infinity II-6545型超高效液相色谱-四级杆串联飞行时间质谱联用仪;Fisher甲醇为色谱纯,甲醇、石油醚、乙酸乙酯等试剂为分析纯.
1.2 样品的提取与分离
苦皮藤根皮2.0 kg采集自陕西宝鸡,经河南农业大学朱长山教授鉴定为Maxim.将其粉碎,每次以3倍量石油醚80 ℃下回流提取2 h,共提取3次,合并提取液,过滤,减压浓缩成浸膏(76 g);浸膏用体积浓度为80%的甲醇水溶液溶解、石油醚萃取除杂,甲醇水溶液的部分减压浓缩得浸膏42 g;此浸膏使用甲醇溶解,硅胶拌样,上硅胶柱,用石油醚:乙酸乙酯 (石油醚:乙酸乙酯=10:1~3:7)进行梯度洗脱,其中8:2洗脱部位经半制备高效液相色谱(采用RP-18色谱柱,MeOH:H2O=65:35等度洗脱,检测波长为232 nm)制备纯化后得到化合物I(16 mg)和化合物II(11 mg).
1.3 实验条件
样品溶于CDCl3,以四甲基硅烷(TMS)为内标(H0.00,C0.0).1H核和13C核的工作频率分别为400.132 MHz和100.577 MHz,实验温度为25℃,谱宽分别为9 980.04 Hz和25 125.69 Hz.二维谱包括2D梯度场1H-1H COSY、1H-13C HSQC、1H-13C HMBC及1H-1H NOESY谱,均采用标准脉冲程序.化合物I的1H-1H COSY的2(1H)和1(1H)维的谱宽为3 591.95 Hz和3 601.19 Hz,采样数据点阵21=1 024×128,累加次数为16;DEPT135的谱宽为25 125.63 Hz;1H-13C HSQC的2(1H)和1(13C)维的谱宽分别为3 591.95 Hz和19 118.22 Hz,采样数据点阵21=1 024×128,累加次数为64;1H-13C HMBC的2(1H)和1(13C)维的谱宽分别为3 591.95 Hz和19 118.48 Hz,采样数据点阵21=1 024×128,累加次数为256.NOESY的2(1H)和1(1H)维的谱宽分别为4 201.68 Hz和4 201.68 Hz,采样数据点阵2×1=2 048×128,累加次数为64.化合物II的1H-1H COSY的2(1H)和1(1H)维的谱宽为3 591.95 Hz和3 601.20 Hz,采样数据点阵21=1 024×128,累加次数为16;DEPT的谱宽为25 125.63 Hz;1H-13C HSQC的2(1H)和1(13C)维的谱宽分别为3 591.95 Hz和19 118.33 Hz,采样数据点阵21=1 024×128,累加次数为32;1H-13C HMBC的2(1H)和1(13C)维的谱宽分别为3 591.95 Hz和19 118.33 Hz,采样数据点阵21=1 024×128,累加次数为64.NOESY的2(1H)和1(1H)维的谱宽分别为3 591.95 Hz和3 601.18 Hz,采样数据点阵2×1=1 024×128,累加次数为144.
2 结果与讨论
2.1 化合物I的结构解析
根据碳原子化学位移(图S2)规律,C24.3(伯碳)、26.3(伯碳)、30.1(伯碳)、50.7(季碳)、72.2(季碳)、84.6(季碳)、91.5(季碳)分别为4-OH--二氢沉香呋喃型倍半萜多醇脂类化合物C-14、C-13、C-12、C-10、C-4、C-11、C-5的特征峰[17-21];因此,初步认为化合物I属该类型化合物.C169.4、169.6、170.3在乙酰氧基的羰基碳化学位移范围,C175.4在异戊酰氧基的羰基碳化学位移范围,C165.7在苯甲酰氧基的羰基碳化学位移范围.
1H-1H COSY谱图(图S3,S4)指出,H5.38(1H, m)与H5.47(1H, d,=3.3 Hz)相关,H5.38与H2.01(1H, m)、2.10(1H, m)相关,H2.01与H2.10相关,可证明H5.47、5.38、2.01、2.10分别归属于H-1、H-2、H-3a、H-3b;H5.22(1H, m)与H2.56(1H, brd,=3.0 Hz)相关,H2.56与H5.63(1H, dd,=3.0/9.8 Hz)相关,H5.63与H6.08(1H, d,=9.8 Hz)相关,可证明H5.22、2.56、5.63、6.08分别归属于H-6、H-7、H-8、H-9;H4.73(1H, d,=13.3 Hz)与H4.79(1H, d,=13.3 Hz)相关,可证明H4.73、4.79分别归属于H-15a、H-15b.根据1H-13C HSQC谱图(图S5,S6)显示,C75.0、67.4、41.2、76.9、53.7、73.4、75.3、61.5分别归属于C-1、C-2、C-3、C-6、C-7、C-8、C-9、C-15.
1H-13C HMBC谱图(图S7)指出,C169.6与H5.47(H-1)、C169.4与H5.38(H-2)、C170.3与H4.73(H-15a)和H4.79(H-15b)、C175.4与H5.63(H-8)、C165.7与H6.08(H-9)相关,确认取代基OAc(C169.6)处于C-1位、OAc(C169.4)处于C-2位、OAc(C170.3)处于C-15位、Oipet(C175.4)处于C-8位、OBz(C165.7)处于C-9位.
由C-15化学位移为C61.5,推断C-9取代基为-取代;H-8与H-9之间偶合常数为9.8 Hz,表明H-8和H-9均为直立氢,观看Dreiding模型,H-8为-H,H-9为-H,因此C-8取代基为-取 代[13-15].NOESY相关(图2,图S8)指出,H5.47(H-1)与H6.08(H-9)相关,H5.22(H-6)与H5.63(H-8)、H1.79(H-14)、H4.73(H-15a)、H4.79(H-15b)相关,H1.79(H-14)与H4.73(H-15a)、H4.79(H-15b)相关,加之H-1与H-2之间偶合常数为3.3 Hz,因此,化合物I为1,2,15-三乙酰氧基-8-(-甲基)-丁酰氧基-9-苯甲酰氧基-4,6-二羟基--二氢沉香呋喃[1,2,15-triacetoxy-8-(-methyl)-butanoyloy-9-benzoxy-4,6-dihydroxy--dihydroagrofuran].化合物I的NMR详细数据见表1.

化合物I

表1 化合物I的NMR数据归属(CDCl3)

续表1
2.2 化合物II的结构解析
根据碳原子化学位移(图S10)规律,C24.5(伯碳)、26.3(伯碳)、30.1(伯碳)、50.5(季碳)、72.1(季碳)、84.6(季碳)、91.5(季碳)分别为4-OH--二氢沉香呋喃型倍半萜类化合物C-14、C-13、C-12、C-10、C-4、C-11、C-5的特征峰[17-21],初步认为化合物II属该类型化合物.C169.7、170.4在乙酰氧基的羰基碳化学位移范围,C175.9在异丁酰氧基的羰基碳化学位移范围,C165.5、165.7在苯甲酰氧基的羰基碳化学位移范围.
1H-1H COSY谱(图S11,S12)中,H5.62(1H, d,=3.4 Hz)与H5.66(1H, m)相关,H5.66与H5.62、2.20(2H, m)相关,可证明H5.62、5.66、2.20分别归属于H-1、H-2、H-3;H5.22(1H, brd,=4.9 Hz)与H2.59(1H, brd,=3.3 Hz)相关,H2.59与H5.67(1H, dd,=3.3/9.8 Hz)相关,H5.67与H6.12(1H, d,=9.8 Hz)相关,可证明H5.22、2.59、5.67、6.12分别归属于H-6、H-7、H-8、H-9;H4.75(1H, d,=13.1 Hz)与H5.09(1H, d,=13.1 Hz)相关,可知H4.75、5.09分别归属于H-15a、H-15b.根据1H-13C HSQC谱图(图S13,S14)可知,C74.8、68.2、41.3、77.2、53.6、73.6、75.4、62.1分别归属于C-1、C-2、C-3、C-6、C-7、C-8、C-9、C-15.
1H-13C HMBC谱图(图S15)指出,C169.7与H5.62(H-1)、C170.4与H4.75(H-15a)和5.09(H-15b)、C175.9与H5.67(H-8)、C165.5与H5.66(H-2)、C165.7与H6.12(H-9)相关,可以确定OAc(C169.7)处于C-1位、OAc(C170.4)处于C-15位、OiBu(C175.9)处于C-8位、OBz(C165.5)处于C-2位、OBz(C165.7)处于C-9位.
由C-15化学位移为C62.1,可推断C-9取代基OBz为-取代;H-8与H-9之间偶合常数为9.8 Hz,表明H-8与H-9均为直立氢,观看Dreiding模型,H-8为-H,H-9为-H,因此,C-8取代为-取代[13-15].NOESY相关(图3,图S16)指出,H5.62(H-1)与H6.12(H-9)相关,H2.59(H-7)与H1.64(H-12)相关,H1.84(H-14)与H4.75(H-15a)和5.09(H-15b)相关,加之H-1与H-2之间偶合常数为3.4 Hz,可知H-1、H-2、H-9处于同侧,为-取向,C-1、C-2、C-9上取代基均位于位;H5.22(H-6)与H5.67(H-8)相关,可知H-6、H-8处于同侧,为-取向,C-6、C-8位取代基位于位.因此,化合物II结构为:1,15-二乙酰氧基-8-(-甲基)-丙酰氧基-2,9-二苯甲酰氧基-4,6-二羟基--二氢沉香呋喃[1,15-diacetoxy-8-(-methyl)-propionyloxy-2,9- dibenzoxy-4,6-dihydroxy--dihydroagrofuran].化合物II的NMR详细数据见表2.

化合物II
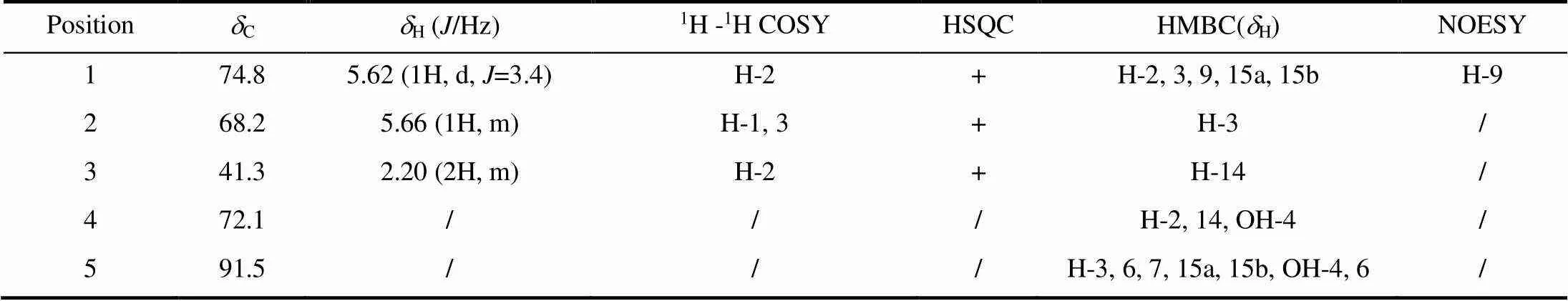
表2 化合物II的NMR数据归属(CDCl3)

续表2
3 结论
本文首次从自然界中分离得到两个新型化合物:1,2,15-三乙酰氧基-8-(-甲基)-丁酰氧基-9-苯甲酰氧基-4,6-二羟基--二氢沉香呋喃(化合物I)和1,15-二乙酰氧基-8-(-甲基)-丙酰氧基-2,9-二苯甲酰氧基-4,6-二羟基--二氢沉香呋喃(化合物II).通过HR-ESI-MS谱图确定了化合物I和化合物II的分子式及其精确分子量;综合利用1D NMR和2D NMR技术,分别对化合物I和化合物II的1H NMR与13C NMR信号进行了详细解析和归属,通过偶合常数、季碳、伯碳等特征峰化学位移确定其-二氢沉香呋喃型化合物结构骨架,应用HMBC谱确定取代基位置,取代构型可根据C-15化学位移及NOESY谱判断,其解析特征为今后-二氢沉香呋喃型化合物的结构研究提供了参考依据.
致谢
郑州大学分析测试中心的朱卫国及康建勋两位老师帮助进行核磁共振仪样品测试,河南省科学院化学研究所的赵俊宏老师帮助进行质谱样品测试,在此特致谢意!
利益冲突
无
附件材料
图S1 化合物I的HR-ESI-MS谱.
图S2 化合物I的DEPT谱.
图S3 化合物I的1H-1H COSY谱.
图S4 化合物I的1H NMR谱.
图S5 化合物I的1H-13C HSQC谱.
图S6 化合物I的13C NMR谱.
图S7 化合物I的1H-13C HMBC谱.
图S8 化合物I的1H-1H NOESY谱.
图S9 化合物II的HR-ESI-MS谱.
图S10 化合物II的DEPT谱.
图S11 化合物II的1H-1H COSY谱.
图S12 化合物II的1H NMR谱.
图S13 化合物II的1H-13C HSQC谱.
图S14 化合物II的13C NMR谱.
图S15 化合物II的1H-13C HMBC谱.
图S16 化合物II的1H-1H NOESY谱.
[1] 《全国中草药汇编》编写组. 全国中草药汇编(下册)[M]. 2版. 北京: 人民卫生出版社, 1996.
[2] CHANG X, WANG Z Y, CHEN X. et al. Two new sesquiterpene pyridine alkaloids from root barks of[J]. J Asian Nat Prod Res, 2019, 21(11): 1043-1051.
[3] ZHAO D Y, CHANG J H, YANG Y N, et al. Study on the chemical constituents from the root bark ofMaxim[J].Journal of Northwest University (Natural Science Edition), 1987, 4: 118-121.赵德义, 常建华, 杨韵娜, 等. 苦皮藤根皮化学成分的研究[J]. 西北大学学报(自然科学版), 1987, 4: 118-121.
[4] CHEN P D, LIANG J Y. Study on the chemical constituents from the root bark ofMaxim[J]. Strait Pharmaceutical Journal, 2002, 4: 33-36.陈佩东, 梁敬钰. 苦皮藤根皮的化学成分研究[J]. 海峡药学, 2002, 4: 33-36.
[5] FAN D S, LI T, ZHENG Z Y, et al. Macrolide sesquiterpene pyridine alkaloids from the stems of[J]. J Nat Med, 2018, 73(1): 23-33.
[6] CHEN Y L, HE J Y, HU C G, et al. Effects ofon human rheumatoid arthritis fibroblast synovial cells proliferation and expression of related cytokines[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2020, 29(4): 14-20.陈彦伶, 何金英, 胡成刚, 等. 苦皮藤对类风湿性关节炎成纤维滑膜细胞增殖和相关细胞因子表达的影响[J]. 中国民族民间医药, 2020, 29(4): 14-20.
[7] YANG G F, LI X T, WEI J L. et al.Synthesis and insecticidal activity in vitro and vivo of novel benzenesulfonyl derivatives based on potent target subunit H of V-ATPase[J].Bioorg Med Chem Lett, 2018, 28(19): 3164-3167.
[8] JIN H Z, HWANG B Y, KIM H S, et al. Antiinflammatory constituents ofinhibit the NF-κB activation and NO production[J]. J Nat Prod, 2002, 65(1): 89-91.
[9] NING R N, LEI Y, LIU S Z, et al. Natural-dihydroagarofuran-type sesquiterpenoids as cognitionenhancing and neuroprotective agents from medicinal plants of the[J]. J Nat Prod, 2015, 8(9): 2175-2186.
[10] SPIVEY A C, WESTON M, WOODHEAD S.Celastraceae sesquiterpenoids: biological activity and synthesis[J].Chem Soc Rev, 2002, 31(1): 43-59.
[11] WU W J, JI Z Q, HU Z N, et al. The effective components and biological activities in insecticidal plant ofMaxim[J]. Journal of Central China Normal University (Natural Sciences), 2005, 39(1): 50-53.吴文君, 姬志勤, 胡兆农, 等. 杀虫植物苦皮藤中的有效成分及其生物活性[J]. 华中师范大学学报(自然科学版), 2005, 39(1): 50-53.
[12] CHENG D, FENG M X, JI Y F, et al.Effects of Celangulin IV and V fromMaximon Na+/K+-ATPase activities of the(:)[J].J Insect Sci, 2016, 16(1): 1-5.
[13] KONG R, MAO X Y. Contrast experiment on the insecticidal effect of plant insecticideagainst wheat aphids[J]. Agricultural Science-technology and lnformation, 2020, 13: 10-11, 18.孔融, 毛晓燕. 植物杀虫剂苦皮藤对小麦蚜虫的杀虫效果对比试验[J]. 农业科技与信息, 2020, 13: 10-11, 18.
[14] 张海艳, 赵天增, 董建军, 等. 一种鉴别苦皮藤根皮药材的方法: 中国, 103048347. B[P], 2014-01-11.
[15] LIN X Q, LI H, ZHAN H L, et al. High-resolution pure shift NMR spectroscopy and its applications[J]. Chinese J Magn Reson, 2019, 36(4): 425-436.
林晓晴, 李弘, 詹昊霖, 等. 高分辨率核磁共振纯化学位移谱新方法及其应用[J]. 波谱学杂志, 2019, 36(4): 425-436.
[16] YIN T P, LI X, WANG Z, et al. A Review on spectral characteristics of dendrobines from theplants[J]. Chinese J Magn Reson, 2020, 37(3): 381-389.尹田鹏, 李幸, 汪泽, 等. 石斛属植物中石斛碱类成分的波谱学特征[J]. 波谱学杂志, 2020, 37(3): 381-389.
[17] 赵天增. 核磁共振氢谱[M]. 北京: 北京大学出版社, 1983.
[18] 赵天增. 核磁共振碳谱[M]. 郑州: 河南科学技术出版社, 1993.
[19] 赵天增, 秦海林, 张海艳, 等. 核磁共振二维谱[M]. 北京: 化学工业出版社, 2018.
[20] CHEN X, WANG T, LIANG Y H, et al. NMR study on a sesquiterpene polyol ester from[J].Henan Science, 2018, 36(8): 1210-1214. 陈欣, 王韬, 梁雅辉, 等. 苦皮藤中一个倍半萜多醇酯活性化合物的NMR数据解析[J]. 河南科学, 2018, 36(8): 1210-1214.
[21] ZHANG H Y, WANG Z Y, CHANG X, et al. Chemical components from seeds of[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(16): 57-61. 张海艳, 王志尧, 常霞, 等. 苦皮藤种子的化学成分分析[J]. 中国实验方剂学杂志, 2017, 23(16): 57-61.
An NMR Study on Two New-Dihydroagrofuran Compounds inMaxim
1,2,2,2,2*,1#,2
1. Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China; 2.Key Laboratory of Natural Products, Henan Academy of Science, Zhengzhou 450002, China
Two new-dihydroagrofuran compounds, 1,2,15-triacetoxy-8-(-methyl)-butanoyloy-9-benzoxy-4,6- dihydroxy--dihydroagrofuran (compound I) and 1,15-diacetoxy-8-(-methyl)-propionyloxy-2,9-dibenzoxy-4,6- dihydroxy--dihydroagrofuran (compound II), were isolated fromMaxim. The chemical shifts of the two new compounds were assigned by one- and two-dimensional nuclear magnetic resonance (NMR) techniques. Their structures were elucidated.
nuclear magnetic resonance (NMR),L.,-dihydroagrofuran,Maxim

O482.53
A
10.11938/cjmr20202862
2020-09-28;
2020-11-16
“重大新药创制”科技重大专项(2018ZX09711001-008-004).
* Tel: 0371-55935563, E-mail: haiyanhai6828_cn@sina.com;
# Tel: 18039119299, E-mail: candy.yjing@163.com.
