新型磷酸二酯酶5抑制剂CPD1对肺动脉高压大鼠血管收缩的影响
2021-03-11朱惠丹柯嘉琪王家璐徐甲甲刘晓晴杨建钦赵子建穆云萍李芳红
朱惠丹,柯嘉琪,王家璐,徐甲甲,刘晓晴,杨建钦,赵子建,穆云萍,李芳红
(广东工业大学生物医药学院,广东 广州 510006)
肺动脉高压(pulmonary arterial hypertension,PAH)是一种进行性和致命性疾病,持续的血管收缩和血管重塑使得肺血管阻力(pulmonary vascular resistance,PVR)进行性增加,最终引起右心功能不全和衰竭,并导致死亡[1]。研究表明,肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)的收缩和增殖是肺血管收缩和重塑的主要原因,胞质内游离Ca2+浓度([Ca2+]i)的增加是PAH致病的关键因素[2],而胞内钙稳态的维持与PASMCs膜上多种钙通道的功能密切相关[3]。
磷酸二酯酶抑制剂是一种抑制磷酸二酯酶(phosphodiesterase,PDEs)活性的药物,在心衰、哮喘、勃起功能障碍等疾病中具有广泛的应用前景。研究表明,PDE5抑制剂[4]通过抑制PASMCs膜上钙通道功能对肺血管重构和扩张有治疗作用,显著改善PAH患者的临床状态、运动能力和血流动力学参数[5-6]。目前,被批准用于治疗PAH的PDE5抑制剂主要有他达拉非(Tadalafil)、西地那非等[7],但其表现出的头痛、潮热、视觉模糊等副作用仍未得到彻底解决,为了减少或者克服这些副作用,中国专利申请CN102020645A公开了一种吡唑并嘧啶酮衍生物(WYQ)的制备方法,提供了所述吡唑并嘧啶酮衍生物或其药用盐用于制备治疗阳痿疾病及PAH药物的用途,该药物的特色是PDE5(IC50=0.001 4±0.000 1 μmol·L-1)的活性远远优于其他PDE同工酶,可有效降低头痛等副作用[8]。尽管如此,该药物水溶性差(室温下低于2 g·L-1)的缺点不容忽视,基于此,团队对WYQ开展了成盐及共晶筛选,通过对发现的盐型或共晶晶型样品的理化性质评估,选出了水溶性有明显提升(室温下不低于13 g·L-1),且理化性质较优的晶型CPD1(中国专利申请号:201910505948.5,Fig 1),以满足临床用药对于活性物质的形态、水溶性及纯度等理化性质的严格要求。初步研究结果显示,CPD1对PAH大鼠具有防治作用,但具体的作用机制还有待进一步研究。
因此,本研究使用野百合碱(monocrotaline,MCT)诱导的PAH大鼠模型,观察CPD1对激动剂诱导的血管收缩效应的影响,阐明CPD1对平滑肌细胞中钙通道功能的作用。为进一步探讨CPD1对于PAH的作用机制奠定基础。
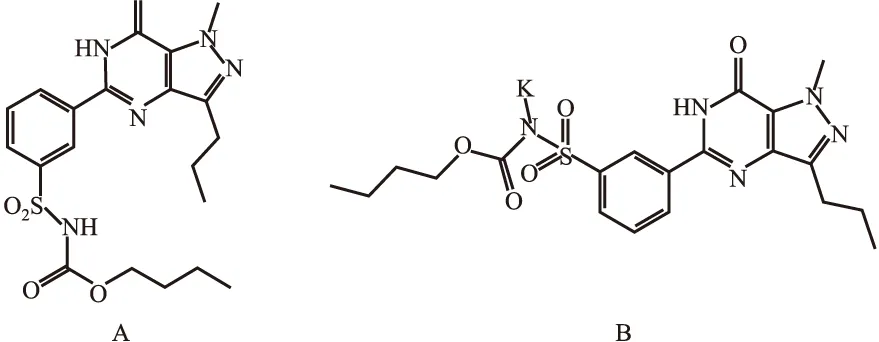
Fig 1 The structural formula of WYQ(A) and CPD1(B)
1 材料与方法
1.1 材料
1.1.1试剂 野百合碱(MCT,C2401)、氯化钾(KCl,P5405)、氯化镁(M2670)、氯化钙(C1016)、HEPES(P005678)、苯肾上腺素(PHR1017)、内皮素-1(E7764)、乙酰胆碱(A6625)、二甲基亚砜(D2650),均购自美国Sigma公司,苏木素伊红染色试剂盒(C0105)购自上海碧云天生物技术有限公司。Tadalafil(171596-29-5)、CPD1(ET32637-37-P1)购自和委托药明康德新药开发有限公司合成,经COA分析测定CPD1纯度为99%。MCT配制: HCl(1 mol·L-1)溶解固体药物,充分溶解后用NaOH(3 mol·L-1)调节溶液pH到7.0,双蒸水定容为2%溶液,现配现用;治疗药物配制:CPD1:用生理盐水配成2.5 g·L-1的溶液;Tadalafil:用0.5%的羧甲基纤维素钠配成2.5 g·L-1的溶液,均4 ℃冰箱保存。其他试剂均为国产分析纯。
1.1.2仪器 多道生理信号采集处理系统(RM6240BDJ)、压力换能器(YPJ01)、张力换能器(JZJ01H)、四腔器官浴槽系统(SQG-4)、离体肠管及热板实验恒温装置(HSS-1B)均购自成都仪器厂;解剖显微镜(SMZ645,日本Nikon);分析天平(BP 221S,德国Sartorius);酸度离子计(H1213A,意大利HANNA);石蜡包埋机(MPS/P1,德国SLEE);石蜡切片机(美国Thermo);冷冻台(中威电子仪器有限公司);烘箱(DH6-9143B5-Ⅲ,上海新苗)。
1.2 方法
1.2.1MCT致PAH模型的建立 MCT作为一种诱导PAH模型的药物在动物实验研究中被广泛使用[9],SPF级SD大鼠,♂,体质量(150±10)g,随机分为正常对照组(12只)、MCT组(15只)、CPD1治疗组(10只)、Tadalafil治疗组(10只)。MCT组和治疗组大鼠,以50 mg·kg-1的剂量给予一次性腹腔注射MCT,正常对照组则采用相同方法注射生理盐水,常规饲养7 d后,治疗组分别给予CPD1和Tadalafil灌胃,给药量10 mg·kg-1·d-1,持续14 d,正常饮食饮水。
1.2.2右心室内压测定 右心室压力不仅能够反映肺血管阻力的变化,而且对PAH预后有重要的提示作用,在利用动物模型研究PAH过程中,准确测量右心室压力是检测模型制备成功的关键技术[10]。启动RM6240生理信号采集处理系统,选择血压测量项,调节血压单位、坐标轴位置及走纸速率等参数,稳定30 min后用水银柱血压计定标压力换能器。大鼠用乌拉坦(0.5 g·kg-1)腹腔麻醉并进行腹腔肝素化(500 IU·kg-1)处理,迅速经右颈外静脉行右心室(right ventricle,RV)插管术,记录各组大鼠的右心室收缩压(right ventricular systolic pressure,RVSP),压力曲线稳定后持续记录5-10 min后结束测量实验。
1.2.3右心室质量指数测定 RVSP测定结束后严格按照华南理工大学实验动物中心的规定对大鼠实施安乐死,迅速取出胸主动脉、心、肺组织,分离右心室(right ventricle,RV),滤纸吸干血液和水分,分析天平称重。同法称取左心室(left ventricle, LV)与室间隔(interventricular septum,VS)重量,计算各组大鼠的右心室质量指数(right ventricular mass index,RVMI)[3]:RVMI=RV/(LV+VS)。
1.2.4肺动脉形态学检测 大鼠安乐死后,连同气管将心、肺取出,左肺经中性甲醛(10%)固定24 h、脱水后,按常规石蜡包埋切片步骤,在最大纵切面连续切片,取厚度为4-5 μm肺组织4片,行苏木精-伊红染色。在LEICA光学显微镜下观察各组大鼠肺小动脉(直径:50-150 μm)形态,每张肺切片至少选取5个视野寻找肺小动脉拍照,对管壁厚度进行测量,计算管壁厚度和厚度百分比(WT%)。
1.2.5血管张力检测 应用离体血管张力检测技术观察血管张力的变化[3]。体视显微镜下分离出胸主动脉和肺内动脉,并将其剪成约3-5 mm的血管环,三角钩滚动去内皮后动脉环置于四腔浴槽中,给以1 g负荷,经张力换能器转换后在RM6240BDJ多道生理信号记录仪上描记张力曲线,调节基线,平衡2 h。实验前先给予KCl 60 mmol·L-1收缩血管,重复3次,判断血管活性,当前后连续2次得到的收缩幅度差小于10%,被认为标本反应可重复,否则弃之。血管环加入苯肾上腺素(phenylephrine,Phen,终浓度0.1 μmol·L-1),待预收缩反应达平台稳定后,加入乙酰胆碱(acetylcholine,Ach,10 μmol·L-1),观察血管环的舒张效应,验证去内皮程度,血管舒张明显超过Phen收缩效应20%的弃之,本研究中血管环活性和去内皮合格率保持在80%-90%。随后,观察内皮素-1(endothelin-1,ET-1)在各组大鼠肺动脉和主动脉中的收缩效应,为避免血管长度和直径的差距对统计结果产生不可避免的影响,各种药物诱发血管的收缩作用以第3次60 mmol·L-1KCl收缩效应的百分数来标准化。
2 结果
2.1 CPD1对MCT致PAH大鼠模型形成的影响
2.1.1对RVSP的影响 与正常对照组(CON)相比,MCT组大鼠的RVSP升高,表明MCT可致大鼠右心室内压升高,肺动脉阻力增高,PAH模型构建成功。CPD1治疗后可抑制模型鼠RVSP的升高,且抑制效果不低于阳性对照药Tadalafil,表明CPD1能够降低MCT引起的高右心室压力,见Fig 2 A-E。
2.1.2对RVMI的影响 与CON相比,MCT组大鼠的RVMI升高,表明MCT可诱导大鼠右心室肥厚。CPD1干预后,大鼠的RVMI降低,同样抑制效果不低于Tadalafil,表明CPD1能减轻MCT诱导的大鼠右心室肥厚,而各组大鼠的心率没有差别(Fig 2F,G)。结果提示CPD1干预能有效抑制MCT诱导的大鼠PAH和右心室肥厚。

Fig 2 Effect of phosphodiesterase type 5 inhibitors on RVSP and RVMI in MCT rats
2.1.3对肺小动脉形态学的影响 与CON相比,MCT组大鼠肺内小动脉的中膜厚度和厚度百分比均明显增大,表明MCT可致大鼠肺内动脉平滑肌细胞增生,肺血管重构。CPD1和Tadalafil干预后,大鼠肺内小动脉中膜变薄,中层平滑肌增生减少,管腔增大,见Fig 3。结果提示: CPD1干预能有效抑制MCT诱导的大鼠肺动脉增殖和重塑。
2.2 CPD1对PAH大鼠肺动脉和主动脉收缩效应的影响
2.2.1血管环去内皮程度检测 Phen作用后血管明显收缩,观察Ach的舒血管效应,结果显示:未破坏内皮的肺动脉血管环中,Ach诱导血管显著舒张,表明血管内皮完整;而去内皮后Ach的舒血管效应明显减弱,两者比较差异有显著性(P<0.01),表明去内皮成功,标本可用,实验者去内皮手法可靠,见Fig 4。
2.2.2对Phen引起的血管收缩效应的影响 观察CPD1干预后对Phen(0.1 μmol·L-1)引起的主动脉和肺动脉收缩效应的影响。结果显示:与CON相比,MCT大鼠中Phen引起的肺动脉收缩效应显著增强,CPD1治疗组的收缩效应减小,见Fig 5A-D;此外,相比MCT组,MCT+CPD1组Phen引起的主动脉收缩效应也减小,见Fig 5E-H。提示CPD1干预能抑制PAH大鼠肺动脉对Phen的高反应性,CPD1可能通过调控血管平滑肌细胞内钙通道功能发挥作用。
2.2.3对KCl引起的血管收缩效应的影响 为进一步评价钙通道在CPD1治疗PAH的作用,继续观察各组大鼠血管对60 mmol·L-1KCl的收缩效应。结果显示:与CON相比,MCT组大鼠中KCl引起的主动脉和肺动脉收缩效应均无变化,表明MCT致PAH对平滑肌细胞电压依赖性钙通道(voltage-dependent calcium channel,VDCC)功能无明显影响,见Fig 6。此外,CPD1治疗后KCl引起的主动脉和肺动脉收缩效应也无明显变化,表明CPD1干预对PAH大鼠平滑肌细胞中VDCC作用不明显。
2.2.4对ET-1诱导的血管收缩效应的影响 继续观察各组大鼠血管对ET-1(10 nmol·L-1)的收缩效应。ET-1是一种强血管收缩剂,可激活非电压依赖性钙通道,主要是钙池操纵性钙通道(store operated Ca2+channel,SOCC)和受体操纵性钙通道(receptor-operated Ca2+channels,ROCC),使血管收缩和增殖[11]。结果显示:相比CON组,MCT组的ET-1收缩肺动脉效应增高,见Fig 7A-D。提示PAH大鼠肺动脉对ET-1的高反应性;相比MCT组,CPD1治疗组肺动脉和主动脉的收缩效应均减小,见Fig 7D,H。表明CPD1干预能抑制PAH大鼠肺动脉和主动脉的非电压依赖性钙通道活性,且可能是CPD1抑制肺动脉ET-1高反应性作用的重要因素。
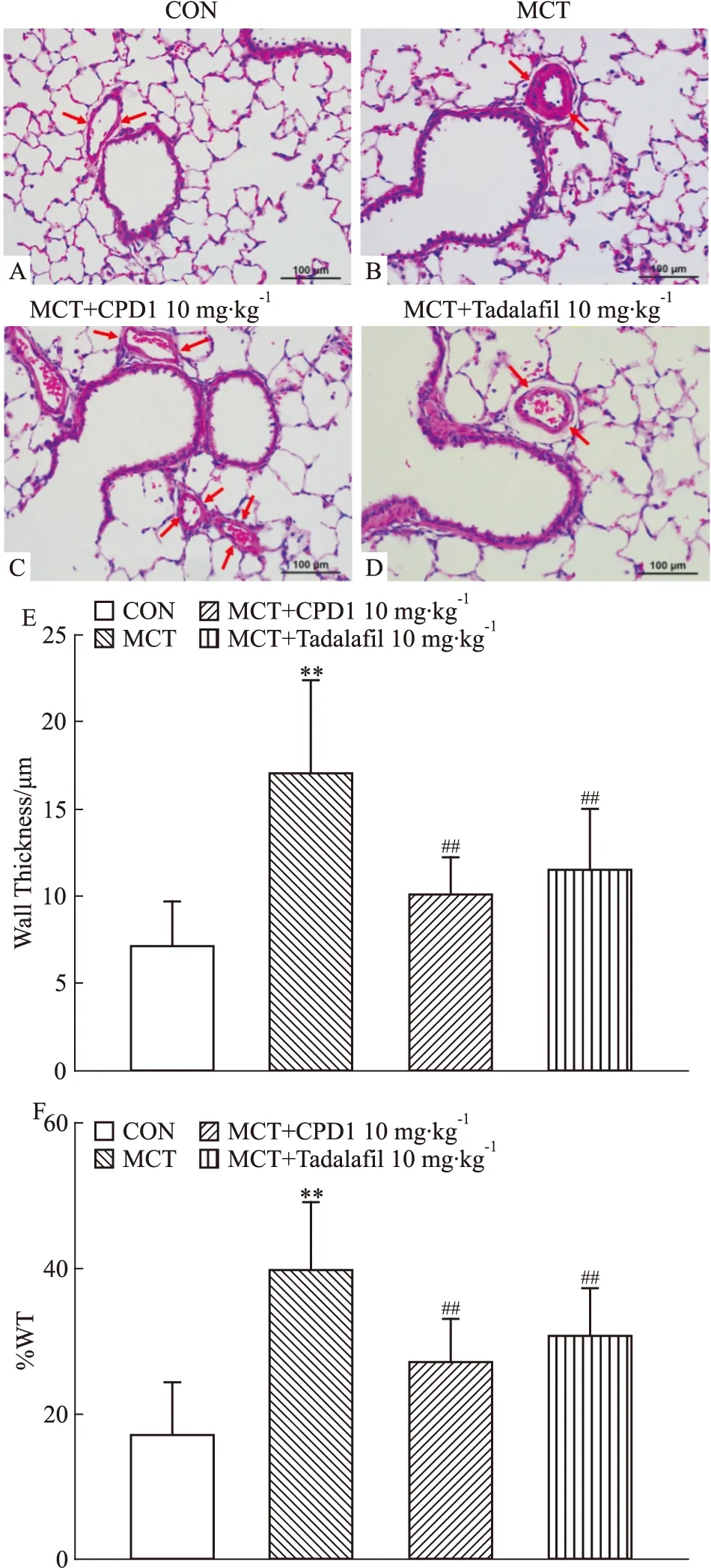
Fig 3 The representative images ofhematoxylin-and eosin stained lung section fromcontrol,MCT, CPD1 and Tadalafil-treated rats,respectively,showing small pulmonary arteries(radius:101-150 μm)control: A section(×200), MCT: B section(×200), MCT+CPD1: C section(×200); MCT+Tadalafil: D section(×200); and the ratio of vessel wall thickness(E) and the percentage of vascular wall thickness/ vascular external diameter(WT%)(F) in PAs of control(n=36), MCT(n=30), CPD1-pretreated(n=31) and Tadalafil-pretreated(n=31) rats.**P<0.01 vs control;##P<0.01 vs MCT.
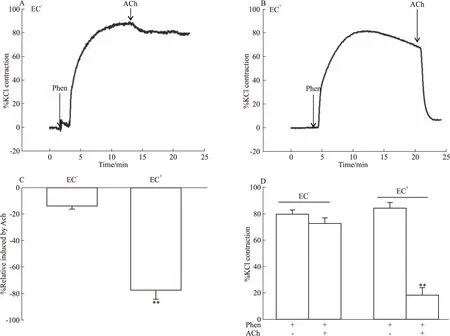
Fig 4 Ach induced relaxation of pulmonary arteries(PAs) precontracted by phenylephrine(Phen)
2.3 CPD1对正常大鼠肺动脉和主动脉的作用为了明确CPD1对大鼠血管作用的普遍性和机制,继续观察CPD1预处理对ET-1(10 nmol·L-1)收缩正常大鼠血管的作用。结果显示:CPD1预处理可抑制ET-1对正常大鼠肺动脉和主动脉的收缩效应,见Fig 8。提示CPD1对正常大鼠血管收缩效应的舒张作用可能主要是通过阻断非电压依赖性钙内流产生的。
3 讨论
心血管疾病依然是全球死亡主要原因[12],PAH作为一类危及生命的肺部疾病,有着心血管疾病的“恶性肿瘤”之称,PVR的持续性增加导致右心功能不全、右心衰竭乃至死亡。目前,已批准用于治疗PAH的靶向药物主要包括前列环素类、内皮素受体拮抗剂和PDE5抑制剂[13]。PDE5抑制剂能够抑制PDE5,增加细胞内cGMP水平,激活蛋白激酶G(PKG),诱导内源性NO的舒血管作用,达到降低肺动脉高压的目的。美国食品药品管理局已批准西地那非和Tadalafil用于治疗PAH,研究表明,西地那非可改善高原运动时的血流动力学和运动性能参数[7],但因其半衰期短,需每天多次大剂量用药(100 mg·d-1),加重了患者的经济和身体负担;Tadalafil 10 mg(2次·d-1)可降低高原缺氧性PAH肺水肿的发生率,但Tadalafil几乎不溶于水,可能影响其生物利用度。靶向治疗药物出现之前,特发性PAH患者中位生存期仅为2.8年,近年来,尽管治疗方案有了显著进展,但仍不能从根本上“治愈”PAH,其3年生存率只有68%[14],且治疗药物价格昂贵,副作用明显。为此,亟需寻找可靠的治疗药物以减轻患者负担,提高PAH的总体生存率。
为了克服现有PDE5抑制剂的缺点,中国专利文献(CN102020645A)公开了一种吡唑并嘧啶酮衍生物WYQ,具有与西地那非和Tadalafil相同的疗效,且具有低剂量高药效的特点[8]。基于此,团队自主研发获得一种新型PDE5抑制剂CPD1,与WYQ结构相似(Fig 1),但水溶性和肠溶性更好、毒性低、理化性质更稳定。本研究利用MCT致PAH大鼠模型,观察了CPD1对PAH大鼠的治疗作用,以及对不同钙通道激动剂诱发的血管收缩效应的影响。结果显示CPD1干预后,降低PAH大鼠的RVSP和RVMI,且使肺内小动脉管壁内膜变薄,管腔增大,说明CPD1干预能减轻PAH大鼠右心室压力增高和右心室肥厚,逆转肺内小动脉的增殖和重塑,提示CPD1干预能抑制MCT致PAH大鼠模型,此外,CPD1干预后,能够降低PAH引起的大鼠死亡率,但如果延长给药时间,药物作用是否依然存在持久性,需要进一步的实验研究。且与Tadalafil治疗组相比,CPD1抑制PAH可能有更好的效果。但CPD1干预对PAH大鼠血管平滑肌细胞中钙通道功能的作用还不明确。
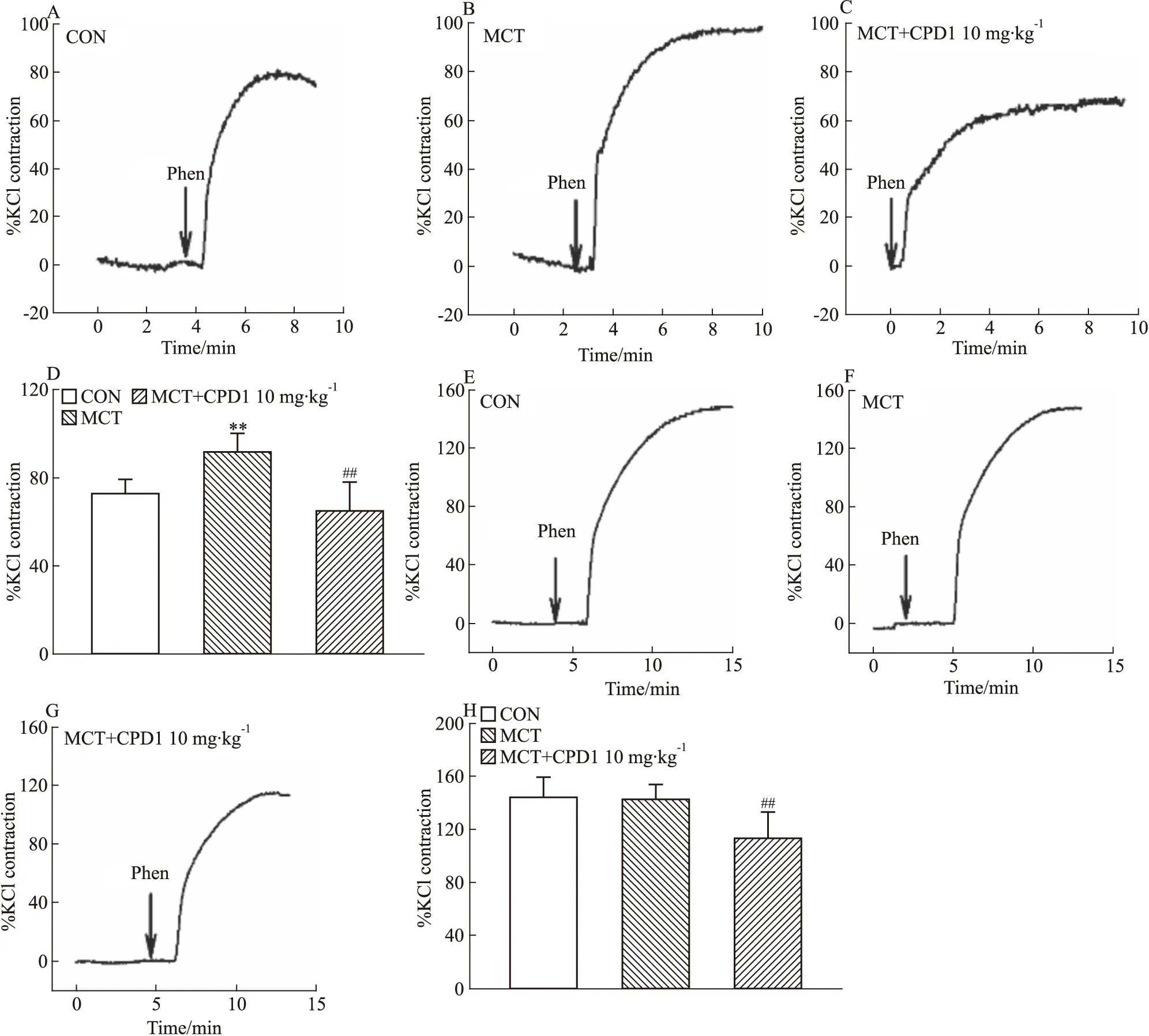
Fig 5 Phen-induced ring contraction in MCT-induced and CPD1-pretreated MCT-induced rats The representative traces of Phen-induced PAs ring contraction in CON(A), MCT-induced(B) and CPD1-pretreated MCT-induced(C) rats. The representative traces of Phen-induced aorta ring contraction in CON(E), MCT-induced(F) and CPD1-pretreated MCT-induced(G) rats. The average values of Phen-induced PAs ring(D) and aorta ring(H) contraction in CON(n=13 and 11), MCT-induced(n=11 and 8) and CPD1-pretreated MCT-induced(n=10 and 10) rats.**P<0.01 vs control,##P<0.01 vs MCT.
PASMCs膜上主要存在3种钙通道:VDCC、SOCC和ROCC,三者共同参与维持胞内钙稳态的平衡。肺血管的收缩主要与PASMCs收缩相关,而PASMCs的收缩主要依赖于膜上钙通道介导的钙内流,使[Ca2+]i升高。研究已证实,cGMP可负向调节钙信号传导和钙通道活性[15],西地那非通过上调VDCC抑制低氧诱导的人PASMCs增殖[16],为进一步明确CPD1对PAH大鼠血管平滑肌细胞中不同钙通道功能的作用,在CPD1干预MCT致PAH大鼠模型的基础上,观察CPD1对不同激动剂诱发的血管收缩效应的影响。本研究结果发现,CPD1干预可下调Phen引起的肺动脉和主动脉收缩,但对VDCC特异性激动剂KCl引起的收缩效应无影响,表明CPD1干预对血管平滑肌细胞中VDCC功能影响不明显。ET-1由血管内皮细胞产生,主要通过激活SOCC和ROCC,引起血管收缩[11],在PAH患者ET-1受体表达增加,且ET-1浓度增加,与肺血流量和心输出量成反比关系。本研究发现,CPD1干预能抑制MCT致PAH大鼠肺动脉对ET-1的高反应性,显著减小主动脉上ET-1的收缩效应,提示CPD1干预能抑制PAH大鼠肺动脉和主动脉中非电压依赖性钙通道的功能,且可能是CPD1发挥抑制MCT致PAH作用的重要因素。尽管多项研究表明,PDE5抑制剂对血压影响不明显[17],但本研究发现CPD1预处理血管环,抑制正常大鼠中ET-1诱发的主动脉收缩效应,表明PDE5抑制剂可能对主动脉平滑肌细胞膜上的非电压依赖性钙通道功能同样有抑制作用,这对于PDE5抑制剂的临床用药具有指导意义。本工作阐明了新型PDE5抑制剂CPD1与血管平滑肌细胞膜上钙通道功能之间的关系,对于针对PAH的新药研究和临床用药具有重要意义。
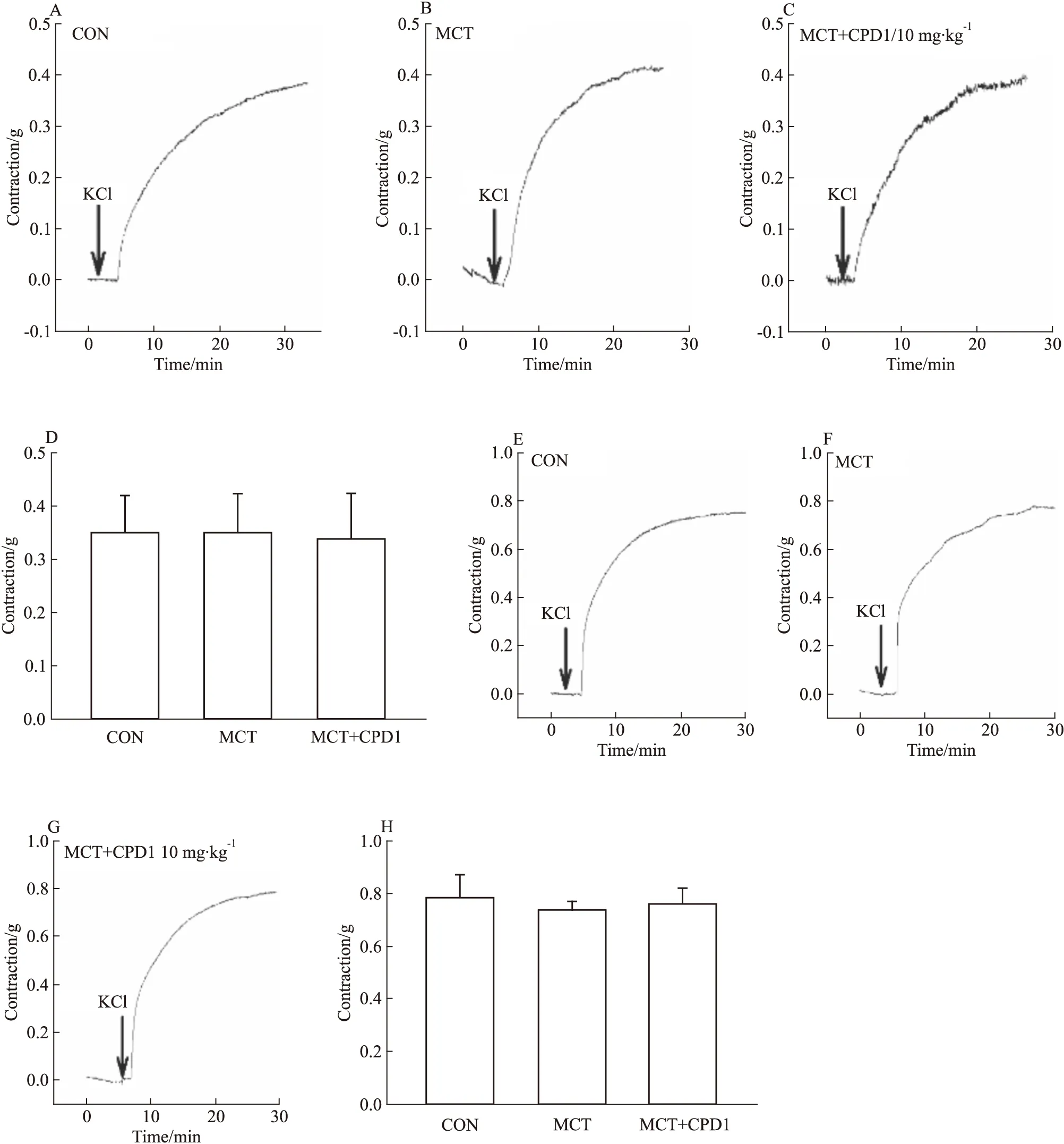
Fig 6 KCl-induced ring contraction in MCT-induced and CPD1-pretreated MCT-induced rats The representative traces of KCl-induced PAs ring contraction in CON(A), MCT-induced(B) and CPD1-pretreated MCT-induced(C) rats. The representative traces of KCl-induced aorta ring contraction in CON(E), MCT-induced(F) and CPD1-pretreated MCT-induced(G) rats. The average values of KCl-induced PAs ring(D) and aorta ring(H) contraction in CON(n=14 and 12), MCT-induced(n=13 and 8) and CPD1-pretreated MCT-induced(n=12 and 12) rats.
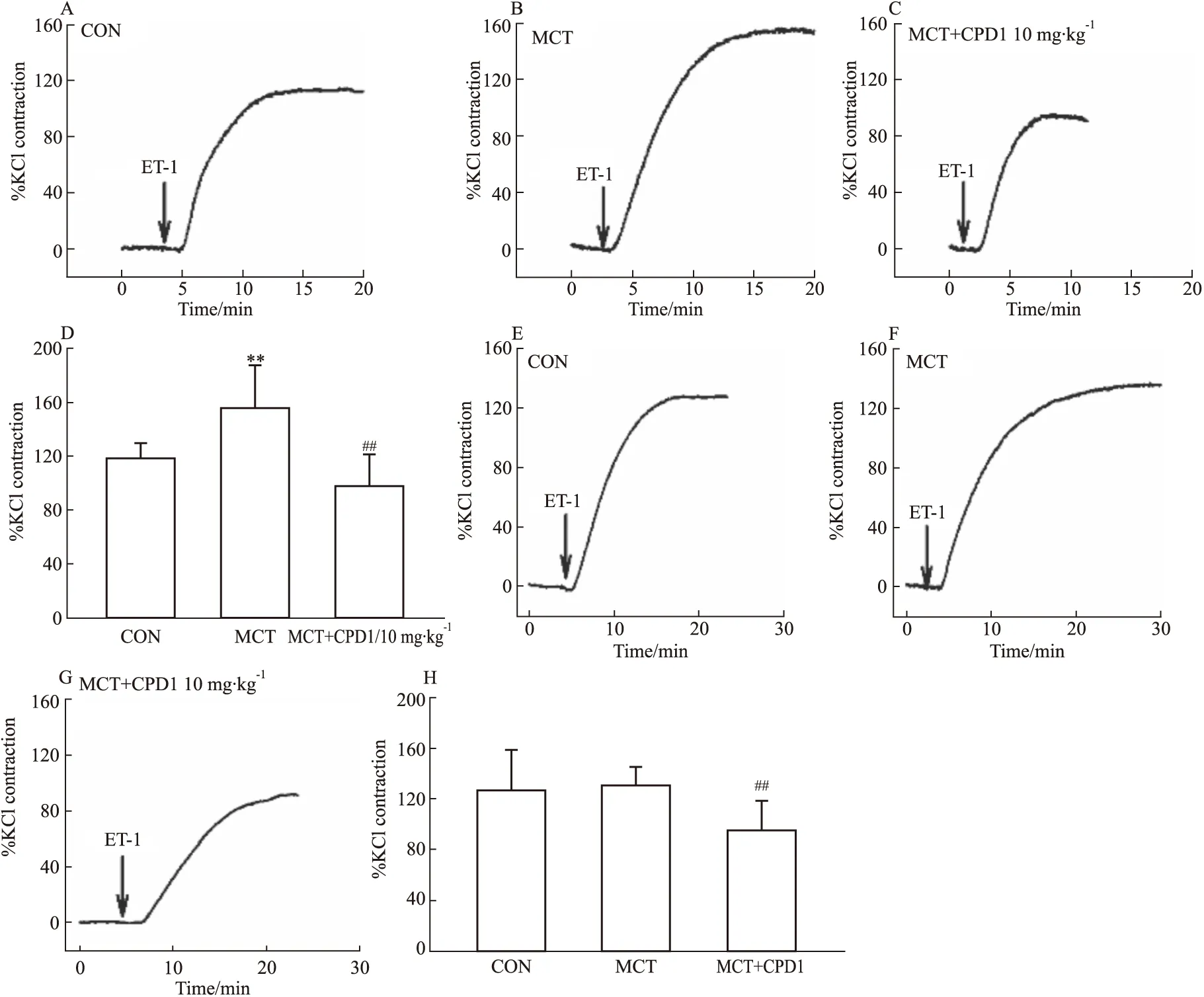
Fig 7 ET-1-induced ring contraction in MCT-induced and CPD1-pretreated MCT-induced rats The representative traces of ET-1-induced PAs ring contraction in CON(A), MCT-induced(B) and CPD1-pretreated MCT-induced(C) rats. The representative traces of ET-1-induced aorta ring contraction in CON(E), MCT-induced(F) and CPD1-pretreated MCT-induced(G) rats. The average values of ET-1-induced PAs ring(D) and aorta ring(H) contraction in CON(n=12 and 9), MCT-induced(n=14 and 14) and CPD1-pretreated MCT-induced(n=16 and 10) rats.**P<0.01 vs control,##P<0.01 vs MCT.
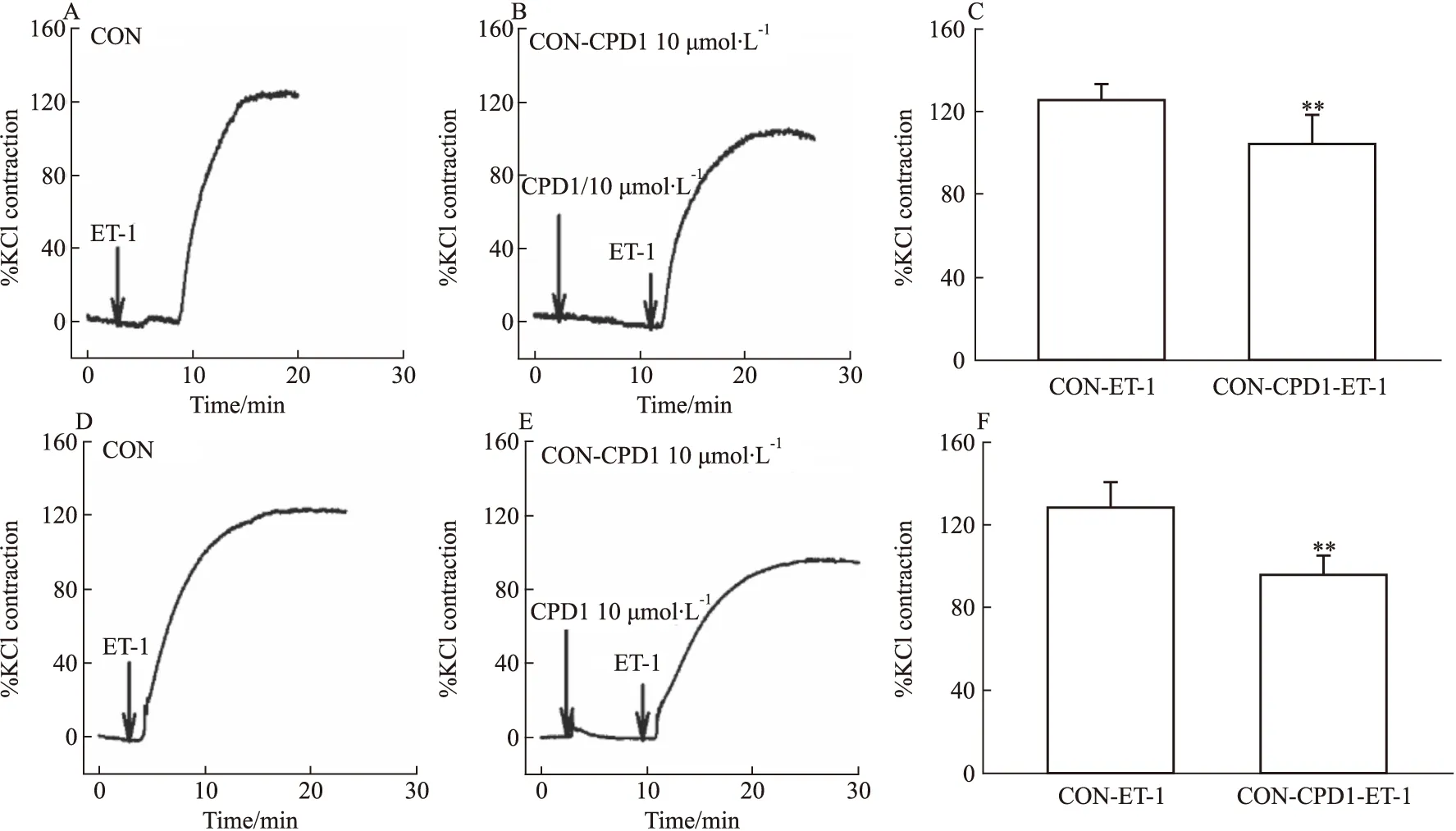
Fig 8 Effect of CPD1-pretreated on ET-1-induced ring contraction in control rats
