低钙对SD大鼠原代成釉细胞生物学特性影响的体外实验研究
2021-03-11王永刚阮建平田剑刚黄瑞哲高江红
王永刚,阮建平,周 静,田剑刚,黄瑞哲,高江红
(1. 陕西省牙颌面疾病临床研究中心,西安交通大学口腔医院口腔预防保健科,陕西西安 710004;2. 山东省东营市人民医院口腔科,山东东营 257091)
钙是人体必需元素之一,牙釉质中的钙含量高达95%~96%。钙离子(Ca2+)参与釉质矿化,是釉质发育矿化过程中的重要元素[1]。
釉质发育不全是釉质发育中受到某些全身性或局部性因素的影响而出现的釉质结构及矿化不全,机体钙摄入不足是釉质发育不全的原因之一。有研究显示,低钙饮食可导致大鼠牙釉质矿化程度显著降低[2],还可以促进氟斑牙的发生[3]。EKAMBARAM等[4]发现,血浆钙与血浆氟浓度二者间存在负相关,高钙减轻氟中毒症状,低钙则加剧氟中毒。低钙还可通过加重氟中毒时细胞内的钙超载,从而加重氟骨症[5]。
不同浓度Ca2+作用于细胞可引起细胞增殖、凋亡等生物学特性的改变。低浓度Ca2+可引起成骨细胞增殖活力增加,高浓度Ca2+可导致成骨细胞凋亡[6]。增加培养基中Ca2+浓度,人牙髓细胞的增殖活性降低[7]。牙釉质是在成釉细胞调控下形成、矿化,釉质的矿化伴随着成釉细胞的分化及生物学特性的变化[8]。DENBESTEN等[9]研究发现,无钙KGM-2培养基中加入20~100 mL/L血清时,体外培养的细胞主要是星形的成纤维样细胞和卵圆形细胞,而当培养基中加入0.05 mmoL/L Ca2+,卵圆形的细胞选择性生长。然而,低钙对原代成釉细胞增殖、凋亡及分化的影响文献报道较少,尚需进一步实验验证。
本研究拟对体外培养的原代大鼠成釉细胞加入不同浓度的低水平的钙,观察成釉细胞形态、增殖、凋亡及分化的变化,探讨低钙在釉质发育中的分子生物学作用。
1 材料与方法
1.1 实验动物与主要试剂出生4 d的SD大鼠购自西安交通大学医学部实验动物中心,雌雄不限,经西安交通大学口腔医院动物实验伦理委员会批准。标准DMEM培养基(美国,HycLone);胎牛血清(浙江天杭生物科技公司);胰酶、胶原酶、明胶(美国,Sigma);无钙DMEM培养基(美国,US Biology);苏木精,伊红(成都格雷西亚化学技术有限公司);CaCl2分析纯,多聚甲醛(北京化工厂);FAST200 RNA 提取试剂盒(上海先锋生物);反转录试剂盒(立陶宛,Fermentas);釉原蛋白一抗(美国,Abcam),DAB显色试剂盒(武汉,博士德);MTT(上海研生生化试剂有限公司);SYBR Premix ExTaqTMⅡ PCR试剂盒(天津,TaKaRa公司);酶标分析仪(上海益联AT-858);流式细胞仪(美国,B-D公司);IQ5实时定量PCR仪(美国,Bio-RAD)。
1.2 含不同浓度Ca2+DMEM培养基的配制取无钙DMEM干粉培养基,溶于双蒸水,0.22 μm滤器过滤,加入CaCl2,用电解质分析仪对培养基中的Ca2+浓度进行测定,使Ca2+浓度分别为0、0.6、1.2 mmoL/L。
1.3 原代SD大鼠成釉细胞培养出生4 d SD大鼠4只,断颈处死,取头部,750 mL/L乙醇浸泡10 min。分离上、下颌磨牙牙胚,含10 mL/L双抗的PBS清洗3遍,加入2.5 g/L的Ⅰ型胶原酶,剪碎后转入离心管中,37 ℃下50 r/min摇床上消化1 h,转入培养皿,37 ℃恒温孵育箱继续消化1 h后,小心吸取上层消化液并弃之。加入2.5 g/L胰酶分次消化,于37 ℃恒温孵育箱内消化5 min,吸取上清置于预先加入含150 mL/L胎牛血清的DMEM培养液的离心管中,消化5次,200目滤网过滤,收集上清液,离心,弃上清,加入含100 mL/L胎牛血清的标准DMEM培养液,混悬,接种于明胶包被的培养瓶、培养板,37 ℃、50 mL/L CO2恒温孵育箱培养。
2 d后,差别消化:2.5 g/L胰酶消化2 min,胎牛血清终止消化,PBS洗2遍,去除成纤维样细胞,继续培养上皮样细胞;培养第4天后,再次差别消化、换液;第5天,分别加入含Ca2+浓度为0、0.6、1.2 mmoL/L的DMEM培养基及100 mL/L胎牛血清继续培养48 h。
1.4 原代SD大鼠成釉细胞HE染色及细胞鉴定
1.4.1HE染色 细胞接种于24孔板玻片上培养5 d后,40 g/L多聚甲醛室温固定15 min。PBS洗3次,苏木素染色1 min,自来水冲洗,伊红染色30 s, 800、900、950 mL/L、无水乙醇梯度脱水。二甲苯透明。中性树胶封片、拍照。
1.4.2RT-PCR检测釉原蛋白和KLK4 mRNA表达 细胞接种于培养瓶培养5 d后,加入裂解液,按FAST200 RNA 提取试剂盒说明书提取总RNA,检测RNA样品浓度和纯度,进行反转录:94 ℃,3 min 95 ℃,30 s 60 ℃,30 s 72 ℃,1 min,30个循环;72 ℃,5 min。PCR扩增引物序列如下:Amelogenin-P1 5′-CTCTGCCTCCACTGTTCT-3′;Amelogenin-P2 5′-TCCACTTCGGTTCTCTCA-3′;KLK4-P1 5′-GACTCCTACACCGTGGGA-3′;KLK4-P2 5′-CGCCTGATGGTGTTAGAC-3′;β-actin-P1 5′-AGAGCAAGAGAGGCATCCT-3′;β-actin-P2 5′-GGTCATCTTTTCACGGTTG-3′。各取PCR产物5 μL,上样于20 g/L的琼脂糖凝胶中,电泳。紫外投射仪下拍照。
1.4.3釉原蛋白免疫组化染色 接种于24孔板玻片上培养5 d后,PBS洗3次,40 g/L多聚甲醛室温固定15 min,PBS洗3次,1 mL/L Triton-X孵育20 min,PBS洗3次,室温下50 mL/L BSA封闭15 min。釉原蛋白一抗4 ℃孵育,过夜,PBS洗3次,加二抗,37 ℃孵育20 min,弃二抗,PBS漂洗,DAB显色,自来水冲洗,苏木素复染,自来水冲洗。800、900、950 mL/L、无水乙醇梯度脱水。二甲苯透明。中性树胶封片、拍照。
1.5 倒置显微镜观察低钙环境下成釉细胞形态变化标准DMEM培养基培养成釉细胞5 d后,分别加入含Ca2+浓度为0、0.6、1.2 mmoL/L的DMEM培养基及100 mL/L胎牛血清,48 h后倒置显微镜观察低钙微环境下成釉细胞的形态变化。
1.6 MTT检测低钙环境下成釉细胞增殖情况标准DMEM培养基培养成釉细胞5 d后,分别加入含Ca2+浓度为0、0.6、1.2 mmoL/L的DMEM培养基及100 mL/L胎牛血清,每组6孔,并设置空白组。培养44 h后,加入MTT液,与原培养液共培养4 h后,吸出混合液,加入150 μL DMSO,酶联免疫检测仪上读取吸光度值,记录并分析结果。
1.7 流式细胞仪Annexin V-PI法检测低钙环境下成釉细胞凋亡情况标准DMEM培养基培养成釉细胞5 d后,分别加入含Ca2+浓度为0、0.6、1.2 mmoL/L的DMEM培养基及100 mL/L胎牛血清,48 h后对凋亡细胞进行测定。2.5 g/L胰酶消化细胞并离心收集细胞,Binding Buffer悬浮细胞,加5 μL Annexin V-FITC,混匀,室温避光10 min,加入 Propidium Iodide,冰浴5 min,混匀。上流式细胞仪检测并分析结果。
1.8 Real time-PCR检测低钙环境下成釉细胞釉原蛋白和KLK4 mRNA表达标准DMEM培养基培养成釉细胞5 d后,分别加入含Ca2+浓度为0、1.2 mmoL/L的DMEM培养基及100 mL/L胎牛血清,48 h后提取细胞总RNA并进行逆转录,具体步骤同实验一。按表1体系在冰上配制反应液。上机,94 ℃×30 s预变性;PCR反应,循环40次,95 ℃×5 s→60 ℃×30 s。IQ5软件分析溶解曲线,记录数据。
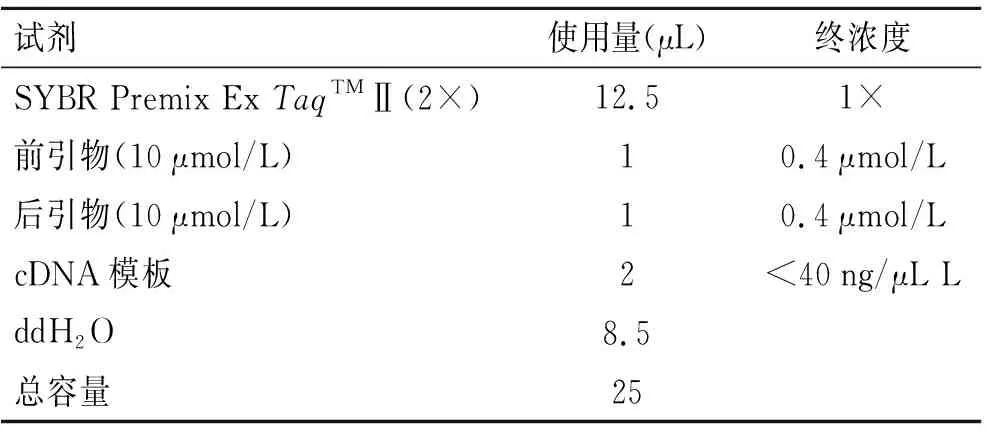
表1 Q-PCR反应体系Tab.1 Q-PCR reaction system
1.9 统计学分析采用SPSS 17.0统计软件进行统计分析,各组数据均以均值±标准差表示,数据经检验符合正态分布,Levene’s 法检验数据方差齐性,MTT和Annexin V-PI实验采用单因素方差分析对组间的均数进行比较,采用Tukey’s 检验进行组间两两比较,Real time-PCR 采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 成釉细胞形态及鉴定体外标准DMEM培养基培养5 d后,HE染色显示细胞聚集成簇、呈铺路样排列,细胞呈圆形、卵圆形及不规则多边形,细胞胞核蓝染(图1A);RT-PCR结果显示釉原蛋白、KLK4均有特异性条带(图1B);釉原蛋白免疫组化可见较多的细胞胞质染色呈棕黄色(图1C)。
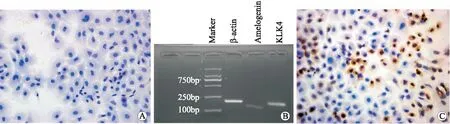
图1 标准DMEM培养基培养5 d后成釉细胞的形态及其鉴定Fig.1 Morphology and identification of ameloblasts cultured in standard DMEM medium for five daysA:HE染色(×40);B:RT-PCR;C:釉原蛋白免疫组化染色(×40)。
2.2 低钙对成釉细胞形态的影响低Ca2+DMEM培养基培养48 h后,倒置显微镜下显示各组细胞主要呈圆形、卵圆形及不规则多边形(图2);1.2 mmoL/L Ca2+组较0 mmoL/L和0.6 mmoL/L Ca2+组有较多细胞胞核密度较高、透光性差(图2A中黑色箭头)及高柱状细胞(图2A中红色箭头)。

图2 倒置显微镜下观察低钙对成釉细胞形态影响Fig.2 The effect of low-level calcium on the morphology of ameloblasts observed under inverted microscope (×40)A:1.2 mmoL/L Ca2+组;B:0.6 mmoL/L Ca2+组;C:0 mmoL/L Ca2+组。
2.3 低钙对成釉细胞增殖活力的影响低Ca2+DMEM培养基培养48h后,MTT显示,与1.2 mmoL/L Ca2+组相比,0、0.6 mmoL/L Ca2+组细胞增殖活性增加,组间差异具有统计学意义(P<0.01,图3)。两两比较,0、0.6 mmoL/L Ca2+组细胞增殖活性均高于1.2 mmoL/L Ca2+组(P<0.01,图3)。
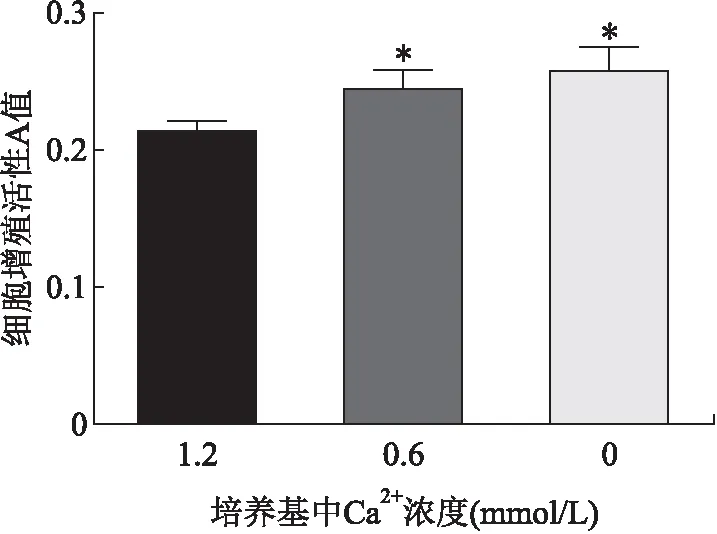
图3 MTT 检测低钙对成釉细胞增殖活力的影响Fig.3 The effect of low-level calcium on the proliferation of ameloblasts detected by MTT assay与1.2 mmoL/L Ca2+组相比,*P<0.01。
2.4 低钙对成釉细胞凋亡的影响低Ca2+DMEM培养基培养48 h后,Annexin V-PI凋亡检测发现,与1.2 mmoL/L Ca2+组相比,0、0.6 mmoL/L Ca2+组细胞凋亡百分率下降,组间差异有统计学意义(P<0.05,图4)。两两比较,1.2 mmoL/L Ca2+组与0 mmoL/L Ca2+组间差异具有统计学意义(P<0.05,图4)。
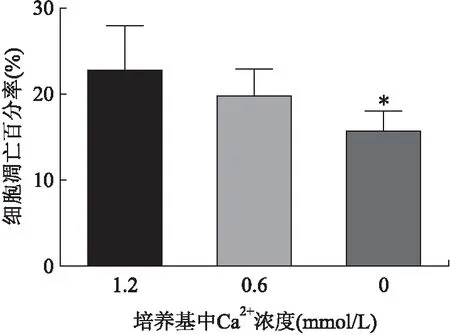
图4 Annexin V-PI检测低钙对成釉细胞凋亡的影响Fig.4 Effect of low-level calcium on ameloblast apoptosis detected by Annexin V-PI与1.2 mmoL/L Ca2+组相比,*P<0.05。
2.5 低钙对成釉细胞釉原蛋白及KLK4 mRNA表达的影响低Ca2+DMEM培养基培养48 h后,Real time-PCR结果显示,与1.2 mmoL/L Ca2+组比较,0 mmoL/L Ca2+组细胞釉原蛋白及KLK4的mRNA表达均降低,差异具有统计学意义(P<0.01,图5)。
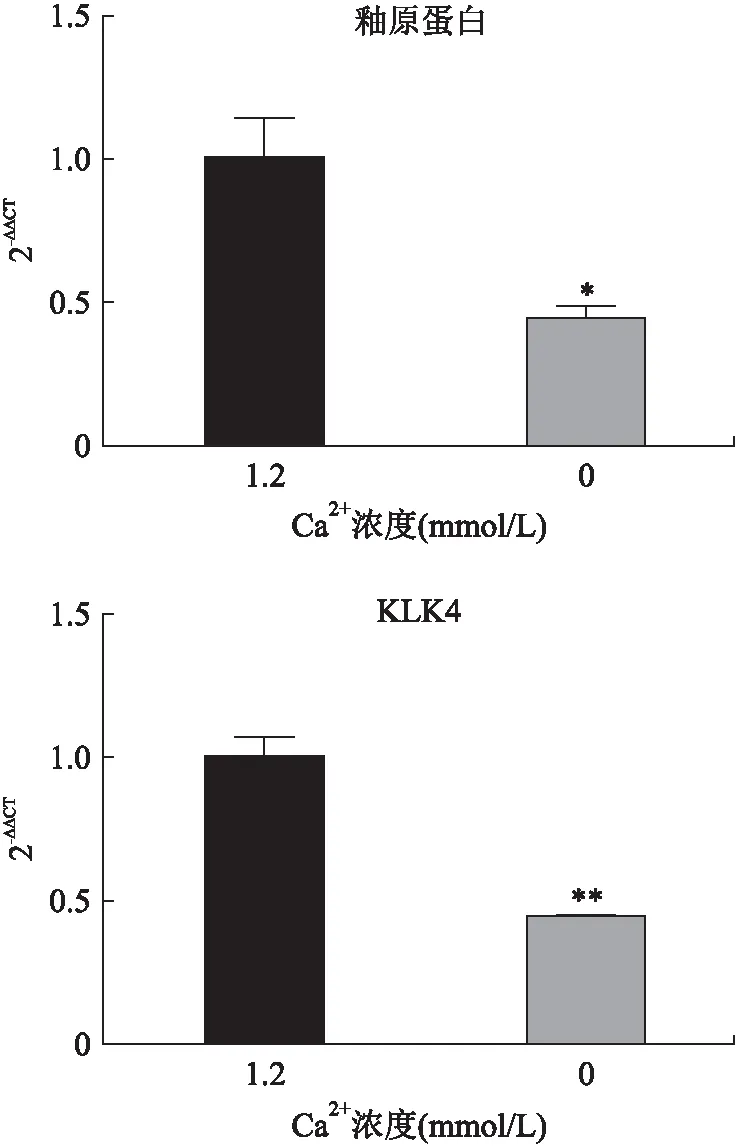
图5 Real-time PCR 检测低钙对成釉细胞釉原蛋白及KLK4 mRNA表达的影响Fig.5 Real-time PCR was used to detect the effect of low-level calcium on the expressions of amelogenin and KLK4 mRNA in ameloblasts与1.2 mmoL/L Ca2+组相比,*P<0.01,**P<0.001。
3 讨 论
钙缺乏可能参与釉质矿化不全及加重氟中毒,然而,低钙环境下成釉细胞生物学特性的变化目前尚不完全清楚。本课题组研究发现,高浓度的钙可能促进成釉细胞样细胞LS8细胞的分化[10];本研究进一步发现,低浓度的钙促进原代大鼠成釉细胞增殖并降低釉原蛋白和KLK4 在mRNA水平的表达,提示钙缺乏可能抑制原代成釉细胞的分化。
牙釉质的形成矿化是在成釉细胞调控下完成的。成釉细胞在分化中主要经历分泌期、转化期、成熟期3个阶段。分泌期成釉细胞呈高柱状,分泌釉原蛋白等釉基质蛋白和基质金属蛋白酶20(MMP20)。釉基质蛋白作为有机模板诱导钙等无机物矿化成核,使釉质晶体在长度方向生长完成[11]。此后,成釉细胞分化进入转化期,细胞变矮,开始分泌丝氨酸蛋白酶(KLK4),KLK4水解釉原蛋白。短暂的转化期后,成釉细胞进入成熟期,细胞高度进一步变矮,并分泌KLK4,水解、吸收釉基质蛋白,转运钙、磷等矿物盐在晶核周围,促进釉质晶体在宽度和厚度方向增长,调控釉质矿化成熟[12]。可见,釉原蛋白由分泌期成釉细胞表达,KLK4由转化期和成熟期成釉细胞合成分泌[12]。本研究通过RT-PCR在mRNA水平对体外培养成釉细胞进行鉴定发现,标准DMEM体外培养5 d的牙源性上皮细胞中釉原蛋白及KLK4 mRNA均显示有特异性条带。釉原蛋白免疫组化结果显示,部分细胞釉原蛋白染色阳性。免疫组化及RT-PCR结果说明,本研究所培养的细胞包含分泌期、转化期及成熟期成釉细胞。
标准DMEM培养基的总钙量为1.8 mmoL/L,采用电解质分析仪对标准DMEM培养基中的Ca2+浓度测定发现其Ca2+浓度为1.2 mmoL/L,因此,本研究定制了无钙DMEM培养基,并在此无钙培养基中添加CaCl2,配置了含Ca2+浓度为0、0.6 mmoL/L的低钙培养基及含Ca2+浓度为1.2 mmoL/L 的标准DMEM培养基。细胞在标准DMEM培养基中培养5 d后,低钙干预后,随着钙浓度的降低,细胞体积较1.2 mmoL/L 的标准DMEM培养基小,且细胞中柱状细胞较对照组少见,提示低Ca2+对体外培养成釉细胞形态可能有一定的影响。细胞活性检测发现,与1.2 mmoL/L组相比,0 mmoL/L Ca2+组及0.6 mmoL/L Ca2+组细胞增殖活性增加,凋亡减少,提示降低培养基中Ca2+对成釉细胞增殖活性有明显促进作用。这与国外的研究报道结果相似:随着培养基中Ca2+浓度降低成釉细胞增殖增加[13]。因此,低钙可促进原代成釉细胞的增殖活性。
本研究中,低钙DMEM培养基干预后,与1.2 mmoL/L Ca2+组比较,0 mmoL/L钙组成釉细胞釉原蛋白及KLK4的mRNA表达水平下调,提示低钙可能影响成釉细胞中釉原蛋白和KLK4 基因的表达。本研究中釉原蛋白mRNA表达水平下调与CHEN等[13]研究结果相似,增加培养基中Ca2+浓度釉原蛋白mRNA及蛋白水平均上调。然而,低钙导致釉原蛋白、KLK4 mRNA表达水平下调的具体调节机制仍待研究。有研究推测,Ca2+对釉原蛋白表达的影响可能通过Ca2+直接作用于釉原蛋白启动子,或者Ca2+通过某一信号通路直接参与釉原蛋白的表达导致[13]。成釉蛋白由分泌期成釉细胞表达,KLK4主要由成熟期成釉细胞表达,成釉细胞在分泌前期及分泌期增殖活力较强,有约1/4成釉细胞在转化期凋亡,又有1/4细胞在成熟期凋亡,即随着成釉细胞的分化,细胞增殖活力减弱[14]。结合本研究中低钙促进细胞增殖,低钙下调成釉细胞釉原蛋白和KLK4 mRNA表达,推测钙缺乏环境可能抑制成釉细胞的分化:相对于正常钙水平组,部分成釉细胞未能从分泌前期分化进入分泌期,且部分分泌期成釉细胞未能分化进入转化期和成熟期。
综上,本研究通过体外细胞实验证实了低钙影响原代大鼠成釉细胞细胞形态、增殖活力、凋亡及特异性基因表达,提示低钙可能造成的成釉细胞分化延迟,进而影响釉质矿化成熟。本研究结果为补钙拮抗氟牙症、釉质矿化不全增加了理论基础。然而,尚需动物实验进一步验证上述研究结果。
