香梨内生拮抗细菌的筛选及对梨火疫病的生防潜力
2021-03-10徐琳赟古丽孜热曼合木提
徐琳赟,古丽孜热·曼合木提,韩 剑,2,蒋 萍,黄 伟,罗 明,2*
(1 新疆农业大学 农学院,乌鲁木齐 830052;2 新疆维吾尔自治区高校农林有害生物监测与安全防控重点实验室,乌鲁木齐 830052;3 新疆农业大学 林学与园艺学院,乌鲁木齐 830052;4 新疆巴州农业科学研究院,新疆库尔勒 841003)
中国是全球栽培梨的三大起源中心之一,也是全球主要的梨生产区域,梨种植面积和产量占世界梨栽培面积和总产量的69.1%和68.4%,出口量居世界第一。库尔勒香梨(简称香梨,Pyrussinkiangensis)已有1400年栽培历史,是一个地域性极强的地方特色品种。新疆得天独厚的地理优势和气候条件造就了香梨皮薄肉脆、香味浓郁和耐贮力强等优良品质而享誉国内外。目前中国香梨种植面积达7.3万hm2,主要分布在新疆巴州库尔勒、轮台和阿克苏地区,总产量104.6万吨,是新疆特色经济林果产业的重要支柱产业,在促进农业增效、农民增收和区域经济发展中发挥着重要作用。
随着香梨生产的发展,种植规模不断扩大,各种病害相继发生,成为影响香梨生产的突出问题。近年来梨树腐烂病、褐斑病、果实黑斑病等常见病害逐年回升,危害愈加严重;同时一些潜在的重大病害发生风险加大,如梨、苹果等仁果类果树最具毁灭性的、重大检疫性细菌病害梨火疫病(Erwiniaamylovora)[1]。该病害目前已扩散分布于世界近60个国家和地区,目前中国尚无发生的报道。最近十年内与中国毗邻的韩国[2]、日本[3]、哈萨克斯坦[4]、吉尔吉斯斯坦[5]和俄罗斯等国相继有发现梨火疫病的报道。胡白石等[6]对“梨火疫病”的入境风险分析显示该病害为中国特高风险有害生物。随着林果品种引进和种苗调运,进口水果贸易增加,加剧了梨火疫病等有害生物传播的风险,是香梨产业安全生产的重大隐患,值得高度重视并及早采取预防措施。目前香梨病害的防治仍然主要依赖化学农药,由此引起的病菌抗药性、环境污染及果实的农药残留问题愈加突出,寻求环境友好和安全有效的生物防治措施防控香梨病害日益受到人们的重视。
植物内生细菌生活在健康植物的各种组织内部,是植物微生态系统中的天然组成部分。内生细菌在植株体内具有稳定的生存空间,在植物体内定殖、传导,通过产生抗菌活性物质,营养及位点竞争和诱导植物系统抗性(induced systemic resistance,ISR)等作用机制抑制病原菌的侵染,提高宿主植物抗病性和促进生长;还可作为外源抗性基因载体,构建基因工程菌等,在植物病害生物防治中是一类独具优势、极具应用潜能的新的资源菌[7]。国内外已有内生细菌用于棉花、马铃薯、水稻、玉米及甘蓝、番茄、橡树和水果产后病害防治的报道[8]。郭睿文[9]从猕猴桃中筛选出对猕猴桃溃疡病病原菌有较强抑制作用的拮抗菌。刘慧芹等[10]从苹果、梨、杏等果树的木质部中分离的内生细菌中筛选出拮抗菌株X8,对番茄灰霉病和辣椒疫病的防效达到75.4%和79.3%,显著高于50%腐霉利和25%甲霜灵的防效,具有作为生物农药开发利用的价值。谭小艳等[11]从柑橘叶片中分离到对柑橘溃疡病菌有拮抗作用的细菌菌株Bc51,并对其进行了鉴定及抑菌活性的测定。而目前研究中对香梨内生细菌及其生物防治作用的研究鲜见报道。本研究从香梨植株中分离内生细菌,针对梨树重要的3种病原菌——梨火疫病(Erwiniaamylovora)、梨梢枯病菌(Pseudomonassyringaepv.syringae)和梨树腐烂病菌(Valsamalivar.pyri),筛选出具有较强抑菌作用的拮抗菌株,测定拮抗菌株对梨火疫病生防作用的潜力,为发掘利用内生细菌的生防资源,探索梨树病害的生物防治途径奠定科学基础。
1 材料和方法
1.1 培养基及缓冲液
内生细菌分离和培养[12]:营养琼脂培养基(NA);病原细菌的培养和拮抗试验:LB培养基;病原真菌培养和拮抗试验:马铃薯葡萄糖培养基(PDA)。
PBS缓冲液:0.2 mol/L KH2PO4溶液和0.2 mol/L K2HPO4溶液配制,pH7.2。
1.2 内生细菌的分离材料
从新疆库尔勒市哈尔巴克乡、沙依东园艺场、尉犁县和轮台县香梨种植园,采集健康香梨树上的新鲜花器、当年生新生枝条、叶片和果实样品,样品迅速带回实验室,采用4 ℃冰箱冷藏,备用。
1.3 供试病原菌
梨火疫病菌(Erwiniaamylovora)E.a0055 菌株来源于美国,梨分离物由新疆乌鲁木齐海关技术中心提供。
梨梢枯病菌(Pseudomonassyringaepv.syringae)来源于新疆伊犁的梨分离物,由新疆农业大学农学院微生物实验室分离并保存。
梨树腐烂病菌(Valsamalivar.pyri)菌株来源于新疆库尔勒的香梨分离物,由新疆农业大学林学与园艺学院林木病理学实验室提供。
1.4 香梨内生细菌的分离和纯化
将采集的健康梨树的枝条、花、叶片和果实在自来水流水下冲洗1~2 h,再用无菌水冲洗,称取花瓣、枝条(剪成0.5~1 cm的小段)、叶片和果实(剪成4 mm2的组织块)各1 g,用75%酒精浸泡1 min,将用1%次氯酸钠浸泡2~5 min,无菌水冲洗3~5次。取最后一次无菌水冲洗液0.l mL分别涂布于NA培养基上,置于28 ℃恒温箱中培养2~3 d,观察有无菌落长出检测样品表面灭菌是否彻底。取表面灭菌彻底的样品放入灭菌的研钵中,每1 g样品中加入10 mL PBS缓冲液将组织充分研磨,静止10 min后,用移液枪吸取上清液加入试管无菌水中,充分混匀制成不同稀释度的稀释液。吸取100 μL样品稀释液注入到NA培养基平板上,均匀涂布后放入恒温培养箱28 ℃培养2~3 d。根据平板上长出菌落的不同形态、颜色、大小挑取单菌落,反复划线纯化后,转接到NA培养基斜面,4 ℃保藏。
1.5 内生细菌的抑菌作用测定及拮抗菌筛选
1.5.1 病原菌的准备将梨火疫病原细菌和梨梢枯病菌活化,挑取单菌落接入LB培养液中,在28 ℃、150 r/min摇床上振荡培养24~48 h至菌液OD600= 0.8~1.0,用无菌水稀释至浓度为107cfu/mL菌悬液,备用。
将梨树腐烂病菌活化,接种于PDA培养基平板上,在28 ℃恒温培养箱中培养5 d后,用灭菌打孔器沿菌落边沿取直径为6 mm的菌饼备用。
1.5.2 拮抗菌的初筛病原细菌拮抗菌的初筛采用同步培养法测定。分别取梨火疫病菌(浓度为107cfu/mL)和梨梢枯病菌(浓度为107cfu/mL)菌悬液0.1 mL在NA培养基平板上涂板。用接种环在待测内生细菌菌株活化的菌落上蘸取一环菌体,在涂菌平板边缘2 cm的圆周上等距离点接4个点,每菌株设3次重复。26~28 ℃培养2~3 d后,十字交叉法测量相对抑菌圈大小。
病原真菌采用异步培养法测定。将梨树腐烂病菌菌饼分别置于PDA平板中央,在距培养皿边缘2 cm的圆周上等距离4点接种待测内生细菌,26~28 ℃培养。当病原真菌长至培养皿边缘时,十字交叉法测量抑菌圈大小。每皿点接1株待测内生细菌,每菌株设3次重复。
抑菌圈半径(mm)=[抑菌圈直径(mm)-测试菌直径(mm)]/2
1.5.3 拮抗菌的复筛梨火疫病和梨梢枯病拮抗菌的复筛:将初筛的对梨火疫病菌和梨梢枯病菌具有拮抗作用的内生细菌菌株在LB平板上活化后,用接种环移取一环放入装有50 mL LB液体培养基的250 mL三角瓶中,28 ℃、150 r/min条件下振荡培养24~48 h至菌液OD600= 0.8~1.0。分别吸取病原细菌梨火疫病菌和梨梢枯病菌的菌悬液0.1 mL均匀涂抹在NA平板上,在距涂菌平板边缘2 cm的圆周上等距离位置放置4个灭菌滤纸片(直径4 mm)的,用移液枪吸取5 μL初筛拮抗菌菌悬液滴加在滤纸片上,以加入等量灭菌的LB液体培养基为对照,28 ℃下培养2~3 d后,十字交叉法测量抑菌圈大小。每菌株设3皿重复。
腐烂病拮抗菌的复筛:将梨树腐烂病菌菌饼置于PDA平板中央,在距培养皿边缘2 cm的圆周上等距离插入4只牛津杯(直径为8 mm),加入40 μL初筛拮抗菌培养液(OD600= 0.8~1.0),26~28 ℃培养5~7 d后,测量抑菌圈大小。每菌株设3次重复。
1.6 内生拮抗菌对梨火疫病防效的生物测定
1.6.1 拮抗菌和病原菌接种液的制备将待测拮抗菌菌株活化后接种于NA培养液,150 r/min、28 ℃摇菌24 h至OD600= 0.8~1.0做为接种液。同1.5.1将梨火疫病菌0055新鲜培养液稀释至浓度107cfu/mL作为接种液。
1.6.2 香梨离体花序接种在香梨果园初花期采集花枝,插入0.05% NaCl溶液中防腐保湿。用手持式压力喷雾器将待测拮抗菌菌液喷雾接种梨花序,每朵花喷菌液约80 μL,每个拮抗菌株接种50花序,重复3次;同时设喷施农用链霉素(华北制药厂生产,有效成分72%)4 000倍液对照,及无菌水为空白对照,在25 ℃、70%空气湿度的人工气候箱中培养24 h后喷雾接种病原菌液,每朵花约80 μL。将接种后的花序置于人工气候箱中25 ℃、70%空气湿度培养,3、5和7 d后定时观察记录发病情况,统计花腐率并计算防效。试验结束后将发病植株材料干热灭菌后销毁。
花腐率(%)=(病花数/总花数)×100%
花腐防效(%)=(对照花腐率-处理花腐率)/对照花腐率×100%
1.6.3 盆栽杜梨苗接种(1) 拮抗菌对梨火疫病的保护性防效。试验在实验室人工气候箱中进行,以盆栽2年生杜梨苗为接种材料。用手持式压力喷雾器将待测拮抗菌菌液喷雾至叶片与枝条完全湿润,每个菌株喷施5盆(约25个枝条),重复3次。同时设喷施农用链霉素(华北制药厂生产,有效成分72%)4 000倍液为对照,以无菌水喷雾为空白对照。拮抗菌接种后的杜梨苗放入28.5 ℃、相对湿度75%、光照12 h的人工气候箱中培养。72 h后再喷雾接种病原菌液,继续在人工气候箱中再培养。每天观察发病情况,记录发病枝条数、测定枝枯长度、枝枯长度占接种枝条长度的比例及发病级别。根据统计结果,计算发病率和病情指数,统计防效。试验结束后将发病植株材料干热灭菌后销毁。
(2) 拮抗菌对梨火疫病的治疗性防效。治疗性试验病原菌和拮抗菌的接种顺序与(1)的保护性试验相反,即先在杜梨苗上喷施接种病原菌液72 h后再喷施拮抗菌液,其他试验材料、培养条件及防效调查方法等均与保护性试验一致。
参考Paprstein等[13]的方法并改进,制定梨火疫病原菌接种离体枝条的病情分级标准[14]:0级,枝条无病斑;Ⅰ级,枝条病斑长度占接种枝条长度的1%~5%;Ⅲ级,枝条病斑长度占接种枝条长度的6%~15%;Ⅴ级,枝条病斑长度占接种枝条长度的16%~30%;Ⅶ级,枝条病斑长度占接种枝条长度的31%~50%;Ⅸ级,枝条病斑长度占接种枝条长度>51%。依据离体枝条接种后相同时间的病情指数划分病原菌的致病力。
发病率(%)=(发病枝条数/接种总枝条数)×100%
病情指数=∑(各级发病枝条数×病级代表值)/(接种总枝条数×最高级值)×100
枝枯防效(%)=(对照病情指数-处理病情指数)/对照病情指数×100%
1.7 拮抗菌株的鉴定
1.7.1 形态和培养特征将拮抗菌株划线接种于LB培养基上,28 ℃培养24 h,观察并描述其菌落形态特征。同时进行革兰氏染色,观察供试菌株的菌体大小、形态、芽孢的有无、形状及着生位置等,主要参照《常见细菌系统鉴定手册》等[15]。
1.7.2 16S rDNA和rpoD基因序列测定及分析以采用热裂解法提取的拮抗细菌菌株总DNA为模板,采用细菌通用引物进行16S rDNA扩增。正向引物27F(5′-GAGTTTGATCCTGGTCAG-3′),反向引物1492R(5′-AAGGAGGTGATCCAGCCGCA-3′),目标片段长度约1 500 bp。扩增体系25 μL:DNA模板2.0 μL,引物(10 μmol/L)各0.5 μL,Tap PcR MAster Mix(购自上海生工生物工程有限公司) 12.5 μL,ddH2O 9.5 μL。PCR扩增条件:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。PCR扩增产物在电泳仪电压100 V条件下经1%琼脂糖凝胶检测30 min,检测合格后由上海生工生物工程有限公司完成测序。测序结果在NCBI(http://www.ncbi.nlm.nlh.gov)网站中进行Blast比对分析,与GenBank中已知菌株的16S rDNA进行序列相似性比较,选取序列相似性高的菌株利用MEGA5.05软件以邻接法构建系统发育树。
2 结果与分析
2.1 香梨植株内生细菌的分离结果
对采集的健康香梨树的花、叶、枝条和果实中定殖的内生细菌进行数量测定和分离。结果表明,香梨树的花、叶、枝条和果实中均存在内生细菌,不同组织中内生细菌的分布密度不同。枝条中的菌群密度最高(3.5×104~4.4×105cfu/g,平均3.9×105cfu/g),其次是叶片(2.8×104~1.7×105cfu/g),平均2.3×105cfu/g),再次是花(1.0× 104~1.3×105cfu/g,平均1.1×104cfu/g),果实中最少。
依据内生细菌的菌落形态、大小、颜色、表面光滑程度及分布部位的不同,选取单菌落反复纯化,共分离获得内生细菌菌株337株,包括枝条120株,叶片110株,花80株,果实27株。
2.2 内生细菌的抑菌作用测定及拮抗菌筛选
以梨树3种重要病害梨火疫病、梨梢枯病和梨树腐烂病的病原菌为靶标病原菌,测定分离内生细菌的抑菌作用,从中筛选拮抗菌株。初筛结果显示(表1),337株内生细菌菌株中,有14株具有明显的抑菌作用,对初筛中表现出有抑菌作用的菌株进一步复筛,结果与初筛结果基本一致。通过筛选分别获得对梨火疫病梨、梨梢枯病菌和梨树腐烂病菌的拮抗菌株有7株、8株和4株。其中对梨火疫病菌的抑菌作用较强(抑菌圈半径>4 mm)的拮抗菌株有SN37、HN89和HN143;内生菌TN50菌株虽然在平板抑菌作用测定中不产生抑菌圈,但该菌株在与病原菌共培养时生长速度快,竞争能力强,能在24 h迅速覆盖病原菌菌落,故也将其作为备选的生防潜力菌株。对梨梢枯病菌的抑菌作用较强(抑菌圈半径>4 mm)的有SN16、HN89、ZN5和HN30,对梨树腐烂病菌均有较强抑菌作用(抑菌圈半径>5 mm)的菌株是HN89、ZN5、SN19和HN9菌株。ZN5、SN19和HN9菌株对梨梢枯病菌和梨树腐烂病菌均有拮抗作用,HN89菌株对3种病原菌都具有较强的抑菌作用。

表1 香梨内生细菌菌株对3种病原菌的抑菌作用测定结果
2.3 内生拮抗细菌对梨火疫病的防效
将筛选出的对梨火疫病菌具有抑菌作用的7个菌株(SN37、HN89、HN98、HN143、HN126、TN68、TN16)和具有竞争作用的TN50菌株,通过离体花序、杜梨苗接种,测定其对该病害的防治效果。
2.3.1 对香梨花腐的保护性防效在离体香梨花序上喷施拮抗菌株菌液,再接种病原菌,之后调查3、5和7 d各处理的花腐率,计算保护作用的效果。结果显示(表2),未喷施拮抗菌液的对照在病原菌接种后第2天香梨花序的花药、柱头、蜜腺、花萼、子房、花柄等处即陆续开始出现花腐症状,而喷施拮抗菌的处理(HN143菌株除外)能在一定程度上延缓花腐症状出现的时间,降低花腐率,不同菌株之间差异。其中TN50的防效最高,7 d平均防效达52.36%,与农用链霉素防效接近(60.67%);其次是HN89(39.66%),再次是HN98,防效达到30%以上;其余菌株的防效低于30%,防效不佳。
2.3.2 对杜梨苗梨火疫病的保护性和治疗性的防治效果选择对香梨花腐具有较好预防效果的拮抗菌株TN50、HN89和平板抑菌效果最优的SN37在杜梨苗上进行梨火疫病的保护性和治疗性的防治试验。保护性试验结果显示(图1,表3),在杜梨苗上预先喷施TN50、HN89和SN37菌液能显著降低嫩枝的枝枯率和病情指数(P<0.05),7~15 d的平均保护性防效分别为67.20%、54.32%和45.91%。其中TN50在第10天的防效最高(71.13%),至15 d时仍能稳定在67.03%,显著优于HN89和SN37菌株。
治疗性试验结果表明(图2,表4),喷施TN50、HN89和SN37菌液对杜梨苗的枝枯具有明显的治疗效果。防效最好的TN50菌株在7和10 d的防效都维持在65%以上,之后有所下降,7~15 d的平均治疗防效为63.88%,略低于农用链霉素的防效(79.25%);其次是HN89菌株(52.10%);SN37菌株防效较低(36.17%)。
2.4 内生拮抗细菌的鉴定
对梨火疫病具有一定防效的TN50、HN89和SN37菌株进行分类鉴定。TN50在NA培养基上菌落圆形,粘性有光泽,边缘整齐,不透明,淡黄色,菌体杆状,G-,无芽孢,无鞭毛。HN89菌株在NA培养基上菌落乳白色,圆形、边缘整齐、不透明,粘性光滑,菌体短杆状,单生,G+,中央位芽孢,芽孢囊不膨大,产荚膜。SN37菌株菌落淡黄色,隆起,不透明,粘性光滑,菌体杆状,单生,G-,无芽孢,端生鞭毛。

图1 拮抗菌株预处理(喷施)对杜梨苗梨火疫病的保护性防效Fig.1 The protective control efficacy of the antagonistic strains to the fire blight of birch pear seedling

表2 内生拮抗菌株接种对梨花腐预防作用的室内生测结果
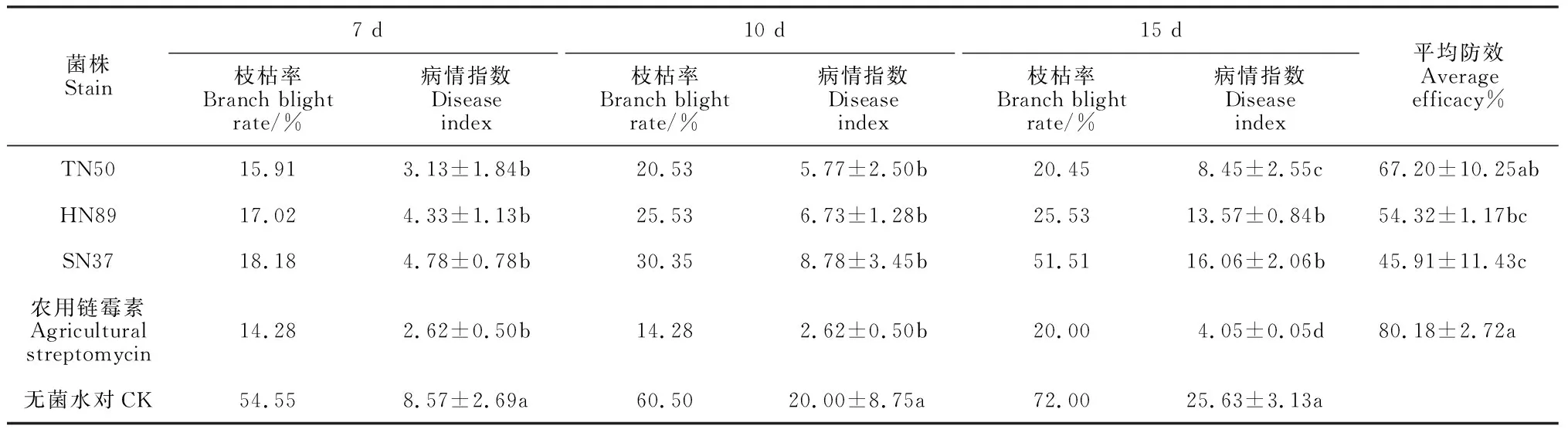
表3 拮抗菌株对杜梨苗梨火疫病的保护性防治效果
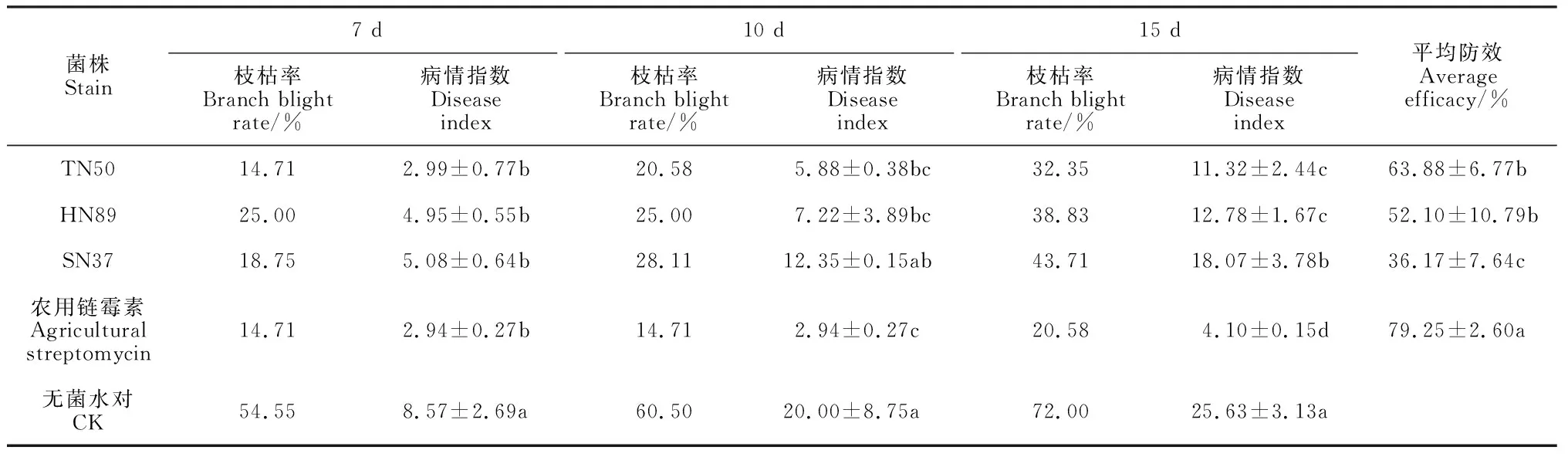
表4 拮抗菌株对杜梨苗梨火疫病的治疗性防效

图2 拮抗菌株预处理(喷施)对杜梨苗梨火疫病的治疗性防效Fig.2 The therapeutic control efficacy of the antagonistic strains to the fire blight of birch pear seedling
以提取的TN50、HN89和SN37菌株的总DNA为模板,采用16S DNA的通用引物进行PCR扩增、测序,分别得到大小为1 435 bp、1 459 bp和1 347 bp DNA片段,GenBank登录号分别为MN860164、MN86014和MN860183。将测序结果系统发育分支上,序列相似性达99.7%。由图5可以看出,SN37菌株与Pseudomonasjaponicastrain CH-26(MH712955.1)聚在一个小的分支上,序列相似性达到了99.7%。综合形态特征和16S DNA系统发育分析结果,将TN50菌株鉴定为克雷伯氏菌(Klebsiellasp.),HN89菌株鉴定为类芽孢杆菌(Paenibacillussp.),SN37菌株鉴定为假单胞杆菌(Pseudomonassp.)。

图3 基于16S r DNA序列构建的拮抗细菌TN50菌株的系统发育树Fig.3 Phylogenetic tree of antagonistic strain TN50 constructed based on 16S r DNA sequence
序列在NCBI数据库中进行基因在线Blast,使用DNAMAN软件进行序列拼接及比对。使用MEGA5.05软件进行系统进化分析,从中找出相似度最高的菌株序列采用邻接法构建基于16S rDNA 基因序列为基础系统发育树(图3~5)。由图3可以看出,TN50菌株与模式菌株Klebsiellavariicolastrain YD8 (KY887765.1)位于同一个系统发育分支上,相似性最高达到了99.7%。由图4可以看出,HN89菌株与模式菌株Paenibacilluspolymyxastrain DSM36T (NR_117733.2)聚在同一个

图5 基于 16S r DNA 序列构建的拮抗细菌SN37菌株的系统发育树Fig.5 Phylogenetic tree of antagonistic strain SN37 constructed based on 16S r DNA sequence

图4 基于 16S rDNA 序列构建的拮抗细菌HN89菌株的系统发育树Fig.4 Phylogenetic tree of the antagonistic strain HN89 constructed based on 16S rDNA sequence
3 讨 论
植物内生菌作为植物微生态系统的重要组成部分,是一个多样性丰富的微生物类群。目前关于内生细菌的分离筛选主要来自农作物、蔬菜、药用植物等,对果树内生细菌的研究较少,香梨内生细菌及其抑菌作用的研究未见报道。有研究认为内生细菌在林木组织中的分布以根部最多,茎部次之,叶部较少[16]。在柑橘中内生细菌的分布为根>主干树皮>枝条>叶片>果实[17],而在苹果树叶片中内生细菌数最多(4.95×102cfu/g),树皮居中(4.4×102cfu/g),茎中最少(1.83×102cfu/g),从叶片上分离到的内生细菌占所分离总数的75%[18]。本研究发现,在香梨树的枝条、叶片、花器和果实中不同组织中内生细菌的分布丰度不同,其特点为枝条(3.9×105cfu/g)>叶片(2.3×105cfu/g)>花(1.1×104cfu/g)>果实,分离出的337株内生细菌中,枝条中分离到的内生细菌最多,占分离菌株总数的35.6%。不同植物和不同的组织中内生菌的分布、数量和种类不同,反映了植株内生环境的差异,与树种、树龄、生长季节、地域分布和气候环境等多因素有关[19]。
本研究通过初筛、复筛从分离的香梨内生细菌菌株中筛选出对梨火疫病、梨梢枯病菌和梨树腐烂病菌的14个拮抗菌株,均是从枝条中分离获得的。其中有4个菌株兼具抗病原真菌和细菌的活性,ZN5、SN19和HN9菌株对梨梢枯病菌和梨树腐烂病菌均有拮抗作用,HN89菌株对梨火疫病梨、梨梢枯病菌和梨树腐烂病菌3种病原菌均有较强的抑菌作用,抑菌谱广,具有一定的生防潜力。生防细菌防治植物病害的机制主要有拮抗、竞争、重寄生和诱导植物产生抗病性等。拮抗作用是内生细菌的重要生防机制,通常是采用平板对峙法测定待测菌株对靶标病原菌的拮抗作用,比较抑菌圈大小筛选生防菌株。但该法存在一定的局限性,如供试菌株的生长速度或是所产生的抑菌物质的扩散能力等会影响测定结果[20],尤其是对仅具备竞争作用的菌株难以直观地检测出来。本研究中发现,在筛选梨火疫病菌拮抗菌时,TN50菌株虽不产生抑菌圈,但该菌株生长速度极快,能在24 h迅速覆盖病原菌,故将其作为备选的菌株。因此,在生防菌株筛选时,不能仅以抑菌圈作为依据,还应考虑对营养和空间的竞争能力强及其他抗菌机制的菌株,筛选出不同类型、不同作用机制、不同环境要求的生防潜力菌株,发挥其互补、协同作用以提高病害防效,在病害生物防治中更具应用价值。
梨火疫病是危害梨、苹果、山楂等仁果类果树的重大细菌病害之一。国外对防治技术包括检疫、修剪和铲除发病植株、药剂防治、生物防治及选育抗病品种性等措施[21]。但该病害防治难度大,无特效药剂和单一的防控措施,至今仍未得到很好的控制,安全有效的防控依然是世界性的难题。在20世纪70年代初期使用农用链霉素喷雾,保护花器免受侵染非常有效,但长期、大量使用农用链霉素已导致抗药性的产生。目前农用链霉素已经停止生产并退出了农药市场,迄今尚无防效相当的替代药剂。近年来随着对梨火疫病原菌的微生态学和侵染生物学的深入研究,推动了一些新的防治策略取得进展。研究发现,花器是梨火疫病菌最初、也是最重要的初侵染源。生防菌在花器的柱头、花梗表面定殖占领病原菌的侵染位点并抑制其生长繁殖是病害生物防治的关键[22]。如利用荧光假单胞菌(Pseudomonasfluorescens)和草生欧文氏菌(Erwiniaherbicola)等多次喷布开花期的梨树,在柱头定殖生长能有效减少病菌对花的侵染和花间传播[23]。美国研发的荧光假单胞菌(Pseudomonasfluorescens)A506商品菌剂得到了实际应用,使梨火疫病的花器发病率平均下降40~60%,达到了农用链霉素的防效,或与其他化学药剂的防效相当[24]。另一种生防菌剂ErwiniaherbicolaC9-1也通过美国环保局的生产许可并在生产中使用。Zeller and B. Wolf等[25]从花和叶分离出39株内生细菌,最有效的E.herbicola89菌株对花腐控制率接近70%,明显优于链霉素。本研究首先通过喷施拮抗菌菌液接种香梨离体花序,测定对花腐的保护性防效。试验结果表明,TN50菌株的防效最高(52.36%),与农用链霉素相近。进一步通过杜梨苗接种,明确菌株TN50、HN89、SN37对梨火疫病的保护性和治疗性防效。TN50菌株尽管在室内平板抑菌作用测定中并不产生抑菌圈,但具有生长速度快的特点,抢占病原菌的作用位点,竞争有限的生长资源可能是其对香梨花腐和杜梨苗枝枯具有防效较好的重要机制。而HN89、SN37菌株虽然具有较好的抑菌效果,但竞争力不强影响其防效。
通过梨幼果接种来评价梨火疫病生防菌株防效是一种常用方法[26],但有时果实接种试验与实际防效并不相关,大多数研究者更倾向于采用对病原菌最敏感的花器接种作为生防菌防效鉴定的方法[27]。本研究在实验室严格隔离的条件下采用香梨花器结合对梨火疫病高度感病的杜梨苗接种二种方法测定菌株的防病效果,力求更客观、准确地筛选出生防潜力菌株。本研究中筛选出的生防潜力菌株还要在后续工作中进一步研究其抗逆性能和在环境中的定殖性能,明确其抑菌机制,为制定病害的安全防控措施,严防病害入侵提供科学基础和技术储备。
