根域限制对葡萄根中IAA含量及其代谢相关基因表达的影响
2021-03-10纠松涛王继源许文平张才喜赵丽萍王世平
徐 岩,纠松涛,王继源,王 磊,许文平,张才喜,赵丽萍,王世平
(上海交通大学 农业与生物学院,上海 200240)
根系作为植物重要的营养器官,负责从土壤中吸收水分和矿质元素,并合成氨基酸、激素等物质[1]。20世纪90年代初期,研究人员从盆栽实践中获得启发,开始探索限制植物根系的栽培方式,即根域限制栽培(root restriction cultivation)。根域限制栽培是利用物理或生态方式将植物的根系控制在一定的容积内,通过控制根系生长来调节地上部的营养生长和生殖生长平衡的一种非传统栽培方式[2]。先前研究表明,根域限制栽培下葡萄的根系构型发生显著变化[3],葡萄果实品质也得到显著提升[4-5]。
内源激素作为重要的植物生长调节物质,在植物的生长发育过程中发挥着重要的调节作用,尤其是对根系发生的影响。其中,吲哚-3-乙酸(IAA)是生长素(auxin)的主要活性成分,参与植物根系发育的诸多方面,其中包括调控主根生长、根毛的发育、侧根原基的形成以及不定根的生长[6-8]。植物根系的生长受到根系组织中IAA浓度的影响,适当的IAA浓度有助于根系的生长,但过高或过低的浓度均不利于根系的生长[9]。生长素在地上部生命活动旺盛的部位合成,如茎尖、幼叶、胚芽鞘等器官,合成的生长素会暂时储存在“库”器官或者直接通过极性运输到根尖等作用部位[10],该过程涉及生长素的合成、极性运输等过程。
植物体内的生长素主要以色氨酸为前体,在氨基转移酶(tryptophan aminotransferase, TAA)的作用下生成吲哚-3-丙酮酸(indole-3-pyruvate, IPA),IPA又在黄素单加氧酶(flavin monooxygenases, YUC)的作用下形成IAA[11-12]。生长素的极性运输主要由向胞内运输的AUXIN蛋白和向胞外运输的PIN蛋白来实现[13-14]。在植物根中有2种不同的极性运输方式,即向基性和向顶性运输,主要通过AUX/LAX、PIN和ABCB/MDR/PGP等运输载体来完成[15]。通过AUX和PIN等运输载体的协同作用,IAA在根中形成浓度梯度,这是IAA对植物根系发育调控的关键。生长素的信号传递需要与受体结合来完成,目前发现的生长素受体有生长素结合蛋白1(auxin binding protein 1, ABP1)和运输抑制剂响应蛋白1(transport inhibitor response 1, TIR1)[16-17]。此外,根系的生长不仅需要根尖分生区细胞不断分裂增殖,还需要根伸长区细胞的伸长。CycA1、cycD3、cdc2、cycB1均属于细胞周期调控蛋白,在有丝分裂过程中发挥着关键作用[18-19]。LRP1(lateral root primordia 1)在不定根及侧根原基中特异表达,是一个调控根系伸长的转录因子,具有较强的组织特异性。SWP1(struwwelpeter 1)能够结合到LRP1基因启动子序列,对其表达起抑制作用。
近年来,根域限制栽培技术在葡萄生产过程中得到了广泛应用,关于根域限制栽培影响葡萄根系发育和果实品质的研究也日渐深入[20-21],但是根域限制是如何调控葡萄根中生长素代谢、根发育相关基因的表达水平来影响内源IAA的合成和分配,进而影响其根系构型的还不清晰。因此,本研究以一年生‘玫瑰香’葡萄为试验材料,对根域限制和传统栽培下的葡萄根系中生长素的含量、生物合成、转运以及信号转导相关基因(VvTAA1、VvTAR2、VvYUC2、VvYUC4、VvYUC6、VvYUC8、VvABP1、VvTIR1、VvAUX1、VvLAX1、VvLAX2、VvLAX3、VvPIN1、VvPIN4、VvABCB1和VvABCB19)、细胞周期相关基因(VvcycA1、VvcycB1、VvcycD3和Vvcdc2)和根系伸长相关基因(VvLRP1和VvSWP1)表达丰度进行检测,以期阐明根域限制栽培影响葡萄根系构型变化的内在机制,从而进一步完善根域限制栽培理论。
1 材料和方法
1.1 材料及处理
本研究以300株一年生‘玫瑰香’葡萄扦插苗为试验材料,定植于上海交通大学果树研究室玻璃温室(31°11′N,121°29′E)内。其中,150株采取根域限制栽培(简称限根组),定植在直径30 cm、高40 cm的限根器中,限根器的四周分布着透水孔,下部用塑料托盘与地面隔开;将土壤、有机肥、河沙按照1∶1∶1混合作为栽培基质。其余150株采取传统地栽方式(非根域限制栽培,简称对照组),将温室中的土壤深翻20 cm后,在其上堆积相同成分的栽培基质,形成厚度为40 cm、宽300 cm的栽培床。对照组初始栽培株行距为60 cm ×60 cm,为保证不同植株间根系发育有足够的空间,我们采取间伐的策略进行样品采集。2种栽培模式下地上部管理方式一致,均保持单蔓生长,每周对副梢进行一次修剪,所有试验材料均配置统一的滴灌设备。肥水管理参照娄玉穗等[5]的方法进行。
1.2 样品采集
实验材料定植于2019年3月29日,经过10 d的缓苗,分别于定植后10、25、40、55、70、85、100、115、130、145、160和205 d采集限根组和对照组植株的根系样品,限根组和对照组分别记为RR和nR。由于定植后10和25 d新生白根数量少,分别选取18株树进行取样,6株为一个重复,共设置3组重复;随后白根数量增加,每个取样点分别选取6株树,2株为一个重复,设置3组重复。为保证根系完整性,采用流水冲洗根部周围土壤,挖取植株时,以葡萄的主干为中心,以冠幅为参考标准确定根部挖取范围;限根组葡萄根系采样时,用流水将限根器内的土壤淋湿,后将限根器拆开,同样用流水将土壤冲散,取出葡萄全根系。清洗干净取出的葡萄全根系,用吸水纸吸干,将葡萄根系均匀摊开、置于黑色背景布上拍照。同时取下幼嫩的白根,迅速用液氮处理,并保存于-80 ℃超低温冰箱中备用。
1.3 生长素含量测定
葡萄根中生长素(IAA)含量利用固相萃取反相高效液相色谱荧光检测法,参照Xin等[22]和符继红等[23]的方法。色谱柱采用Waters sunfire C18(150 mm×4.6 mm,5 μm),流动相为乙腈-10 mmol/L乙酸钠(20∶80,V/V,乙酸调节至pH 3.5)。在流速1 mL/min,进样量20 μL,柱温20 ℃,样品温度10 ℃,荧光激发和发射波长分别为275和345 nm条件下,分离测定IAA含量。
1.4 根系细胞结构观察
选取限根组和对照组中定植70 d的葡萄根系进行细胞结构观察。观察的根系样品包括老根从距离根茎连接处2 cm处横剖、幼根从距离根尖2 cm处横剖、幼根根尖纵剖和毛细根横剖。石蜡切片的制作过程参照安吉翠[24]的方法。制片完成后使用Olympus BX61显微镜进行观察摄影。
1.5 基因表达分析
1.5.1 总RNA提取总RNA的提取使用Tiangen公司的RNA plant plus Reagent植物总RNA提取试剂盒,按照说明书步骤操作。
1.5.2 引物设计利用Primer 5软件进行特异性引物设计,要求上游引物和下游引物的Tm值相差在1 ℃以内,GC含量保持在40%~60%;引物长度保持在17~25个碱基对(base pair,bp);引物合成后,稀释成100 μmol/L的母液,-20 ℃保存备用,用时可稀释成10 μmol/L的工作液使用。引物序列见表1,委托上海睿勉生物进行引物合成。
1.5.3 cDNA的合成和荧光定量PCR以总RNA为模板,参照TaKaRa的PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书反转录合成cDNA。以cDNA为模板,使用1.5.2中合成的引物序列,参考TB GreenTMPremix Ex TaqTMⅡ试剂盒的使用步骤,利用Bio-Rad iQ5(Hercules, CA, USA)荧光定量PCR仪检测目的基因的表达水平。优化后的反应条件为:95 ℃预变性60 s;95 ℃变性 5 s,60 ℃退火 15 s,40个循环;72 ℃ 20 s。试验设置3次重复。参考Jiu等[25-26]的方法,以葡萄KyActin1基因作为内参基因,各基因的定量水平采用2-ΔΔCt方法计算。
1.6 数据处理
用Excel 2010和SAS 9.2软件(SAS Institute, Cary, North Carolina)对获取的数据进行统计分析,并进行单因素方差分析(One-way ANOVA)及最小显著性差异法(LSD法)检验(P<0.01),使用Origin 9软件制图。

表1 用于荧光定量PCR 的 引物序列
2 结果与分析
2.1 根域限制对葡萄根系构型和细胞结构的影响
首先,与对照组相比,限根组葡萄根系构型发生显著变化,主要表现在根域限制后根尖处出现大量集群根、不定根持续发生、根系出现螺旋卷曲(图1,A)。其次,根域限制栽培后,由于葡萄的根系构型发生了极显著的改变,与之密切相关的根系细胞结构和细胞大小也会相应发生改变(图1,B)。其中,葡萄老根的细胞在根域限制处理后大部分呈圆形或椭圆,相比较而言,对照组老根的细胞大部分呈长方形,细胞排列更紧密(图1,B、a);葡萄具有吸收能力的毛细根结构在根域限制后也出现了显著的变化,具体表现在表皮细胞分布更均匀,中柱鞘和皮层细胞更大,内皮层细胞更厚(图1,B、b);葡萄幼根根尖的根冠区对根尖主要起到保护作用,根域限制处理后,其根冠区明显更厚(图1,B、c);而且根域限制栽培下幼根细胞排列更疏松,细胞更长、更大(图1,B、d)。
2.2 根域限制对葡萄根中IAA含量的影响
为进一步解析根域限制影响葡萄根系构型的机理,本研究采用液质联用法(HPLC-MS/MS)分析了根域限制对一年生‘玫瑰香’葡萄幼嫩根系中IAA含量的影响(图2)。其中,在定植后40、100、145和205 d,限根组葡萄幼根中IAA含量极显著低于对照组(P<0.01),尤其在定植后205 d时,对照组根系中IAA含量高达255.2 ng/g,约是对照组的19.0倍。整体来看,限根组葡萄根系中IAA含量在4个采样时期呈现先降低后上升的趋势,而在对照组中IAA的含量呈现先升高后降低然后又快速上升的趋势。由此可见,根域限制处理不仅对葡萄根中IAA的含量产生影响,还使得IAA含量在不同时期发生显著动态变化。

不同大写字母表示相同时期nR和RR之间在0.01 水平差异显著(P<0.01);下同图2 根域限制条件下“玫瑰香”葡萄的根系IAA含量的变化Different capital letters indicate significant differences between nR and RR on the same growth days at the 0.01 level (P<0.01); the same for the following figuresFig.2 The root IAA content of grapevine (Vitis vinifera L. cv. Muscat Hamburg) under root restriction treatment
2.3 根域限制对葡萄细胞周期和根伸长相关基因表达的影响
通过形态学观察和解剖结构分析发现,根域限制抑制葡萄不定根的伸长、致使不定根的根尖簇生大量集群根,根尖膨大且伴有明显的增生。因此,本研究对几个与细胞周期调控和根伸长相关的基因进行了qRT-PCR分析。结果(图3)显示,在大多数取样时期,根域限制处理对葡萄细胞周期调控和根伸长相关基因的表达水平产生了显著的影响。首先,根域限制对细胞周期调控基因VvcycA1、VvcycB1、Vvcdc2、Vvcycd3表达量的影响存在相似性,大部分时间都显著高于同期对照(图3,Ⅰ~Ⅳ)。其中,限根组VvcycA1基因表达量除在定植后10 d显著低于对照,在定植40和55 d与对照相近外,其余时间与对照组相比均显著上调表达;而根域限制显著诱导VvcycB1基因在定植后70、85、100、130和205 d时比对照组上调表达,在定植10、140和160 d时下调表达;限根组Vvcdc2基因的表达量除定植后25和55 d显著低于对照组外,其余10个采样时期均显著高于对照组;同样,限根组Vvcycd3的表达量在定植后160 d比对照组显著下调,在定植10、25和145 d与对照组相近,其余取样时期均显著高于对照组。由此可知,根域限制可能通过诱导VvcycA1、VvcycB1、Vvcycd3和Vvcdc2基因的上调表达来加快细胞分裂的进程。其次,根域限制也显著影响根伸长相关的基因VvLRP1和VvSWP1的表达(图3,Ⅴ、Ⅵ)。其中,与对照组相比,根域限制在定植后的7个采样时期均显著抑制VvLRP1的表达水平,而在定植后的9个采样时期显著促进VvSWP1的表达水平,说明这两个基因在根域限制诱导下发挥相互拮抗的作用。然而,根域限制处理后VvLRP1基因上调表达的5个时期,VvSWP1基因同样上调表达,又说明在有些时期二者发挥着协同的作用。由此可以看出,根域限制处理后,VvLRP1和VvSWP1在根系不同发育阶段发挥的作用存在较大差异。
2.4 根域限制对葡萄生长素代谢相关基因表达的影响
2.4.1 生长素合成相关基因表达前人研究表明,IPA途径对拟南芥中的生长素生物合成至关重要,并且YUC家族是该途径中的限速步骤[27]。本研究结果显示,葡萄根中IAA合成相关基因VvTAA1、VvTAR2、VvYUC2、VvYUC4、VvYUC6和VvYUC8的表达在根域限制条件下受到了不同程度的影响(图4)。其中,根域限制葡萄根系VvTAA1基因在定植10~40 d下调表达,从定植55 d开始受到显著诱导并上调表达,其在定植后115 d时表现尤为明显,限根组表达量约是对照的26.2倍;随后除定植160 d显著下调表达外,其余时期仍表现为上调表达(图4,Ⅰ)。与VvTAA1基因表现相反,VvTAR2基因表达量在采样前期受根域限制的上调诱导更为明显,尤其在定植55 d时表现最为突出,限根组表达量约是对照的31.2倍;之后,短暂显著下调表达(定植70 d),再持续上调表达(定植85~130 d);随之,在定植145~205 d显著下调表达(图4,Ⅱ)。同时,与对照组相比,葡萄根系VvYUC2和VvYUC4基因的表达水平在根域限制诱导下多数时期均上调,而VvYUC6和VvYUC8基因多数时期表达量均下调(图4,Ⅲ~Ⅵ)。整体来看,在定植后100、145和205 d时,葡萄根系中VvYUC6的表达量与IAA含量变化一致,而在定植后40、145和205 d时,根中VvYUC8的表达量与IAA含量变化一致,说明这两个基因可能在葡萄根域限制调控根系IAA合成中发挥着重要的作用。

图3 根域限制条件下葡萄幼根中细胞周期和根伸长基因表达的变化Fig.3 Changes in expression levels of cell cycle and root growth regulatory genes of grapevine (Vitis vinifera L. cv. Muscat Hamburg) roots under root restriction treatment
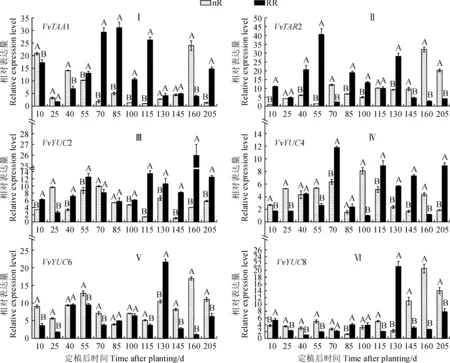
图4 根域限制条件下葡萄根系IAA合成相关基因表达的变化Fig.4 Changes in expression levels of IAA biosynthesis genes of grapevine (Vitis vinifera L. cv. Muscat Hamburg) under root restriction treatment

图5 根域限制条件下葡萄根系IAA受体基因表达的变化Fig.5 Changes in expression levels of IAA receptor genes of grapevine (Vitis vinifera L. cv. Muscat Hamburg) roots under root restriction treatment
2.4.2 生长素受体基因表达生长素与受体结合后才能实现信号的顺利传递,从而发挥调控作用[16]。目前已经明确的IAA受体蛋白有ABP1和TIR1[17,28-29]。qPCR分析结果也显示,根域限制下葡萄根系生长素受体基因VvABP1和VvTIR1的表达量均发生了显著变化(图5)。其中,根域限制处理根系VvABP1基因的表达水平在定植后25、85、100和205 d时均显著高于对照组,而在定植后10、55、70、115、130和160 d时均显著低于相应对照组,尤其在定植后160 d时约是对照组的1/14(图5,Ⅰ);同时,根域限制处理在定植后70、100、130和205 d时均显著诱导根系中VvTIR1基因的上调表达,特别在定植后130 d时表达丰度最高,根域限制的诱导效果最为显著;而对照组根系中VvTIR1基因在定植后160 d时表达丰度最高(图5,Ⅱ)。整体来看,葡萄根系VvABP1和VvTIR1基因在整个采样时期的表达变化趋势较为一致。

图6 根域限制条件下葡萄根系中IAA运输相关基因表达的变化Fig.6 Changes in expression levels of IAA transport-related genes of grapevine (Vitis vinifera L. cv. Muscat Hamburg) roots under root restriction treatment
2.4.3 生长素运输相关基因表达生长素主要依赖细胞膜上的载体蛋白实现向细胞内外的运输,AUX/LAX家族是IAA向细胞内运输的载体蛋白[30],而ABCB/PGP/MDR家族和PIN蛋白家族是IAA向细胞外运输的载体[31]。图6显示,葡萄根系VvAUX1等8个生长素运输相关基因在根域限制后的表达模式存在一定的相似性,它们在定植后70、85和130 d时均受到显著诱导而上调表达,这与上述根域限制下根系大量发生的时期相吻合,而它们在定植后145和160 d时的表达丰度与其他时期相比处于较低的水平。其中,在定植后70 d,根域限制诱导VvAUX1(图6,Ⅰ)和VvLAX2(图6,Ⅲ)上调表达效果最为显著;根域限制诱导VvLAX1(图6,Ⅱ)和VvLAX3(图6,Ⅳ)的表达量均在定植后130 d达到峰值,分别为同期对照组的2.7和5.1倍;根系VvPIN1和VvPIN4的表达模式较为相似,它们在限根组定植后55~130 d以及205 d时的表达水平均显著高于对照组,并以定植后85 d和130 d时受到根域限制的诱导作用最为显著,且两基因均在定植后85 d时增长幅度最大,此时限根组分别为对照组的15.1和23.7倍(图6,Ⅴ、Ⅵ);在定植后70 d、85 d、100 d、130 d和205 d,根域限制组中VvABCB1的表达量显著高于对照组,而在其他时期均低于对照组(图6,Ⅶ);在定植后25、55、85、100、115、130和205 d时,根域限制组中VvABCB19的表达量均显著高于对照组,而在其他时期与对照组相比没有显著性差异(图6,Ⅷ)。整体来看,在多数时期,根域限制处理均能显著诱导生长素运输相关基因的表达水平,也表明根域限制加快了葡萄根中生长素的运输过程。
3 讨 论
3.1 根域限制对葡萄根系细胞结构、细胞周期和根系伸长的影响
与传统地栽组相比,葡萄根系构型在根域限制后发生极显著变化,主要表现在根尖处出现大量集群根、不定根持续发生、根系出现螺旋卷曲,其表型改变与根系细胞结构和细胞大小的改变密切相关。根域限制处理后,根系细胞排列更加疏松,说明细胞需要不断脱落更新,这与根域限制后根系更新加快的表型吻合。其次,可能由于限根器对根尖存在压力胁迫,导致幼根根尖的根冠区更厚,从而实现对根尖的保护。另外,由于根系被局限在一定的容积内,导致吸收根更多、更粗壮,吸收根的内皮层细胞则更厚,中柱鞘和皮层细胞都更大。
根系的伸长得益于根尖分生区细胞的分裂和伸长区细胞的延伸。本研究筛选了细胞周期调控相关基因VvcycA1、VvcycB1、VvcycD3和Vvcdc2以及根系伸长相关的基因VvLRP1和VvSWP1进行表达分析。在8月中旬到11月初,葡萄细胞周期调控相关基因VvcycA1、VvcycB1、VvcycD3和Vvcdc2的表达量受到根域限制诱导呈现显著上调表达,这也与该时期根系快速更新的变化相一致。然而,在4月初到5月中下旬,根域限制组和对照组中上述基因的表达量几乎没有显著差异,可能是由于在根域限制处理的前期,限根器对根系伸长生长的阻碍作用尚不明显,使得根系中细胞周期相关基因的表达未发生显著变化。LRP1基因在不定根及侧根原基中特异表达,对根系伸长和侧根发生起到了促进作用[32]。SWP1基因位于LRP1基因的上游,会抑制LRP1基因发挥作用。前人研究表明,敲除SWP1基因使得LRP1的表达量上调,进而促进拟南芥根系的伸长生长[32-33]。本研究结果表明,在定植后10、70、85、100和205 d,葡萄根域限制显著诱导VvLRP1基因上调表达,潜在表明上述时期侧根发生和根系伸长的速度快于对照组。然而,本项研究也发现,根域限制处理后,VvLRP1和VvSWP1在葡萄根系不同发育阶段发挥的作用存在较大差异,二者在部分时期协同调控根系生长,而在有些时期VvSWP1的上调表达会抑制VvLRP发挥作用,这与Krichevsky等[32]的研究结果有差异。
3.2 根域限制对葡萄根系生长素代谢相关基因表达的影响
植物根中的IAA主要依赖于根尖自身合成和地上部幼嫩组织合成后转运而来。因此,要明确根域限制对根中IAA含量的影响,不仅要分析根域限制处理对IAA合成基因的影响,还要分析根域限制对IAA运输相关基因的影响。本研究结果表明,在定植后40、100、145和205 d时,根域限制组葡萄根中IAA的含量均显著低于对照组。同时,6个IAA合成相关基因中仅有VvYUC6和VvYUC8的表达模式与IAA含量变化趋势较为一致,表明这2个基因可能对于根域限制下葡萄根中IAA合成发挥着重要的作用;而其他几个基因,诸如VvYUC2、VvTAA1等,在多数时期却受到根域限制处理的诱导上调表达,这与根域限制下根中IAA含量下降的趋势不一致。这可能从侧面反映出,根域限制可能对葡萄根中IAA的极性运输产生了更大的影响。植物根中生长素的极性运输包括向基性和向顶性两个不同方向,其中多种生长素转运蛋白参与该过程[15]。本研究发现,在葡萄定植后的多个时间点,根系向基性转运蛋白基因VvAUX1、VvPIN1和VvPIN4的表达水平明显上调,同时向顶性转运蛋白基因VvLAX1/2/3、VvABCB1和VvABCB1的表达也受到根域限制的诱导呈现上调表达。表明葡萄根域限制致使生长素的极性运输加剧,这可能是因为根域限制下根域空间有限,根系生长受限,幼嫩部位合成的生长素只有通过加快极性运输进程才能使葡萄抵御这一根域逆境胁迫。因此,根域限制通过调控生长素合成和极性运输相关的基因表达丰度来影响根系中生长素的合成和运输。
综上所述,根域限制下葡萄根系构型、细胞结构以及内源IAA均发生显著变化。此外,根域限制可能通过改变了根系中生长素合成和极性运输相关基因的表达丰度,从而影响根系中生长素的合成和运输,进而改变了葡萄的根系构型以适应根域限制的栽培环境。该研究有助于阐明根域限制栽培影响葡萄根系构型变化的内在机制,为进一步完善根域限制栽培理论奠定了坚实的基础。
