青稞HvtAGO1基因的克隆及其在条纹病胁迫下的表达
2021-03-10姚晓华安立昆姚有华白羿雄吴昆仑
姚晓华,王 越,安立昆,姚有华,杨 雪,白羿雄,吴昆仑*
(1 青海大学, 西宁 810016;2 青海省农林科学院, 西宁 810016;3 青海省青稞遗传育种重点实验室/国家麦类改良中心青海青稞分中心, 西宁 810016)
青稞(HordeumvulgareL. var.nudumHook. f.)为禾本科大麦属,是栽培大麦的一个变种,因其成熟时籽粒内外稃与颖果分离,籽粒裸露,故又称裸大麦[1]。公元5世纪以来,青稞是藏族同胞的主粮,在青藏高原被广泛种植,为藏区的粮食安全提供了重要保障[2-3]。青稞籽粒含有丰富的营养成分和生理活性物质,因此具有丰富的营养价值和医药保健作用[4-5]。
条纹病是青稞生产中一种常见的种传病害,主要由麦类核腔菌[Pyrenophoragraminea(Rabenh.) Ito et Kurib.]引起,属于真菌性病害[6]。条纹病害一旦发生会使大麦产量大幅度降低,易感品种产量可降低92%[7];2012年青海省青稞条纹病发生面积5.2×104hm2,占播种面积的60%,发病率在15%~20%,重者达50%,条纹病严重影响着青稞的产量与品质[8]。目前条纹病的主要防治方法是种子包衣[9],但青藏高原地区生态环境脆弱,严控农药化肥,种子包衣防治难以推行,因此抗病品种的选育是防控条纹病最有效、最环保的方式。大麦条纹病抗性是一个复杂的性状,涉及许多抗病基因[10]。数量性状位点(QTL)分析是大麦抗病育种中获得关键性状基因的有效方法[11-12]。例如,将QTL分析应用于抗条纹病和易感大麦品种杂交后代,鉴定出Rdg1a和Rdg2a两个抗病基因,分别位于2HL和7HS染色体上[12-15],其过表达显著增强了大麦对条纹病的抗性[16-19]。然而,通过QTL分析,只发现了少数抗条纹病基因。说明通过传统的基因定位获得抗条纹病基因可能遇到了瓶颈,因此需要新的方法和视角来探索与条纹病抗性相关的植物新基因。
Argonaute(AGO)蛋白是核糖核酸介导的转录后基因调控复合物的重要蛋白,最初在拟南芥中发现[20]。该蛋白主要由可变N端、PAZ(PIWI-Argonaute-Zwille)、PIWI(Pelement-induced wimpy testis)和MID(Middle)4个结构域组成,有的还有DUF1785(Domains of unknown function protein 1785)和AgoL2(Argonaute linker 2)两个结构域,其中PAZ 结构域和C末端的PIWI 结构域为2个标志性的功能域[21-22]。研究表明,AGO蛋白可以与不同类型的小RNA结合,在植物的抗病中发挥重要作用。番茄miR403可以通过靶向AGO2基因调控叶缩短病[23];在水稻中,病毒诱导的OsAGO18能够抑制miR168,从而减轻miR168对水稻OsAGO1的抑制,使感染RSV病毒(Ring Sopt Virus)的水稻具有抗病毒防御能力[24];在烟草中,AGO1的差异表达能够改变植物对病毒感染的耐受能力,使遭受病毒侵染的烟草不仅恢复性状,同时还增强了冷胁迫的耐受能力[25]。
本研究通过分析不同抗性青稞品种条纹病感染后的转录组测序结果,鉴定出一个差异表达的AGO基因,在Swiss-Prot中被注释为AGO1基因。在抗病品种‘昆仑14号’和感病品种‘Z1141’中克隆了该基因,分析了其序列的结构、生理生化特性以及与其他禾本科植物的进化关系,利用psRNATarget在线工具预测了调控该基因的miRNA(hvu-miR168-5p),并利用降解组测序验证了两者的靶向关系。利用实时荧光定量PCR分析了HvtAGO1基因和调控其表达的hvu-miR168-5p在青稞条纹病胁迫下的响应模式,以期为进一步研究HvtAGO1基因的抗条纹病功能和抗病机理奠定理论基础。
1 材料和方法
1.1 材 料
抗病青稞品种‘昆仑14号’和感病青稞品种‘Z1141’由青海大学农林科学院作物栽培与育种研究所青稞研究室提供。‘昆仑14号’条纹病发病率<10%,‘Z1141’条纹病发病率>90%。
1.2 方 法
1.2.1 青稞叶片总RNA的提取及cDNA合成利用植物总RNA提取试剂盒(天根)提取青稞品种‘昆仑14号’和‘Z1141’的总RNA,用超微量核酸蛋白测量仪(NanoPhotometer)测定RNA的浓度和纯度,以1.5%琼脂糖凝胶电泳检测质量。参照第一链cDNA合成试剂盒PrimeScript 1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA,-80 ℃保存。
1.2.2 青稞HvtAGO1基因的克隆从‘昆仑14号’和 ‘Z1141’ 青稞品种条纹病感染前后差异表达的转录组测序(RNA-seq)结果中获得1个差异表达的AGO基因(Gene IDHORVU7Hr1G007000),利用Primer5.0设计该基因引物(表1)。以青稞‘昆仑14号’和‘Z1141’叶片cDNA 为模板进行PCR扩增(东洋纺试剂盒)。扩增体系为25 μL,其中2×PCR Buffer for KOD Fx缓冲液12.5 μL、上下游引物各0.5 μL(10 μmol·L-1)、dNTPs 5 μL(2 mmol·L-1)、KOD酶0.5 μL(1.0 U·μL-1)、cDNA模板1 μL、ddH2O补足至25 μL。反应程序:94 ℃预变性 2 min;98 ℃变性 10 s,56 ℃退火 30 s,68 ℃延伸40 min 30 s,35个循环;72 ℃延伸10 min,最后4 ℃ 保持5 min。乙醇沉淀法回收目的条带,用超微量核酸蛋白测量仪测定回收产物的浓度和纯度,再将其连接到pEasy-Blunt载体(全式金生物)上,转化至大肠杆菌Trans-T1感受态细胞。挑取5个白斑单菌落进行阳性克隆鉴定,至少3个阳性克隆送至上海生物工程股份有限公司,使用通用引物M13测序。
1.2.3 青稞HvtAGO1基因生物信息学分析利用Expasy Protparma(http://www.expasy.org/tools/protp aram.html)和Protscale(https://web.expasy.org/protscale/)预测蛋白质的理化性质和亲/疏水性。利用SignalP4.1(http://www. Detaibio.com/tools/signal-peptide.html)和TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白质的信号肽和跨膜结构。利用CELLO 2.5 (http://cello.life.nctu.edu.tw)对HvtAGO1蛋白进行亚细胞定位预测。利用SMART(http://smart.embl-heidelberg.de/)预测结构域。利用SPOMA(https:// npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)预测HvtAGO1蛋白的二级结构和三级结构。利用SignalP 4.1(http://www.detaibio. com/tools/signal-peptide. html)和TMHMM-2.0(http://www. cbs. dtu. dk/services/TMHMM-2.0/)预测蛋白质的信号肽和跨膜结构。利用NCBI中的Blastp功能,查询与HvtAGO1蛋白同源的禾本科其他物种AGO1蛋白序列,用DNAMAN6.0软件进行多序列比对,用Mega5.1软件构建系统进化树。
1.2.4 调控HvtAGO1基因的miRNA鉴定利用psRNATarget(http://plantgrn.noble.org/psRNATarget/analysis?function=1)预测调控HvtAGO1基因的miRNA。利用降解组测序验证miRNA与HvtAGO1基因的靶向关系。

表1 引物序列
1.2.5HvtAGO1基因及其调控miRNA在青稞条纹病胁迫下的表达分析采用Primer5.0设计hvu-miR168-5p和HvtAGO1的qRT-PCR引物,利用实验室建立的青稞条纹病侵染体系,获得条纹病侵染20 d后‘昆仑14号’和‘Z1141’正常叶片和感病叶片[26]。提取叶片总RNA,反转录后以cDNA(200 ng·μL-1)为模板,分别以5SrRNA和TC139057为内参进行实时荧光定量PCR(qRT-PCR)分析,引物序列见表1。反应体系为20 μL,其中TB Green premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)10 μL,cDNA模板2 μL、(10 μmol·L-1)各0.8 μL和ddH2O 6.4 μL。qRT-PCR扩增条件:95 ℃预变性5 min; 95 ℃变性5 s, 60 ℃退火30 s,72 ℃延伸30 s,循环40次;溶解曲线,95℃ 5 s,70 ℃ 1 min。应用2-ΔΔCt法计算基因相对表达量[27]。每个样品设3次生物学重复。
2 结果与分析
2.1 青稞HvtAGO1基因的克隆与序列分析
以‘昆仑14号’和‘Z1141’的叶片总RNA反转录的cDNA为模板,HvtAGO1-F/R为引物,扩增到一条约3 675 bp的目的条带(图1)。其完整开放阅读框为3 651 bp,编码1 217个氨基酸(GenBank 登录号 MW387021)。测序后比对,‘昆仑14号’和‘Z1141’的碱基序列及其编码的氨基酸序列相似性均为100%。利用SMART对其氨基酸序列进行保守结构域预测,发现该基因具有典型的 PIWI、PAZ和DUF1785结构域,同时具有Gly-rich-ArgoN(Glycine-rich region of argonaut)、ArgoN(N-terminal domain of argonaute)、ArgoL2 (Argonaute Linker 2)和ArgoMid(Mid domain of argonaute)结构域,属于AGOs 基因家族(图2)。
蛋白质理化性质分析表明,HvtAGO1蛋白分子式为C5861H9195N1785O1746S37,分子量为133.79 kD,不稳定指数为50.90,脂溶指数是65.90,理论等电点为9.49,其中负电荷残基(Asp + Glu) 为112个,正电荷残基(Arg + Lys)为149个。平均疏水性(GRAVY)为-0.694。预测结果表明,HvtAGO1蛋白是一个亲水性的不稳定碱性蛋白。对HvtAGO1蛋白跨膜结构与信号肽预测发现,该蛋白不存在跨膜结构,且无信号肽。CELLO V.2.5分析表明,HvtAGO1蛋白可能定位在细胞周质中,得分为1.492。该蛋白定位到细胞结构的可能性:细胞周质(1.492)>细胞外(1.165)>外膜(0.818)> 细胞质(0.802)>内膜(0.722)。

图2 HvtAGO1基因结构域预测Fig.2 Domain prediction of HvtAGO1 gene

蓝色表示α-螺旋;红色表示延伸链;绿色表示β-转角;橙色表示无规则卷曲; 紫色表示HvtAGO1蛋白氨基酸长度图3 HvtAGO1蛋白二级结构预测Blue stands for α-helix; Red stands for extended chain; Green stands for β- turn; Orange stands for randon coil; Purple stands for the amino acid length of HVTAGO1 proteinFig.3 Secondary structure prediction of HvtAGO1
对HvtAGO1蛋白的二级结构预测结果表明:HvtAGO1蛋白的二级结构主要是由无规则卷曲、α-螺旋、延伸链、β-转角组成,其中无规则卷曲占56.41%,α-螺旋占25.74%,延伸链占13.40%,β-转角占4.44%(图3),可见该基因是以无规则卷曲和α-螺旋为主,这2个二级结构在蛋白行使功能时可能发挥重要作用。用SWISS-MODEL对HvtAGO1蛋白进行三级结构预测,由图4可知,HvtAGO1蛋白的功能结构域折叠成锤子状,主要由无规则卷曲和α-螺旋构成,锤身包含了PIWI特征结构域;锤柄主要包含PAZ特征结构域。Unipro基因注释结果表明该蛋白为AGO1,因此将该基因命名为HvtAGO1。

图4 HvtAGO1蛋白三级结构预测Fig.4 Tertiary structure prediction of HvtAGO1

Hvt. 青稞;Hv. 大麦;Bd. 二穗短柄草;Si. 粟;At. 山羊草; Tu. 乌拉尔图小麦;Zm.玉米;黑线表示DUF1785结构域;红线表示PAZ结构域;绿线表示PIWI结构域图5 HvtAGO1与其他禾本科植物蛋白和DUF1785、PAZ和PIWI结构域序列比对Hvt. Hordeum vulgare(Tibetan hulless barley);Hv. Hordeum vulgare;Bd. Brachypodium distachyon;Si. Setaria italica;At. Aegilops tauschii;Tu.Triticum urartu;Zm. Zea mays;The bold black frame represents NB-ARC conserved functional region of N/A protein;The black line represents DUF1785 conserved domain; The red line represents PAZ conserved domain; The green line represents PIWI conserved domainFig.5 Multiple alignment of HvtAGO1 and three domains (DUF1785, PAZ and PIWI) compared with other Gramineae plants
2.2 HvtAGO1蛋白的同源比较及系统进化分析
图5显示,青稞HvtAGO1蛋白与山羊草(Aegilopstauschii)、二穗短柄草 (Brachypodiumdistachyon)和乌拉尔图小麦(Triticumurartu)等的AGO1蛋白序列相似性分别为96.64%、79.34%和80.07%,这些序列都具有高度保守的DUF1785、PAZ和PIWI结构域。系统进化树表明,在7种禾本科植物种中,青稞HvtAGO1蛋白与山羊草的亲缘关系最近,与玉米和粟的亲缘关系较远(图6)。

图6 HvtAGO1蛋白与禾本科其他植物系统进化树Fig.6 Phylogenetic tree analysis of the HvtAGO1 protein and other Gramineae plants

A. hvu-miR168-5p剪切靶基因HvtAGO1的位置;B.hvu-miR168-5p剪切靶基因HvtAGO1的靶点鉴定;在A中HvtAGO1下方箭头和B中圆点表示hvu-miR168-5p指向的裂解位点图7 hvu-miR168-5p剪切靶基因HvtAGO1的位置和靶点鉴定1.Position of hvu-miR168-5p shearing target gene HvtAGO1; B. Target identification of hvu-miR168-5p shearing target gene HvtAGO1; The arrow below HvtAGO1 in A and the dot in B indicated hvu-miR168-5p-directed cleavage siteFig.7 Position and target identification of hvu-miR168-5p shearing target gene HvtAGO1
2.3 调控HvtAGO1基因的miRNA的鉴定
利用在线工具预测调控HvtAGO1基因的miRNA为hvu-miR168-5p;同时降解组测序结果证明,HvtAGO1确实为hvu-miR168-5p的靶基因,其剪切位置为HvtAGO1基因的832 bp处(图7)。由此说明hvu-miR168-5p和靶基因HvtAGO1存在靶向作用关系。
2.4 hvu-miR168-5p和靶基因HvtAGO1在条纹病胁迫下的表达
利用实时定量PCR检测了HvtAGO1和调控其表达的hvu-miR168-5p在条纹病胁迫下的表达模式。结果(图8)表明,抗病青稞品种‘昆仑14号’和感病青稞品种‘Z1141’在条纹病菌感染后,hvu-miR168-5p和其靶基因HvtAGO1表达量均极显著上调(P<0.01)。其中,病菌侵染后hvu-miR168-5p在‘昆仑14号’叶片表达量为未侵染的42.24倍,而‘Z1141’为未侵染的7.21倍;病菌侵染后HvtAGO1在‘昆仑14号’叶片的表达量为未侵染的14.37倍,‘Z1141’为未侵染的5.08倍。且病菌侵染后,hvu-miR168-5p和靶基因HvtAGO1在‘昆仑14号’叶片的表达量均极显著高于‘Z1141’(P<0.01)。推测hvu-miR168-5p和靶基因HvtAGO1在青稞抗条纹病过程中发挥重要作用。
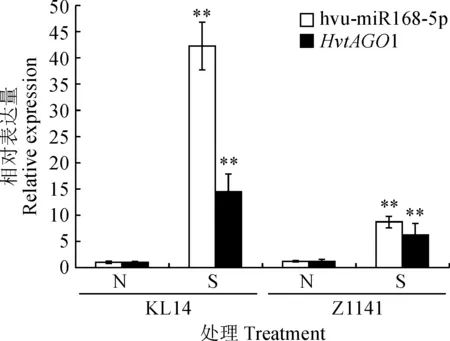
N.正常叶片;S.感病叶片;**表示同一品种同一基因的感病叶片与正常叶片差异极显著 (P <0.01)图8 不同抗性青稞品种hvu-miR168-5p和靶基因HvtAGO1在条纹病胁迫下的表达N. Normal leaves; S. Leaves with barley leaf stripe; ** stands for significant difference between leaves with barley leaf stripe and normal leaves within same variety and gene at 0.01 levelFig.8 Expression levels of hvu-miR168-5p and target gene HvtAGO1 in different resistant Tibetan hulless barley infection with barley leaf stripe
3 讨 论
近年来,AGOs家族基因已经从拟南芥、苹果、玉米、水稻等多种高等植物中被分离鉴定出来[28-31]。RNA干扰在植物的生长发育过程中发挥重要的作用,在水稻和玉米中已经证实,AGO蛋白是已知的小RNA调控通路的核心部分,通过抑制靶基因的表达来调控发育过程[30-31]。然而,青稞HvtAGOs相关基因序列和抗病功能目前还没有相关研究。本研究从青稞抗病品种‘昆仑14号’和 感病品种‘Z1141’条纹病感染前后转录组差异表达的基因注释中获得的一个HvtAGO1基因,进一步对其进行了克隆和序列分析。已有研究表明,AGO1 参与的通路包括miRNA 通路、转录后基因沉默(PTGS)通路、病毒诱导的基因沉默(VIGS)或抗病毒沉默通路和ta-siRNA 通路[28]。AGO1主要结合miRNA在细胞质中通过切割靶mRNA或介导翻译抑制在转录后水平抑制靶基因表达[32]。在拟南芥中,AtAGO1 能与病毒siRNA结合形成RNA沉默复合体,在抗病中发挥重要作用[33]。因此推测,HvtAGO1编码的蛋白在青稞中的作用与同类AGO1蛋白在其他植物中的作用相似。
前人研究表明,AGO蛋白包含高度保守的结构域,如DUF1785、PAZ和PIWI,这些结构域在结合sRNA双链和裂解靶RNA中起重要作用[34-36]。本研究从青稞分离的与条纹病相关的HvtAGO1蛋白与山羊草、二穗短柄草、小麦等6个禾本科植物的AGO1蛋白序列相似性为87.05%,其中DUF1875、PAZ和PIWI结构域相似性分别为97.57%,98.44%和96.02%。可见,7个AGO1蛋白虽然相似性不太高,但3个结构域相似性均大于95%,结构域的较高保守性也说明了他们在特异地与小RNA 结合进行目标靶基因切割时,可能存在基因功能的一致性[37]。另外发现,青稞与大麦的AGO1蛋白序列相似性仅为82.69%,青稞与大麦相比,在70~137 bp和185~234 bp产生片段插入,这2个片段的插入导致两者在进化上产生距离,是否会导致功能差异,还有待进一步研究。
2010年Kantar等[38]首次从大麦中分离出miR168,之后又有学者从干旱、镉、铝和盐胁迫下的水稻[39]和黄瓜[40]中分离出miR168。利用转基因拟南芥进行的启动子分析显示,真菌可以激活miR168,而且能够上调控制叶片形态和植物生长[41]。在番茄卷曲叶病毒感染期间也发挥抗病作用[24]。本研究中,青稞条纹病感染前后的降解组测序结果中,HvtAGO1被miR168-5p剪切。研究表明,miR168能够调控AGO1基因的表达,AGO1作为RNA诱导沉默复合物(RNA induced silencing complex, RISC)中转录调控或/和转录后调控的核心元件,负责转录后基因沉默,参与植物发育过程和病毒防御[41]。本研究在证明了HvtAGO1为hvu-miR168-5p的靶基因后,利用qRT-PCR表达分析发现,青稞叶片被条纹病菌侵染后hvu-miR168-5p被激活,且抗病品种表达量显著高于感病品种,推测该miRNA在青稞抗条纹病过程中发挥重要作用,能够正向调控条纹病抗性。同时,靶基因HvtAGO1在受青稞条纹病侵染后,叶片中的表达与hvu-miR168-5p呈相同的表达趋势,这与被RMV、CMV和TCV感染的拟南芥中miR168和AtAGO1的表达量总是与病毒感染过程的进展同时增加的结果类似[42]。HvtAGO1和hvu-miR168-5p表达水平的同时升高可能是两者均具有协同表达调节机制[43]。但两者在青稞抗条纹病过程中的具体调控机制有待进一步研究。
