砧木类型对甜樱桃花芽多胺代谢相关基因表达和休眠的影响
2021-03-10屈玥婷刘勋菊王继源陈秋菊纠松涛张才喜
屈玥婷,刘勋菊,王继源,陈秋菊,纠松涛,张才喜
(上海交通大学 农业与生物学院,上海 200240)
甜樱桃(PrunusaviumL.)是蔷薇科李属的落叶果树。在冬季来临时落叶果树的花芽通常会进入休眠的状态以抵御严寒的天气。只有成功地度过冬季休眠,才能在春季正常开花结果,因此甜樱桃的花芽休眠是其生长发育过程中重要的生理过程。Lang等[1]根据休眠的诱因将休眠分为类休眠、内休眠和生态休眠。类休眠是指植物休眠结构、组织或器官受到相邻器官的抑制而不能正常萌发生长的现象;内休眠是指植物受休眠结构内部生理生化因素的制约,即使有适宜的外界环境也不能正常萌发生长的现象;生态休眠是指植物受到外部环境的制约而引起的休眠,如低温和水分胁迫等,如果条件适宜就可以恢复生长。
先前的研究表明,除光照和温度等因素外,砧木类型也能影响果树休眠的进程[2]。赵丹丹[3]研究发现,‘丰水’梨叶芽的休眠进程与其砧木的需冷量有关,高需冷量的砧木能延缓休眠进程,而低需冷量的砧木能加快休眠进程。李璇等[4]的研究发现,‘丰水’梨嫁接在不同砧木时叶芽的休眠进程不同,嫁接于‘豆梨’的叶芽休眠结束时间早于‘杜梨’且其内部多胺的含量变化符合休眠进程的变化,表明梨叶芽的休眠进程与砧木的种类及其内部多胺代谢相关。汪晓云等[5]对油桃砧木的研究表明,砧木能够影响接穗的萌芽开花和果实成熟。
多胺是植物体在代谢过程中产生的一类小分子有机化合物,植物体内最丰富的几种多胺是腐胺(Put)、亚精胺(Spd)和精胺(Spm)[6-9]。在高等植物中,多胺参与许多生理过程,如花发育和果树休眠等。范克欣[10]研究发现,Put能够促进桃树的花芽进入休眠,而Spd和Spm含量升高能够促进花芽解除休眠。Mohamed等[11]研究表明,在休眠期间葡萄芽内Spm和Spd的含量水平较低,Put含量处于较高的水平,休眠结束后多胺的含量则相反的变化。精氨酸是多胺合成的重要前体,Edwards等[12]研究发现,向还未成花的苹果外源施用精氨酸,对苹果成花的过程能够起到促进作用。此外,干旱和低温的胁迫环境能够提高柑橘和柠檬内的精氨酸含量从而提高多胺的含量促进成花的过程[13]。Wang等[14]早在1985年就比较了早花甜樱桃花芽(EB)与晚花山樱桃花芽(LB)内的多胺含量,在休眠阶段LB内的多胺含量始终保持较高的水平且波动不明显,而EB内多胺虽然含量较低,但在缓慢稳定地增加。休眠结束时,2种类型的花芽内的多胺含量都有所增加,之后才开始出现明显的生长变化。
在植物体中,Put的合成途径有两条:一条是鸟氨酸脱羧酶(ODC)反应途径,另一条是精氨酸脱羧酶(ADC)脱羧反应途径[13]。精氨酸脱羧酶反应途径中,以精氨酸作为反应前体,在ADC的作用下生成Put,Put同时也是Spm和Spd的合成原料。S-腺苷甲硫氨酸脱羧酶(SAMDC)在Spd和Spm的合成过程中也起到了重要作用。多胺的主要分解过程是通过二胺氧化酶(DAO)和多胺氧化酶(PAO)实现的。PAO将Spd和Spm氧化分解生成二氨基丙烷和1-(3-丙氨基)-丙氨酸。因此,多胺氧化酶(PAO)、精氨酸脱羧酶(ADC)和S-腺苷甲硫氨酸脱羧酶(SAMDC)是多胺代谢过程中的关键酶。
前期田间调查发现,同一品种嫁接在不同砧木类型(乔化和矮化)上,其休眠进程和花期存在显著差异。目前,关于此现象还未见相关研究和报道。本试验将从甜樱桃多胺代谢过程中的关键基因PavPAO、PavADC和PavSAMDC以及多胺含量变化等方面开展相关研究,探究砧木类型对甜樱桃多胺代谢过程以及休眠和开花进程的影响机理,
1 材料与方法
1.1 植物材料
本实验采用嫁接于乔化砧木‘马扎德’(Mazzard)和矮化砧木‘吉塞拉6号’(Gisela 6, G6)的7年生的甜樱桃品种‘罗亚理’。Mazzard是世界上广泛使用的一种乔化的樱桃砧木[15],其几乎与所有甜樱桃和酸樱桃品种亲和,且对恶劣的土壤环境具有较强的适应性[15]。G6是亲本为酸樱桃和灰毛叶樱桃的半矮化砧木,树体比Mazzard小20%~30%,其优点是开花早且结果量较大,能够适应各种类型的土壤[16],对李矮缩病毒(PDV)和李属坏死环斑病毒(PNRSV)有较好的抗性[17]。实验材料种植于上海交通大学浦江绿谷基地(31.25°N,121.48°E)。所采取的样品为Mazzard和G6砧的‘罗亚理’一年生枝条的花芽,采样阶段为休眠期到初花期。将采得样品于液氮中冷冻,置于-80 ℃冰箱内储存。
1.2 方 法
1.2.1 形态学观察花芽的统计:随机选取嫁接于2种砧木的‘罗亚理’各3棵树的一年生枝条10根,将所有芽纵切观察内部是花芽或是叶芽,统计每根枝条的花芽分化的百分率,利用Origin做图。
枝条和树体的形态学观察:利用直尺和卷尺等工具对距地面20 cm处树体的粗度和高度进行测定,比较嫁接于乔化和矮化砧木上的树体发育差别。
物候期观察:在休眠的不同时期进行拍照记录,数据的初步统计采用 Origin进行处理。
1.2.2PavPAO和PavADC基因的克隆及系统发育分析取100 μg花芽利用液氮进行研磨,采用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根 DP411),根据产品说明书提取花芽总RNA。以总RNA为模板,参照TaKaRa的PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书反转录合成cDNA。参考NCBI网站(https://www.ncbi.nlm.nih.gov/)进行基因序列的预测,随后利用软件Primer 5.0进行引物设计(表1,1~4)。以cDNA为模板进行PCR扩增后将所得产物利用pEASY®-Blunt进行载体构建,最后送至公司进行测序。
利用MEGA 6.0软件进行系统进化分析,利用DNAMAN软件进行蛋白序列比对。利用在线网站http://netbio.sjtu.edu.cn/对PavADC的互作蛋白进行预测。
1.2.3 多胺含量测定采用HPLC方法对花芽多胺含量进行分析,运行程序、样品前处理方法和标品衍生处理方法参照吴琴燕等[18]并稍作改进。本实验采用Waters高效液相色谱仪进行测定,色谱柱为安捷伦SB-Aq,流动相为60∶40的甲醇和水,检测波长为230 nm,流速0.8 mL/min,柱温30 ℃。Put、Spd和Spm标准品均为Tmstandard的产品。
(1)植物样品前处理方法:取0.5 mg花芽样品液氮研磨,加入4 mL预冷的5%高氯酸溶液冰浴浸提1 h,4 ℃ 1 200 r/min离心30 min后取500 μL上清液加入7 μL苯甲酰氯,混匀后加入2 mol/L NaOH 溶液1 mL,涡旋20 s后置于37 ℃水浴锅反应30 min,取出后加入2 mL饱和NaCl溶液终止反应,再加入2 mL乙醚进行萃取,震荡混匀后1 500 r/min离心5 min,吸取1 mL醚相,于超净工作台吹干,-20 ℃冰箱储存,用时加入400 μL色谱级甲醇溶解上机。
(2)标品衍生处理方法:取配置好的标品共1 mL,加入20 μL苯甲酰氯,混匀后加入2 mol/L NaOH溶液1 mL,30 ℃水浴反应40 min,取出后加入2 mL饱和NaCl溶液终止反应,再加入3 mL乙醚进行萃取,混匀后15 000 r/min离心5 min,吸取1.5 mL醚相,于超净工作台吹干,-20 ℃冰箱储存,用时加入500 μL色谱级甲醇溶解上机。
1.2.4 荧光定量PCR参考TB GreenTMPremix Ex TaqTMⅡ试剂盒的使用步骤,利用Bio-Rad iQ5(Hercules, CA, USA)荧光定量PCR仪检测目的基因的表达水平。运行程序如下:95 ℃预变性3 min,95 ℃ 10 s,55 ℃ 30 s的程序进行39个循环,试验设置3次重复。利用软件Primer 5.0设计引物(表1, 5~10)。以β-actin作为内参基因,利用2-ΔΔCT的方法[19]对荧光定量的结果进行分析得到各个时期基因表达量。
1.2.5 PavPAOs和PavADC的亚细胞定位将3个PavPAOs和PavADC基因连接到pHB载体上,再将构建好的载体转入GV3101农杆菌菌株中,随后摇菌培养,菌液的适宜浓度为A600=1.0。用含有载体的农杆菌菌液注射到3~5周龄的烟草叶片,置于黑暗环境培养3~5 d后,使用德国徕卡(Leica)/TCS SP8 STED 3X激光共聚焦显微镜观察GFP绿色荧光蛋白的分布情况。
1.2.6 双分子荧光互补技术(BiFC) 利用BiFC实验对预测结果进行验证。使用的载体为pXY104和pXY106,同源重组方法构建PavADC-pXY106和PavSAMDC-pXY104的载体。再将构建好的载体转入GV3101农杆菌感受态,涂板挑菌进行阳性克隆的验证后摇菌至A600为0.8~1.0。互作基因载体混合,室温静置2~5 h后,注入生长5周左右的烟草叶片中。经过3 d暗培养后,使用激光共聚焦显微镜进行荧光信号观察。pXY104和pXY106空载体作为实验对照。载体引物见表1(11~12)。
2 结果与分析
2.1 不同砧木类型‘罗亚理’花芽形成及开花物候期和树体发育变化
通过田间观察发现,不同砧木类型甜樱桃‘罗亚理’的开花进程有差异,‘G6-罗亚理’的初花期要早于‘Mazzard-罗亚理’(图1,A)。不同砧木类型上‘罗亚理’的花芽分化状况统计结果显示,在嫁接于不同砧木的‘罗亚理’上各随机选取的10根枝条中,‘G6-罗亚理’花芽分化的百分率高于‘Mazzard-罗亚理’的枝条占整体的80%(图1,B)。此外,本研究对不同砧木类型的‘罗亚理’树高和主干粗度进行了调查,结果显示,‘Mazzard-罗亚理’的树体和主干粗度均高于‘G6-罗亚理’(图1,C)。

表1 引物序列
2.2 不同砧木类型‘罗亚理’花芽多胺含量变化
通过HPLC方法对不同砧木类型‘罗亚理’花芽多胺含量进行了检测,以分析多胺含量差异是否造成不同砧木类型‘罗亚理’开花物候期和花芽形成的不同。由图2可以看出,10月15日至12月15日,不同砧木‘罗亚理’花芽Put含量差异并不明显,而从1月17日开始至3月10日,‘G6-罗亚理’花芽Put和Spd的含量始终高于‘Mazzard-罗亚理’,同时两者差异逐渐增大。整体来看,在休眠期,‘Mazzard-罗亚理’花芽Put和Spd含量变化波动较小;而‘G6-罗亚理’花芽Put和Spd含量在整个阶段均呈现较大的变化,直至休眠结束后花芽萌发时有大幅度的升高。虽然在生物体中Put、Spd和Spm是较为丰富的3种多胺,但在甜樱桃花芽内,Spm含量却很低,仅‘G6-罗亚理’在1月份和3月份有合成;而2种‘罗亚理’花芽Spd的含量整体高于Put。

A. 开花物候期;B. 一年生枝条上形成花芽分化率;C. 距地面20 cm处主干粗度和树体高度图1 不同砧木类型‘罗亚理’的花芽形成及开花物候期和树体发育A. The blooming phenophase; B. The floral bud differentiation rate on annual branches; C. The trunk diameter and the height of the tree 20 cm from the groundFig.1 The floral buds formation, blooming phenophase and the development of ‘Royal Lee’ grafted in different rootstocks
2.3 甜樱桃PavPAOs和PavADC基因的克隆及其生物信息学分析
为更好地明晰不同砧木类型对甜樱桃花芽内多胺含量的影响,本研究对多胺代谢的关键基因PavPAO2、PavPAO4、PavPAO5及PavADC进行克隆,其长度分别为1 485、1 611、1 704和2 307 bp。对不同物种的PAO和ADC蛋白系统进化关系分析结果(图3)表明,PAO家族分为4个亚家族,每个亚家族内蛋白数量分布不同,4个亚家族分别包含15、15、7和7个蛋白。其中,PavPAO2是亚家族Ⅰ的成员,PavPAO4是亚家族Ⅱ的成员,PavPAO5是亚家族Ⅳ的成员。甜樱桃中的PavPAOs与桃、扁桃和苹果等物种的亲缘关系较近,而与甜橙、栓皮栎等物种亲缘关系较远。甜樱桃中的PavADC与桃、扁桃和苹果等物种的亲缘关系较近,而与麻风树、蔓花生等物种亲缘关系较远。ADC家族分为2个亚家族,每个亚家族内蛋白数量分布不均,2个亚家族分别包含12和3个蛋白。其中PavADC是亚家族Ⅰ的成员(图3)。

**P<0.01,* P<0.05图2 不同砧木类型‘罗亚理’花芽内3种多胺的含量变化Fig.2 The contents of 3 types of polyamines in floral buds of ‘Royal Lee’ grafted in different rootstocks

图3 多个物种PAOs(左)蛋白和ADC(右)蛋白进化树Fig.3 Phylogenetic tree of PAOs (Left) and ADC (Right) in different species

图4 甜樱桃PavPAOs氨基酸序列比对Fig.4 Amino acid sequence alignment of PavPAOs of Prunus avium
本研究利用DNAMAN对PavPAOs家族编码蛋白进行了多序列比对,结果(图4)表明,PavPAOs家族不同成员的氨基酸序列存在显著差异。
2.4 不同砧木类型的甜樱桃花芽PavPAOs和PavADC基因的表达
qRT-PCR分析结果(图5,A)显示,不同砧木类型‘罗亚理’花芽PavPAOs和PavADC的表达水平有差异。从休眠期到脱苞期,‘Mazzard-罗亚理’花芽内PavPAO5表达量始终高于‘G6-罗亚理’,这表明在两种花芽内该基因的表达差异可能是‘Mazzard-罗亚理’花芽多胺含量低于‘G6-罗亚理’的原因。在休眠期,PavADC基因在两种砧木‘罗亚理’花芽中的表达丰度均不高;而在发育后期,‘G6-罗亚理’花芽内PavADC的表达水平远远高于‘Mazzard-罗亚理’,说明在发育后期,‘G6-罗亚理’花芽中可能大量合成多胺。在整个休眠期,PavPAO2和PavPAO4的表达量整体水平远远低于PavPAO5的基因表达量,由此推测,PavPAOs家族中,在休眠期起到主导作用的家族成员可能是PavPAO5(图5,B)。
2.5 PavPAOs和PavADC的亚细胞定位
为明确PavPAOs和PavADC蛋白在细胞中发挥生物学功能的场所,本研究利用激光共聚焦显微镜观察融合质粒35S∷PavPAO2-GFP、35S∷PavPAO4-GFP、35S∷PavPAO5-GFP和35S∷PavADC-GFP在烟草叶片表皮细胞中的瞬时表达情况。结果(图6)显示,在瞬时表达PavPAO2-GFP和PavPAO4-GFP融合蛋白的烟草叶片中,在细胞膜上检测到绿色荧光信号;在瞬时表达PavPAO5-GFP和PavADC-GFP融合蛋白的烟草叶片中在细胞膜和细胞核中检测到绿色荧光信号;而在单独表达GFP的对照组中,绿色荧光信号分布于细胞膜、细胞质和细胞核中。根据此实验结果推测PavPAO2和PavPAO4在细胞膜上发挥功能,而PavPAO5和PavADC在细胞核发挥功能。

A. 材料间比较;B. 基因间比较图5 不同砧木类型的甜樱桃花芽PavPAOs和PavADC基因的表达分析A. Comparison between malerials; B. Comparison among genesFig.5 Expression analysis of PavPAOs and PavADC in sweet cherry floral buds of different rootstock types
2.6 PavADC与PavSAMDC在细胞内的相互作用
为解析PavADC在细胞内发挥作用的机制,本研究首先通过在线网站http://netbio.sjtu.edu.cn对其可能的互作蛋白进行预测。结果(图7,A)显示,PavADC与S-腺苷甲硫氨酸脱羧酶(PavSAMDC)蛋白可能存在互作关系。先前的报道表明,SAMDC蛋白是多胺代谢过程中的限速酶,能够使S-腺苷甲硫氨酸(SAM)脱羧生成1-氨基丙基-1-羧酸(ACC)和乙烯,继而促进Spd和Spm的合成[20-21]。因此,为进一步明确两者的互作关系,本研究通过BiFC实验对其进行验证,结果(图7,B)显示,将PavADC-pXY106和PavSAMDC-pXY104菌液混合后注射烟草叶片,培养3~5 d后YFP荧光信号观察发现,在实验组PavADC-pXY106和PavSAMDC-pXY104中可见明显的YFP荧光信号,且荧光信号主要集中在细胞核和细胞膜,而在PavADC-pXY106和pXY104、pXY106和PavSAMDC-pXY104以及pXY106和pXY104等3组阴性对照中均未观察到YFP荧光信号。表明PavADC与PavSAMDC存在相互作用。
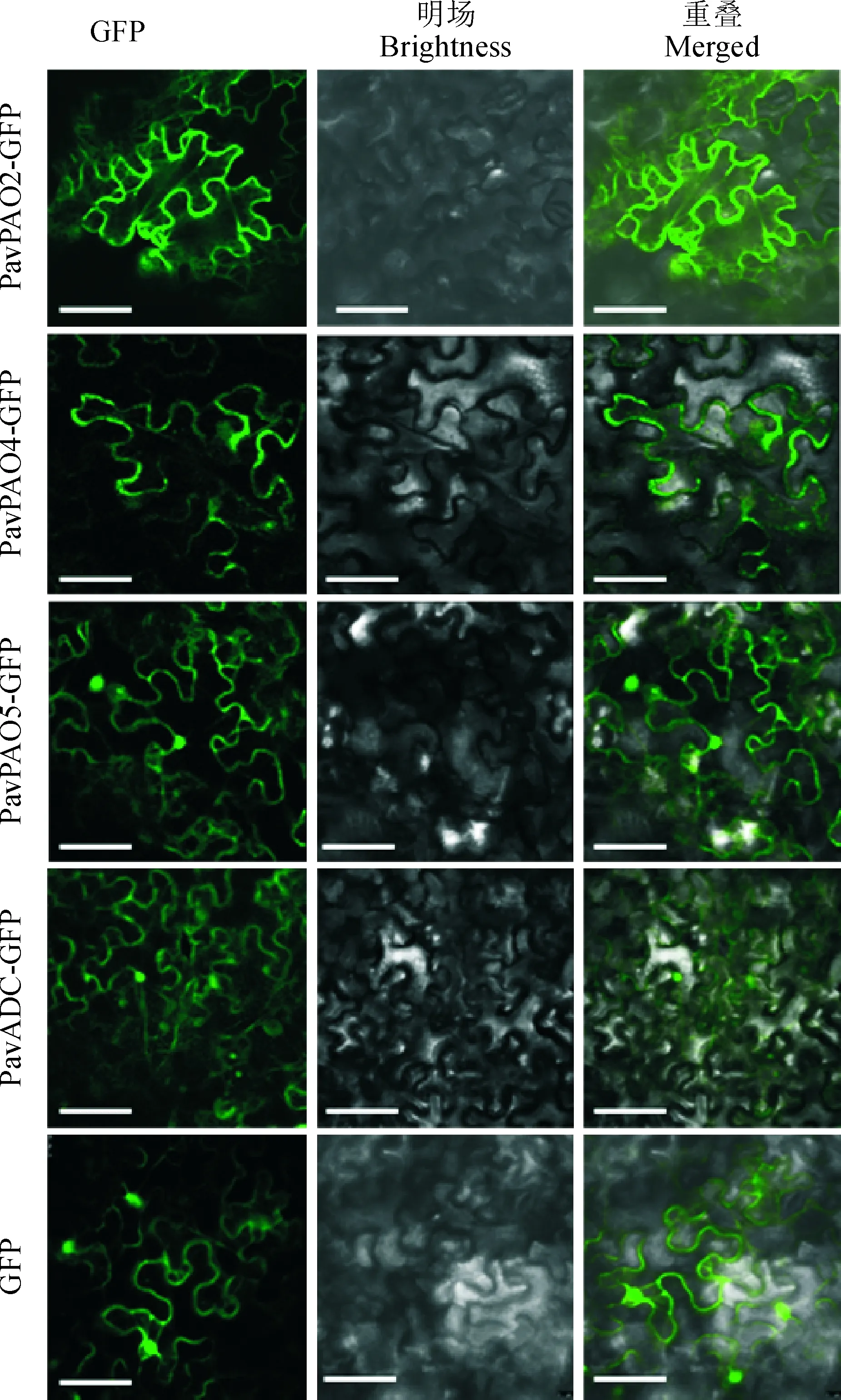
图6 甜樱桃PavPAOs和PavADC在本氏烟草叶片表皮细胞中的亚细胞定位(标尺=50 μm)Fig.6 Subcellular localization analysis of PavPAOs and PavADC in leaf epidermal cells of Nicotiana benthamiana(Bar=50 μm)

A. SAMDC与ADC的互作预测,中心红点为ADC,左侧红圈为SAMDC;B. BiFC实验。激光共聚焦观察烟草叶片中蛋白互作图7 PavADC和PavSAMDC在细胞内相互作用(标尺=50 μm)A. The prediction of the interaction between SAMDC and ADC; B. Bimolecular fluorescent complimentary. The yellow signals were observed with a bimolecular fluorescence complementation assay in Nicotiana benthamiana leavesFig.7 Interactions between PavPAOs and PavSAMDC in cells (bar=50 μm)

图8 不同砧木类型‘罗亚理’花芽内PavSAMDC基因的表达变化Fig.8 The relative expression of PavSAMDC in the floral buds of ‘Royal Lee’ grafted in different rootstocks
2.7 甜樱桃PavSAMDC基因表达分析
为进一步明确PavSAMDC的功能,本研究对不同发育期的花芽的表达模式进行了分析,结果(图8)显示,在休眠前期,PavSAMDC的表达量存在小幅度的波动,而在休眠后期,PavSAMDC的表达量快速升高,花芽开始萌芽开花,此变化规律与PavADC基因表达量的变化规律相同,这也潜在地表明两者协同作用共同调控休眠后期的甜樱桃花芽内多胺的水平,最终促进花芽解除休眠开始萌芽开花。
3 讨 论
3.1 果树花芽内不同种类多胺的含量变化及其作用
多胺在植物生长发育过程中发挥着重要的作用[22],在植物体内最为丰富的几种多胺为Put、Spd和Spm。前期研究发现,在不同物种不同器官中,不同种类的多胺含量不同。吴琴燕等[18]的研究表明,在茶鲜叶中,Spm的含量最高,Put的含量最低,Spd的含量中等;在芽内的多胺含量高于茎,在茎内的多胺含量高于叶片。范克欣等[10]研究发现,在桃花芽内3种多胺的含量也不相同,Put的含量高于Spd,而Spm的含量最低。Wang等[14]对早花甜樱桃和晚花山樱桃的研究结果表明,早花甜樱桃花芽内的多胺含量变化趋势不同于晚花山樱桃,而从整体来看,Spm的含量高于Put的含量,Spm的含量最低。孙晓焱[23]的研究发现,在川梨叶芽内Spd含量最高,其次是Spm,而Put的含量最低。本实验的研究结果显示,在休眠过程中,Spd的含量高于Put,而Spm仅有少量合成,大体上乔化砧木内多胺的含量都低于矮化砧木。这种差异可能是由于不同种类的多胺在休眠期间行使的功能不同造成的。
刘少华等[24]的研究表明,在杏花芽内,多胺含量的高低顺序为Spd>Put>Spm。Put能够促进萼片原基和雌蕊原基的分化进而促进开花,因此在露萼期花芽内的Put含量最高;Spm对萼片、雌蕊和开花的过程有一定影响,其在花芽内含量变化趋势相对较为复杂;Spd对花芽分化以及开花早晚影响较高,因此研究发现其在初花期含量最高。杨贵先等[25]对南瓜花发育过程中多胺的含量变化研究发现,在南瓜雌花中Spd的含量最高,Put的含量最低,而在南瓜雄花中Put的含量要高于Spd和Spm,推测在南瓜雄花发育的过程中Put可能发挥着主要作用,而在雌花中Spd在其发育过程中发挥着更为重要的作用。本研究中,多胺含量的高峰期出现于花芽露白期,因此推测多胺能够促进甜樱桃花芽的萌发,且Spd在花芽休眠和萌发阶段的总含量高于Put的总含量,推测在甜樱桃花芽休眠和萌发的过程中Spd起主要促进作用。
甜樱桃花芽多胺变化的相关研究虽然取得了一定的进展,但对花芽内不同种类多胺执行的具体功能和发挥作用的发育阶段还需进一步的实验验证。
3.2 多胺的代谢对果树芽休眠的影响
多胺作为“第二信使”能够影响多种果树的芽休眠进程,如桃和葡萄[10,26]。结合本研究结果可知,当2种砧木的甜樱桃花芽于2月28日时,其花芽内Put和Spd的含量均迅速上升。这不仅说明不同种类的多胺在不同休眠阶段发挥着不同的作用,还说明花芽内多胺含量的变化与其休眠进程密切相关。本研究中所检测的多胺属于游离态,也有研究指出休眠的解除与游离态多胺密切相关[20]。
3.3 PavPAOs和PavADC对果树多胺代谢的影响
PAO基因和ADC基因是多胺代谢途径中的关键基因。在植物体中,精氨酸在ADC等酶的作用下脱羧生成Put,进而生成Spd和Spm,使植物体内多胺的含量升高;而多胺能够在PAO等酶的作用下氧化分解生成醛、氨和过氧化氢从而使多胺的含量降低[27]。多胺作为生物体内的活性物质与多种生理过程有关,如植物的生长发育、抗逆性、开花和休眠等[28]。作为多胺代谢过程中的关键基因,这两种基因能够通过影响多胺代谢改变植物内多胺的水平进而影响植物的休眠和花期。Wang等[14]研究表明,当多胺的含量迅速升高时,甜樱桃的花芽会从休眠的状态过渡到活跃生长状态。张全军等[29]研究也说明,‘丰水’梨花芽的萌发和多胺的含量呈正相关且多胺的代谢是影响梨花芽萌发的重要因素。
本研究对甜樱桃花芽内2种基因的表达分析发现,在休眠阶段,PavPAOs的表达量存在小幅度的波动,当休眠结束时表达量降低,而PavADC的表达量在休眠阶段变化相对稳定,在休眠解除时存在大幅的升高。结合对花芽内多胺含量和嫁接于2种砧木上甜樱桃花芽开花进程的分析,推测PavPAO和PavADC基因通过调控花芽内多胺的含量来响应季节变化,进而促进花芽解除休眠和提前开花。
3.4 砧木类型对接穗的影响
关于砧木类型对接穗的影响已有前人进行了相关研究。砧木能够影响樱桃接穗的早果性和果实品质。早在1987年就有报道指出马哈利实生砧木嫁接的樱桃品种会比马扎德砧木提前1~2年结果[15],这一结果同样也在Hrotk等[30]的研究中得到证实。酸樱桃无性系砧木无论是作为砧木或是中间砧,其接穗品种的果实都会比马哈利砧木大[31]。此外,砧木也能够影响接穗内的多胺含量。Tao等[32]的研究发现,在受到高温胁迫时,苦瓜嫁接苗的叶片中多胺含量的积累高于自根苗。对番茄的研究也表明,在受到Ca(NO3)2胁迫时,番茄嫁接苗叶片和根系内多胺含量上升而自根苗叶片和根系中多胺含量下降,嫁接苗的多胺合成能力较强且分解较少,有较强的耐受性[33]。
本研究表明,休眠期间嫁接于不同砧木的‘罗亚理’花芽内多胺的含量不同,打破休眠和开花的时间也不同。推测砧木类型能够影响接穗内某种物质或某种生理特性的不同,进而影响多胺代谢过程对环境的响应,从而调控多胺水平的变化最终影响接穗的休眠及开花。然而砧木是通过何种途径调控多胺代谢的具体机制尚不清晰,在今后的研究中会对此问题进行更深入的探索研究。
综上所述,砧木类型能够通过影响多胺代谢进而影响休眠以及开花的过程。在多胺代谢过程中,关键基因PavPAOs和PavADC的表达能够影响花芽内多胺的水平,PavADC能够促进休眠期间多胺含量的升高从而促进休眠解除以及提早开花。
