过表达OsCatC基因水稻的获得及其耐盐性机理分析
2021-03-10刘聪美刘选明林建中
邓 勇,刘 聪,田 野,刘聪美,刘选明,林建中
(湖南大学 生物学院 植物功能基因组学和发育调控湖南省重点实验室,长沙 410082)
土壤盐碱化是一个日益严重的全球性问题,目前全世界约20%的耕地已受到盐碱化的影响[1]。土壤盐碱化阻碍了植物的生长和发育,降低了作物产量,成为世界农业的一个主要环境限制因素[2-4]。高浓度的盐胁迫引起植物的离子失衡和高渗透胁迫,同时使植物产生并积累过量活性氧(reactive oxygen species, ROS),导致氧化损伤[5]。正常条件下,植物体内的ROS分子在各种抗氧化防御机制下维持在相对平衡状态,并作为信号分子参与多种细胞生理过程[6]。植物受到生物胁迫和非生物胁迫因素的干扰时,ROS的产生和清除之间的平衡会遭到破坏,细胞内ROS水平会突然增加,从而对细胞结构造成重大损害[7]。如在盐胁迫下,ROS的增加可引起脂质过氧化、蛋白质氧化、核酸损伤、酶抑制、程序性细胞死亡(PCD)等,从而对植物细胞构成威胁并最终导致细胞死亡[8-9]。
ROS主要包括过氧化氢(H2O2)、超氧自由基

1 材料和方法
1.1 实验材料
参试粳稻品种 Kitaake (OryzasativaL. cv. Kitaake)由植物基因组学与发育调控湖南省重点实验室保存,用于水稻愈伤组织的遗传转化、克隆、RNA提取等实验。
1.2 引物合成
按照引物设计原则,利用软件Premier 5.0设计特异性引物。本研究所用引物序列信息见表1。
1.3 OsCatC基因过表达载体构建
用同源重组法进行载体构建。根据OsCatC的CDS序列和pCUbi1390-Flag载体序列设计引物OsCatC-Flag-F和OsCatC-Flag-R,以Kitaake的cDNA为模板,用高保真Prime STAR酶(R050A;TaKaRa)扩增该基因的CDS序列。PCR产物经琼脂糖凝胶电泳检测后回收纯化,然后pCUbi1390-Flag载体以PstⅠ进行酶切,酶切产物经电泳回收后进行连接。连接产物转化大肠杆菌感受态DH5α (本实验室保存),筛选阳性克隆后进行PCR检测及测序,鉴定最终表达载体pCUbi1390-OsCatC-Flag(图1,A)。在pCUbi1390-OsCatC-Flag载体中,目标基因OsCatC由玉米Ubiquitin启动子驱动表达,其3′端连接有2×Flag的编码序列。植物中的筛选标记基因为潮霉素抗性基因HPT,由35S启动子驱动表达。
1.4 水稻转化及分子检测
将重组质粒pCUbi1390-OsCatC-Flag经电击法转入农杆菌 EHA105 (本实验室保存),利用Toki 等[19]的农杆菌介导的愈伤组织转化方法获得转化植株。提取转化植株的总蛋白,参照Zhou等[20]免疫印迹法,采用抗Flag的单克隆抗体(No.314059;Abmart)进行Western blot分析。采用Trizol试剂(No.9109;TaKaRa)提取转基因植株的总RNA,并逆转录为cDNA,然后参照文献[21]采用实时荧光定量PCR (qRT-PCR)分析OsCatC的转录水平,具体引物序列见表1。
1.5 OsCatC过表达水稻的耐盐性分析
将生长20 d的OsCatC过表达和野生型水稻幼苗移至200 mmol·L-1的NaCl水培营养液中[18],盐胁迫处理7 d,然后再用正常水培营养液培养恢复10 d,拍照其盐胁迫表型并统计存活率。
1.6 OsCatC过表达水稻的盐胁迫响应生理指标检测
生长20 d的OsCatC过表达株系和野生型水稻幼苗用140 mmol·L-1的NaCl分别处理0、1、2、3和4 d,取幼苗地上部分用于后续检测。参照Cao等[22]的电导仪法测定水稻叶片相对电导率;采用丙二醛(MDA)含量检测试剂盒(BC0025;Solarbio)、H2O2含量检测试剂盒 (BC3590;Solarbio)和过氧化氢酶检测试剂盒(S0051;Beyotime)分别测定盐胁迫处理幼苗中的MDA和H2O2的含量,以及过氧化氢酶的活性。
1.7 OsCatC过表达水稻的氧化胁迫耐受性分析
参考You等[23]的方法,使用甲基紫精(MV) (Sigma公司)处理水稻发芽种子。具体方法为:将催芽3 d后的水稻种子转移到不含或含有4 μmol·L-1MV的1/2 MS 培养基中处理7 d,然后拍照其氧化胁迫表型并统计幼苗长度。
1.8 数据分析
所有数据用平均值±标准差表示。数据分析采用 SPSS 23.0统计分析软件,显著性水平为0.05。采用Sigma Plot计算机软件做图。
2 结果与分析
2.1 OsCatC过表达水稻植株的获得及鉴定
以水稻粳稻品种Kitaake的cDNA为模板,以特异性引物扩增得到OsCatC,其CDS序列为1 479bp,编码的CatC由492个氨基酸残基组成。然后将克隆所得的OsCatC用于构建过表达载体pCUbi1390-OsCatC-Flag(图1,A),并通过农杆菌介导的愈伤组织转化法转化Kitaake,共获得了30个独立转基因株系(T0)。随后,采用抗Flag的抗体对各株系的T1代幼苗进行了Western blot鉴定,并从中鉴定到2个OsCatC过表达株系(OE-10、OE-18),其中融合蛋白CatC-Flag积累非常显著,而未转化的野生型(WT)则没有检测到相应信号(图1,B)。随后,采用qRT-PCR 分析了OsCatC的转录水平,发现OE-10和OE-18株系的OsCatC转录水平显著高于野生型(图1,C)。这些结果说明,OsCatC已成功过表达于转基因株系中,并且能正常翻译为融合蛋白CatC-Flag。

表1 PCR引物序列
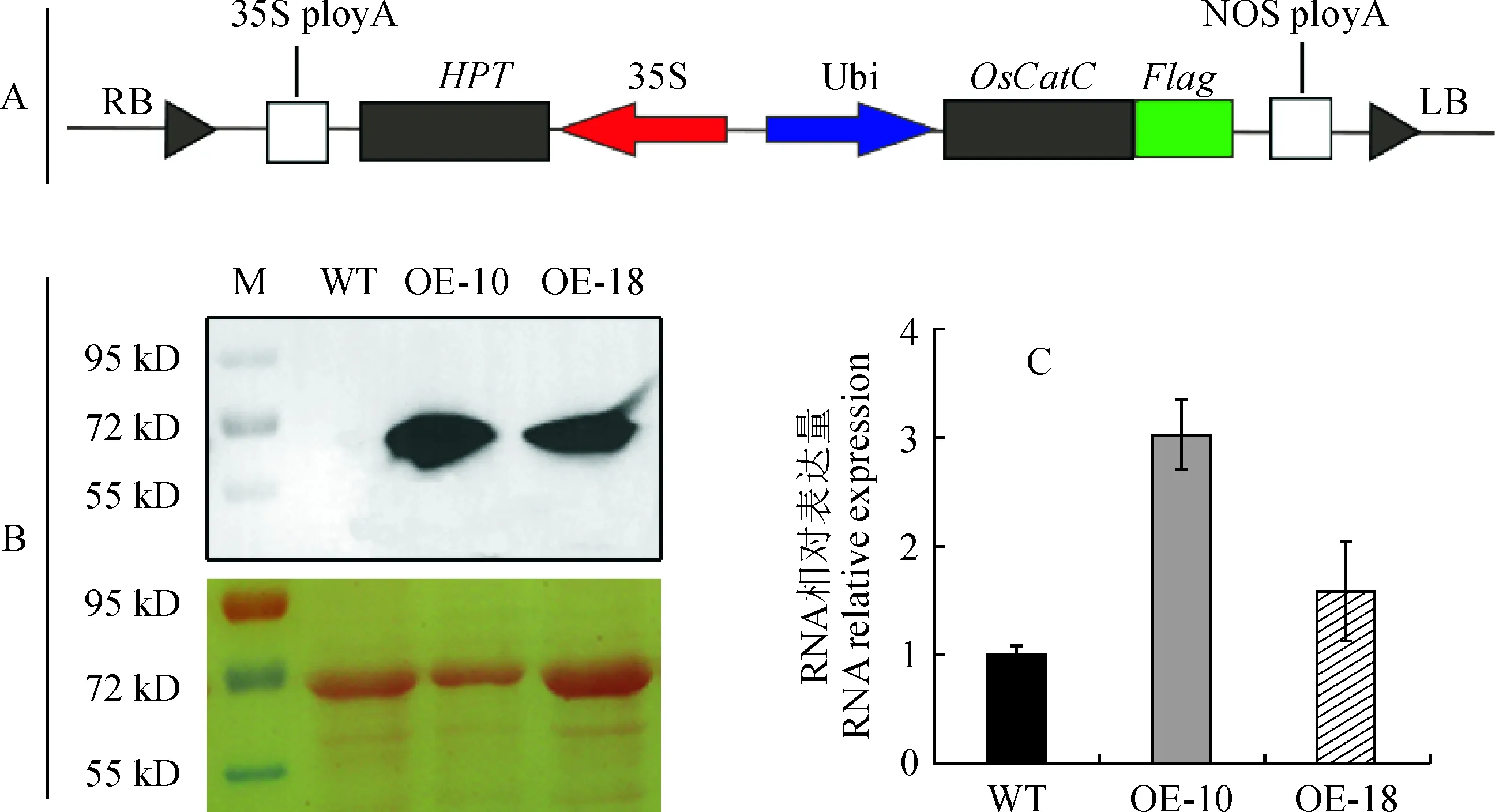
A.pCUbi1390-OsCatC-Flag过表达载体T-DNA区段图谱; B.Western blot检测野生型(WT)和OsCatC过表达株系(OE-10和OE-18)中CatC-FLAG蛋白的表达水平; C.qRT-PCR 检测在野生型和OsCatC过表达株系(OE-10和OE-18)中OsCatC基因的表达情况图1 水稻OsCatC过表达植株的鉴定A. Schematic diagram of T-DNA of the overexpression vector pCUbi1390-OsCatC-Flag. B. Western blot analysis of CatC-FLAG in wild-type (WT) and OsCatC overexpressing lines (OE-10 and OE-18); C. Expression analysis of OsCatC in wild-type (WT) and OsCatC overexpressing lines (OE-10 and OE-18) by qRT-PCRFig.1 Identification of OsCatC overexpressing plants

A.水稻野生型和OsCatC过表达株系(OE-10和OE-18)幼苗用200 mmol·L-1 NaCl 处理0和7 d及恢复10 d的表型;B. 盐胁迫恢复10 d后的幼苗(A)存活率。B中数值代表平均值±标准方差(n=3,t检验,* P < 0.05,** P < 0.01),下同图2 OsCatC过表达植株盐胁迫条件下的表型分析A. Phenotypic comparison of seedlings of wild-type and OsCatC overexpressing lines (OE-10 and OE-18) were treated with 200 mmol·L-1 NaCl for 0 d,7 d and then recovered for 10 d. B. Survival rates of seedlings grown salt stress conditions after 10 d of recovery(A). Data in B is presented as mean ± SD (n=3,Student’s t-test,* P < 0.05, ** P < 0.01), the same as belowFig.2 Phenotypic analysis of OsCatC overexpressing plants under salt stress conditions
2.2 OsCatC过表达水稻植株在盐胁迫下的表型比较
图2,A显示,在正常水培条件下,OsCatC过表达株系OE-10和OE-18与野生型的水稻幼苗长势无明显差异;盐胁迫(200 mmol·L-1NaCl)处理7 d后,OE-10和OE-18株系幼苗与野生型相比绿叶更多,生长状态更好;经过正常水培恢复10 d 后,部分OE-10和OE-18的幼苗仍能恢复正常生长,叶片呈绿色,而野生型幼苗只有极少数能恢复生长,绝大部分幼苗则干枯死亡。同时,各处理幼苗存活率统计发现,野生型幼苗在盐胁迫下的存活率仅为5%左右,而OsCatC过表达株系(OE-10和OE-18)幼苗的存活率仍能维持在20% ~ 25% (图2, B)。这些结果说明,过表达OsCatC能显著提高水稻对盐胁迫的耐受性。
2.3 OsCatC过表达水稻植株在盐胁迫下的生理指标比较
丙二醛(MDA)是细胞膜脂质过氧化的产物之一,其积累能加剧细胞膜的损伤,且受损伤程度与相对电导率正相关[24]。由于200 mmol/L NaCl的胁迫处理导致水稻幼苗死亡率太高,所以我们用140 mmol·L-1NaCl的水培溶液对OsCatC过表达株系和野生型的幼苗进行胁迫处理,然后取材测定其MDA含量、相对电导率、CAT活性和H2O2含量。结果表明,在正常条件下,OsCatC过表达植株OE-10、OE-18和野生型幼苗间的MDA含量和相对电导率无明显差异;盐胁迫处理后,所有水稻幼苗的MDA含量和相对电导率均升高,但是OE-10和OE-18幼苗的MDA含量和相对电导率均显著低于野生型(图 3,A、B)。同时,在正常条件下,OsCatC过表达植株OE-10和OE-18的CAT活性和H2O2含量与野生型没有明显差别;在盐胁迫条件下,OE-10和OE-18幼苗的CAT活性均高于同期的野生型幼苗,尤其OE-10幼苗的CAT活性显著高于野生型(图3,C),而OE-10和OE-18幼苗的H2O2含量均显著低于同期野生型(图3,D)。这些结果说明,过表达OsCatC显著提高了盐胁迫条件下水稻体内的CAT活性,并显著降低体内H2O2的积累量,从而能够降低盐胁迫导致的膜脂质过氧化作用,减轻水稻细胞膜受到的损伤,提高了水稻对盐胁迫的耐受性。
2.4 OsCatC过表达植株在氧化胁迫下的表型
为了验证过表达OsCatC能消除或减缓水稻氧化胁迫的猜想,我们使用甲基紫精(MV)模拟氧化胁迫来处理发芽3 d的水稻幼苗,然后分析OsCatC过表达植株和野生型幼苗对氧化胁迫的响应。结果发现,当用水培养7 d后,野生型和OsCatC过表达植株的幼苗均生长正常(图4,A),且各类苗长无明显差异(图4,B);而当用4 μmol·L-1MV处理7 d后,OE-10、OE-18和野生型幼苗的生长均受到显著抑制,但是OE-10和OE-18生长受抑制程度显著小于野生型(图4,A),且幼苗的长度均显著大于野生型(图4,B)。这些结果说明,过表达OsCatC显著提高了水稻的氧化胁迫耐受性,并进一步证实该耐受性的提高也有助于改良水稻的耐盐性。

图3 OsCatC过表达幼苗在140 mmol/L NaCl盐胁迫条件下的生理指标变化Fig.3 Physiological indices of OsCatC overexpressing seedlings under 140 mmol/L NaCl stress condition

A.催芽3 d的水稻种子用正常的1/2 MS培养液或用含有4 μmol·L-1 MV的1/2 MS培养液处理7 d;B.各类材料用MV处理7 d后幼苗的长度,其中的数值代表平均值±标准方差(n=20,t 检验,* P < 0.05,** P < 0.01)图4 OsCatC过表达水稻幼苗在甲基紫精(MV)处理下的表型A. Three-day-old seedlings were transplanted into 1/2 MS medium with or without 4 μmol·L-1 MV for 7 d; B. Seedling heights of wild-type and OsCatC overexpressing lines (OE-10 and OE-18) treated with mock or 4 μmol·L-1 MV for 7 d. Data in B are presented as mean ± SD (n=20, Student’s t-test, * P < 0.05, ** P < 0.01)Fig.4 Phenotypic analysis of OsCatC overexpressing seedlings treated with methylviologen (MV) at seedling stage
3 讨 论
在植物的生长和发育过程中,H2O2作为信号分子参与了许多发育过程和应激反应[25-28]。在不利的环境条件下,如极端温度、重金属、干旱、空气污染、营养缺乏或盐胁迫等,植物会增加H2O2的产生和积累[29],而高浓度的H2O2对植物细胞具有细胞毒害作用[30-31]。过氧化氢酶(CAT)是含有四聚血红素的酶,能将H2O2直接分解为H2O和O2,是胁迫条件下清除ROS的主要抗氧化酶之一[32]。降低H2O2的累积是植物提高逆境胁迫耐受性的重要策略之一,因此CATs的表达量与植物的耐逆性息息相关。H2O2预处理水稻幼苗可以增加CAT活性,保护水稻幼苗免受镉(Cd)胁迫伤害[33]。干旱胁迫下,小麦CAT活性的增加,其耐旱性也随之增强[34]。在蓝藻细菌中引入大肠杆菌的CAT基因katE,盐胁迫下会减少其H2O2的产生并提高耐盐性[35]。拟南芥CAT1被AtMEK1激活,可以降低H2O2浓度来消除或减缓盐胁迫导致的氧化损伤[36]。本研究结果表明,水稻幼苗受到盐胁迫后促使H2O2积累,而过表达OsCatC可提高其CAT活性,降低体内H2O2的含量,从而提高其盐和氧化胁迫的耐受性。同时,本研究结果也再次证明,提高植物的抗氧化能力有助于增强植物对逆境的耐受性。
植物中CAT家族成员间的酶活性和功能有所不同。拟南芥CAT家族有CAT1、CAT2和CAT3,其中CAT2是过氧化氢酶活性的主要来源[14],且在非生物胁迫响应中发挥重要作用。Mhamdi等[37]发现敲除CAT3仅轻微降低过氧化氢酶活性;CAT2的缺失使过氧化氢酶活性降低80%;而CAT1的缺失对过氧化氢酶活性没有影响。Du等[38]也发现CAT2对过氧化氢酶活性具有重要的组成性贡献,且在干旱和寒冷胁迫反应中也发挥重要作用。尽管Chen等[14]发现拟南芥CAT3主要为转亚硝基化酶活性,而其过氧化氢酶活性很低,但是Zou等[39]发现CAT3的Ser-261可被激酶CPK8磷酸化,激活其过氧化氢酶活性,提高了植株的耐旱性。在水稻CAT家族成员CatA、CatB和CatC中,CatC与拟南芥CAT2同源,也是水稻中过氧化氢酶活性的主要来源。Lin等[15]发现水稻CatC的功能缺失突变体noe1的体内过度积累H2O2和NO,呈现出明显的氧化胁迫损伤,并诱导叶片细胞死亡。Zhou等[18]发现CatC的Tyr-210被类受体胞质激酶STRK1磷酸化和激活,可以消除或减缓盐胁迫导致的氧化损伤,显著提高水稻的耐盐性。刘珊等[40]发现,当敲除水稻OsCatB时,其突变体对高温和氧化胁迫更敏感,但是对盐胁迫响应并无明显差异。至于水稻中CatA参与胁迫响应的具体机制仍不太清楚。这些前人的研究结果表明,水稻中CAT家族成员间的酶活性和参与的生理功能均有差异,其中CatC主要参与ROS的清除,在盐胁迫响应中起主要作用。在本研究中,过表达OsCatC能显著提高水稻耐盐性的结果直接证明,CatC是水稻CAT家族中参与盐胁迫响应的主要成员,OsCatC在水稻等作物的耐盐育种中具有很好的应用前景。
总之,本研究发现在水稻幼苗中过表达OsCatC能显著提高其盐胁迫条件下的CAT活性,同时显著降低H2O2的积累和氧化损伤,从而显著提高水稻的耐盐性。OsCatC是一个可用于水稻耐盐性遗传改良的优质基因。
