昆虫共生微生物及其功能研究进展
2021-03-09王渭霞朱廷恒赖凤香
王渭霞,朱廷恒,赖凤香,*
(1.中国水稻研究所,杭州 310006;2.浙江工业大学生物工程学院微生物研究所,杭州 310014)
人类基因组计划的完成确定了人类约有2.5万个基因。随着人类微生物组计划的实施,终于让我们认识到原来人类将440万的基因“外包”给了寄生在人体的微生物组。不难想象昆虫作为数量最多、分布最广的一类动物,也有大量共生的微生物,这些微生物可通过营养共生、调节宿主生理和发育、保护宿主免受病原体和有害物质的侵害或参与互作交流等途径,在昆虫的进化和物种多样性的形成中发挥不可替代的作用(Douglas,2015)。可以说是共生微生物的多样性驱动了宿主昆虫表型更加丰富和多样化,昆虫的表型变异是宿主基因组、共生微生物基因组、宿主基因型与共生微生物基因型互作的共同结果(Feldhaar,2011;McFall-Ngaietal.,2013)。昆虫与微生物的共生关系是自然界最典型的生物共生体系(holobiont)之一,二者形成共生体单位共进化(Thao and Baumann,2004)。
昆虫共生微生物主要包括胞内共生菌和胞外共生菌(杨义婷等,2014)。胞内共生菌通常分布在特殊的含菌细胞(bacteriocytes)内,采用垂直传播方式(从母代传给子代),与宿主的协同进化明显,是宿主生存不可或缺的;胞外共生菌指生活在昆虫细胞外的微生物,主要以附着于肠壁细胞和游离在肠腔的肠道菌群(gut microbiota)为主;依据共生微生物与宿主的关联程度又可分为互相依赖共存的原生内共生菌(primary endosymbiont)或专性内共生菌(obligate endosymbiont)和缺失不会影响宿主生存的次生内共生菌(secondary endosymbiont)或兼性内共生菌(facultative endosymbiont)。次生共生菌感染昆虫的时间相对较晚,可分布在细胞内(如含菌细菌、脂肪体细胞内)也可分布在细胞外(如肠道内壁、血淋巴中),既可垂直传播也可水平传播,与宿主协同进化的程度较低,不为宿主生存所必需(Douglas,2015)。
1 昆虫共生微生物的多样性及研究手段
1.1 昆虫共生微生物多样性
昆虫体内共生微生物的总量能够占到昆虫生物量的1%~10%,比如成年黑腹果蝇Drosophiamelanogaster和沙漠蝗Schistocercagregaria仅肠道内就约有105~106个细菌。但是,受限于昆虫体型较小和寿命较短等原因,对其共生微生物的研究还相对有限。果蝇中可检测到的微生物种类不超过30种(Chandleretal.,2011)。通过基因组测序的方法发现,植食性昆虫中蚀食枯木或腐朽木的昆虫体内微生物多样性最高,每个个体约130个操作分类单元(operational taxonomic unit,OTU)。OTU是假定的分类单元,将测定序列相似性大于98%的序列定义为一个OTU,用以反映样品中微生物的多样性。而大多数草食性昆虫的共生微生物约30~40 OTU/个体,其中以吸食花粉为生的蜜蜂的共生微生物则不超过6 OTU/个体(Colmanetal.,2012)。梵步甲Harpaluspensylvanicus和斑步甲Anisodactylussanctaecrucis的共生微生物分别有6个和3个OTU(Lundgrenetal.,2007),而在烟粉虱Bemisiatabaci中这一数据可高达3 513个(Harishetal.,2019)。我们在褐飞虱Nilapavatalugens中的研究发现其体内微生物至少有18个OTU(Wangetal.,2015)。
昆虫共生微生物除了细菌以外还包括真菌、酵母菌、原生生物、古菌和病毒等(White and Lichtwardt,2004;Gurungetal.,2019)。其中细菌主要分布在变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)以及衣原体门(Chlamydiae)(Colmanetal.,2012;杨义婷等,2014)。如在草地贪夜蛾Spodopterafrugiperda和褐飞虱中变形菌门和厚壁菌门是最主要的两类共生微生物,而拟杆菌门和放线菌门(Acfinobacteria)的比例较低(Zhangetal.,2019a;Gichuhietal.,2020)。真菌主要分布在子囊菌门(Ascomycota),另外有担子菌门(Basidiomycetes)和接合菌门(Zygomycetes)。由于宿主昆虫的体内环境的特殊性,共生真菌通常为单细胞酵母形态,故通常使用“类酵母共生菌(yeast-like symbiont,YLS)”来描述这些分类学上不属于酵母亚门的共生真菌。目前已在8个目大约143种昆虫物种的不同组织中发现YLS(Vega and Dowd,2005)。另外在中华角蝗Acridacinerea肠道内也分离到18株分属于子囊菌门和担子菌门6个科8个属的共生真菌(陈君芝等,2014)。通常来说,共生真菌都存在于消化肠道,少部分存在于细胞的间隙和细胞内部,如实蝇科幼虫肠的外突囊、天牛幼虫中肠内的含菌体以及含菌细胞。
昆虫体内的病毒并不总是扮演病原物的角色,它们与宿主也可以是共生或共栖关系。关于共生病毒的报道虽然不多,却包含了双链DNA(dsDNA)病毒、单链DNA(ssDNA)病毒、ss(+) RNA病毒和ss(-) RNA病毒等多种类型。以褐飞虱为例,除了可传播的水稻病毒以外,还发现了几种RNA病毒:呼肠孤病毒(Nilaparvatalugensreovirus,NLRV)、Himetobi P病毒(Hemetobi P virus,HiPV)、共生X病毒(Nilaparvatalugenscommensal X virus,NLCXV)(Nakashimaetal.,2006)和蜜露病毒(Nilaparvatalugenshoneydew virus,NLHV) NLHV-1,NLHV-2和NLHV-3(Murakamietal.,2013,2014)。目前对昆虫体内的共生病毒功能研究相对较少。
1.2 昆虫共生微生物研究手段
为解析共生微生物对宿主昆虫的功能,主要采用的方法有:(1)可培养共生微生物的功能直接检测和回补验证;(2)借用抗生素处理消除共生微生物后宿主表型的分析。包括用除菌后宿主昆虫或其唾腺分泌物、产卵液、蜜露等处理相应寄主植物,测定寄主防御反应等;(3)对共生微生物群落基因组测序,通过生物信息学分析共生微生物群组的多样性和功能。传统的分离、培养技术是了解昆虫共生微生物种类及多样性、生理功能、生态作用和对宿主影响的必要手段。但是,自然界中99%的微生物不能培养(Amannetal.,1995)。分子生物学技术如宏基因组测序可以避开微生物分离培养的过程,能够准确、快速、高通量地解读微生物群体的多样性与丰度,给昆虫共生微生物的研究带来了新的方法和思路,极大地提高了发现新共生微生物的能力和功能解析的力度,在测定昆虫微生物的群落结构、研究昆虫与菌群间的互作关系、发掘新的以及具有特定功能的微生物方面呈现巨大的优势,例如发现可产生抗生素或候选毒素等具有防御功能的微生物。为从微观角度研究共生菌与宿主昆虫营养功能互补、宿主种群形成扩散、协同进化等共生机制带来了新机遇(Shietal.,2010)。依赖于现代分子生物学技术的分析虽然可以通过基因组信息预测更多潜在共生菌的可能功能,但在活体中是否有活性并发挥作用则尚待进一步证明。
2 昆虫共生微生物的功能与机制研究
昆虫体内共生的微生物作为宿主生物学性状的重要调节因子可参与宿主营养代谢、促进生长发育、增强繁殖力、影响种群演替等诸多生物学过程。近年来发现共生微生物在宿主抵御病原体感染、寄生虫寄生和捕食等逆境胁迫以及调控寄主植物免疫反应中也具有重要作用。
2.1 提供宿主生长发育所需物质促进生长发育、拓展生态位
通常认为,共生微生物可通过扩大宿主消化能力,提供一些必需的营养物质(如氨基酸、脂肪酸、维生素或其他代谢物),帮助宿主在不均衡营养条件下生存,使得各种昆虫占据或支配原本不可能获得的生态位,这些功能在刺吸式害虫胞内原生共生菌与宿主协同进化中显得非常重要(Baumann,2005;Guenduez and Douglas,2009;Skidmore and Hansen,2017)。这些共生菌基因组大幅度缩减,核苷酸组成发生偏倚,高编码密度和缺乏可移动DNA,基因组保留了大量必需氨基酸合成的基因,而相应的参与非必需氨基酸合成途径的基因几乎全部缺失。胞外共生菌包括肠道微生物同样可通过给宿主提供必需氨基酸、维生素等营养物质来提高宿主的生存和繁殖能力(Ben-Yosefetal.,2010)。表1列出了可通过给宿主提供营养物质来提高适合度的共生微生物。除此之外,在黑腹果蝇Drosophilamelanogaste和拟果蝇D.simulans中发现Wolbachia能响应铁离子浓度的变化,在铁营养胁迫状态下,帮助宿主提高产卵力(Brownlieetal.,2009;Kremeretal.,2009)。植物乳杆菌Lactobacillusplantarum和醋酸杆菌Acetobacterorientalis则分别通过调节果蝇的TOR信号通路和胰岛素信号通路来促进宿主的生长发育(Storellietal.,2011;李玉娟,2017)。灰飞虱Laodelphaxstriatellus体内的Wolbachia则被证明可通过诱导营养细胞的细胞凋亡来提高雌虫的产卵量(Guoetal.,2018)。

表1 为宿主提供营养物质的昆虫共生微生物Table 1 Symbiotic microorganisms in insects that provide nutrients to the host
很多植物材料不仅难以消化、营养不均衡,而且还会包含有植食性昆虫必须耐受和需要解毒的毒性物质或次生代谢物。植食性昆虫尤其是咀嚼式口器的害虫其肠道菌可能在消化和解毒这些来源的食物上发挥了重要作用(Hammer and Bowers,2015)。如危害豆科作物的蝽象Megacoptapunctatissima其体内肠道细菌Ishikawaellacapsulata带有编码可以使植物次生代谢物草酸脱羧的酶(Nikohetal.,2011)。单食性橄榄果蝇Bactroceraoleae的幼虫具有以橄榄中果皮为食的独特能力,能够代谢未成熟青橄榄中高水平的酚类化合物和非水解蛋白质。基因组功能解析发现其共生微生物CandidatusErwinia dacicola的基因组中具有编码解毒和帮助宿主解除绿橄榄中根皮苷(phlorizin)毒性的消化酶基因,推测共生微生物在帮助宿主取食绿橄榄中具有重要作用(Pavlidietal.,2017)。
在许多植食性昆虫中,一个物种的不同种群可能会专食不同的植物,从而可能导致生物型或亚种的形成,次生共生菌在昆虫拓展取食不同植物资源方面具有一定的作用。蚜虫次生共生菌Regiellainsecticola可影响宿主的寄主范围并能在种间水平传播。在三叶草上不能繁殖的野豌豆蚜Megouracrassicauda如果感染了豌豆蚜Acyrthosiphonpisum的R.insecticola,则会提高其在三叶草上的存活力(Tsuchidaetal.,2011)。以苜蓿Medicagosativa为主食的黑豆蚜Aphiscraccivora如果感染了杀雄菌属Arsenophonusspp.亚种,就可以提高其在刺槐Robiniapseudoacacia上的存活力(Wagneretal.,2015)。斑点巨蝽Megacoptacribraria在豆类作物上卵孵化率极低,很少以大豆为食物。当将其肠道共生菌与其近缘的豆科作物害虫蝽象的进行交换后,其在豆科作物上的产卵量激增,而本以大豆为食的蝽象产卵量却出现大幅度下降(Hosokawaetal.,2007)。玉米根萤叶甲Diabroticavirgifera在不断地适应玉米与大豆田的轮作中会通过改变肠道微生物来适应在大豆上生存,能够取食大豆的种群体内共生菌克雷伯菌属Klebsiellasp.和寡养单胞菌Stenotrophomonassp.的占比由原来的4%上升至8%。抗生素的处理会显著降低玉米根萤叶甲在大豆上的存活率,推测由共生菌提供的半胱氨酸蛋白酶可能是玉米根萤叶甲适应大豆的原因之一(Chuetal.,2013)。烟粉虱因其寄主范围和入侵性的不同而分为不同的生物型,这些生物型不仅可通过线粒体DNA鉴定,同时也具有生物型特异的共生微生物,表明共生微生物也会影响宿主的地理分布、取食行为和致害能力(Gueguenetal.,2010)。综上所述,共生微生物不仅可通过合成必需氨基酸、维生素等营养物质来满足宿主营养需求,同时也可通过合成植物次生代谢物的代谢酶等拓展其取食范围和生态位。
2.2 共生微生物为宿主提供防御保护功能
生物在生长发育过程中都必将面对各种威胁,害虫也不例外。害虫除了自身的防御能力外,也与其共生微生物组队来保护其免受寄生、捕食、病原微生物感染或杀虫剂等威胁。共生微生物可通过产生保护性代谢物的方式直接保护宿主抵御各种生物和非生物的胁迫,同时也可通过调控植物防御反应间接地保护宿主。
2.2.1共生微生物产生保护性代谢物抵御寄生、捕食和病原菌感染等生物胁迫,直接保护宿主:共生微生物可通过产生有直接有害作用的代谢物,抵御病原菌、寄生蜂等的入侵,保护宿主免于被感染、寄生或捕食,这是互惠共生菌参与保护宿主最常用的方式。其中蚜虫体内的次生共生菌Hamiltonelladefensa和R.insecticola基因组中发现有合成类毒素和致病因子的基因,可通过产生毒素的方式抵御寄生蜂的幼虫(Degnanetal.,2009;Hansenetal.,2012)。柑橘木虱体内的共生菌CandidatusProfftella可以合成结构与隐翅虫毒素高度一致的毒素diaphorin,保护宿主免受捕食。合成该毒素的基因约占共生菌基因组的15%(Nakabachietal.,2013)。研究还发现H.defensa不同菌株对豌豆蚜的保护能力有不同,其中R.insecticola5.15可以降低寄生率提高宿主存活率,而菌株R.insecticolaLSR1并没有表现出保护能力(Hansenetal.,2012)。对寄生蜂的抵御功能H.defensa并不具有广谱性,抵御豆柄瘤蚜茧蜂Lysiphlebusfabarum和科列马阿布拉蚜茧蜂Aphidiuscolemani的寄生的功能更强(Cayetano and Vorburger,2015)。而在棉蚜Aphisgossypii中H.defensa和Arsenophonussp.的减少虽然导致宿主寿命和自然增长率的降低,畸形死亡率的增加,但并不影响寄生率(Ayoubietal.,2020)。由此可见,同一种类的共生菌在不同宿主体内的功能不完全一致。蝗虫体内肠道菌群的多样性和一种病原菌沙雷氏菌Serratiamarcescens的成功定殖呈负相关,肠道菌种类丰富度越高其抵抗病原菌入侵的功能越强(Dillonetal.,2005)。共生微生物在保护宿主抵御生物和非生物胁迫中的功能研究总结详见表2。
2.2.2提高宿主对杀虫剂和温度等非生物胁迫的抵抗能力:在药理学中,人体肠道微生物组的个体差异被认为是药物活性或毒性差异的重要来源(Nicholsonetal.,2005)。这种类似的相互作用同样在植食性昆虫存在。随着杀虫剂的广泛使用,很多害虫对不同的杀虫剂产生了抗性。这种杀虫剂抗性有源于害虫自身的代谢抗性和靶位点突变的靶标抗性,也有源于其体内共生微生物的贡献(段入心等,2019)。害虫肠道微生物在对杀虫剂的解毒过程中能够被诱导合成解毒酶,并通过矿化作用或共代谢过程,将杀虫剂分解代谢为一种或几种可被昆虫吸收利用的代谢物(Kikuchietal.,2012)。研究者通过对比抗药性种群和敏感种群体内微生物丰度,以及分离抗性种群中的微生物并对其基因组进行解析等手段来推测共生微生物在抗药性中的重要性(Kontsedalovetal.,2008;Chengetal.,2017;Lietal.,2018;Pangetal.,2018;Xiaetal.,2018;Leietal.,2020)。通过对比褐飞虱抗药性种群与敏感种群的肠道共生菌组成,发现敏感种群中变形菌门占99.86%,而抗性种群中厚壁菌门占46.06%,拟杆菌门占30.8%,变形菌门占比为15.49%,抗性种群的肠道菌群中富含解毒细菌,如肠球菌属Enterococcus和伯克氏菌属Burkholderia细菌,推测这些细菌与褐飞虱抗药性产生相关(Malathietal.,2018)。利用 “卵块离体培养法”培养出褐飞虱类酵母共生菌并对其进行抗吡虫啉解脂酶活性实验,发现褐飞虱体内解脂假丝酵母Yarrowialipolytica的共生与吡虫啉的抗药性有关,抗性菌株的羧酸酯酶、多功能氧化酶活性的增强可能是褐飞虱对吡虫啉产生抗药性的代谢基础(李娜等,2010,2011)。以多种杀虫剂为唯一碳源的菌株的生长分析发现,从田间筛选获得的草地贪夜蛾肠道中分离的微生物表现出对多种杀虫剂很强的代谢潜力(Gomesetal.,2020)。这些肠道菌与害虫抗药性产生的分子机制尚需进一步的研究。
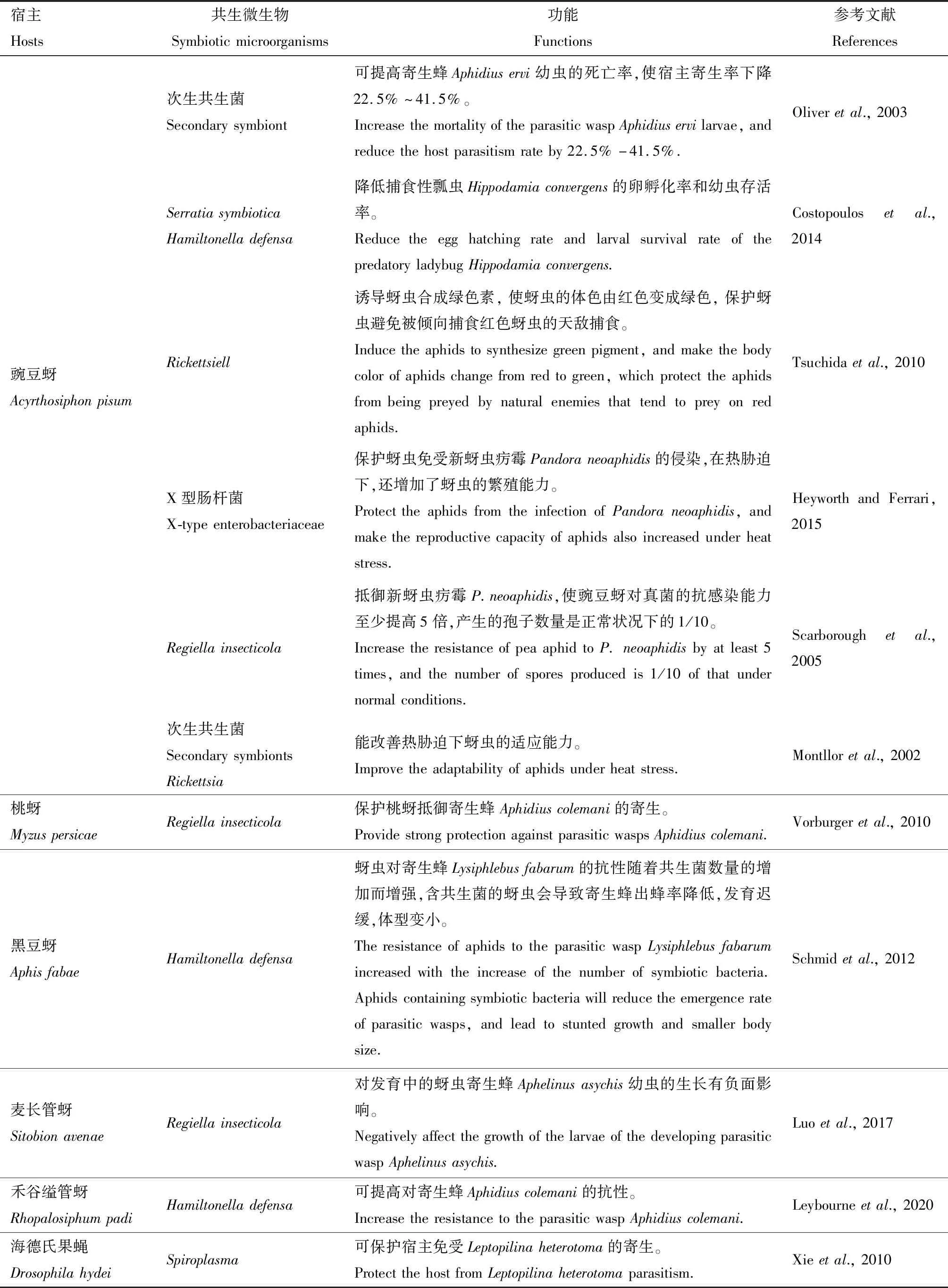
表2 昆虫共生微生物在保护宿主抵御生物和非生物胁迫中的功能Table 2 Functions of symbiotic microorganisms in insects in protecting host against biotic and abiotic stresses

续表2 Table 2 continued
昆虫共生微生物在提高宿主对逆境胁迫的适应性方面的研究主要集中在高温胁迫。在高温时期,蚜虫内原生共生菌Buchnera的感染率会下降,此时次生内共生菌包括Rickettsia能改善热胁迫下蚜虫的适应能力(Montlloretal.,2002)。在高温胁迫条件下,由于许多蛋白的构象容易出现错误并导致功能丧失,热休克蛋白对蛋白质的正确折叠以及错误折叠蛋白质回收具有重要意义。而高温胁迫下共生细菌中约占10%的分子伴侣热休克蛋白Gro EL表现为持续表达。热休克蛋白的高表达使得宿主昆虫中的蛋白错误折叠的发生概率显著降低,从而降低了在胁迫情况下基因有害突变的发生所带来的负面影向,增强了蚜虫对高温的耐受力(Faresetal.,2004,2005)。烟粉虱在受到高温胁迫时,在包含Rickettsia的群体中,细胞骨架基因等与应激反应相关的基因被诱导,从而显著提高了宿主对40℃高温的耐受性(Bruminetal.,2011)。共生微生物在宿主抵御低温胁迫方面报道较少,最近在桔小实蝇中发现肠道微生物米氏克雷伯菌K.michiganensisBD17可通过调控宿主脯氨酸和精氨酸的代谢途径来提高宿主在低温胁迫下的存活力(Razaetal.,2020)。
2.2.3通过调控植物防御反应间接地保护宿主:植物为了防御昆虫的取食和产卵进化出了多种防御机制,包括植物激素信号茉莉酸(jasmonic acid,JA)和水杨酸(salicylic acid,SA)通路在应对害虫取食时的感知、响应和调节免疫防御反应的能力(Erbetal.,2012)。昆虫在取食植物的过程中面临着如何突破植物多种防御体系,以达到顺利取食的目的。在此过程中,昆虫体内共生微生物就像幕后操作者一样扮演着举足轻重的作用,不仅可帮助宿主消化木质素、纤维素等难以消化吸收的植物材料,也可通过唾液腺、蜜露等分泌物间接地调控寄主植物免疫防御反应,从而达到顺利取食的目的(Schwartzberg and Tumlinson,2014;Zhuetal.,2014;Douglas,2015)。例如N-酰基氨基酸是昆虫口腔分泌物(返流剂)的主要和广泛的成分,在昆虫消化过程中作为生物表面活性剂发挥作用。在取食过程中可作为激发子诱导植物防御。Spiteller等(2000)从甜菜夜蛾S.exigua、芸苔天牛Mamestrabrassicae和黄地老虎Agrotissegetum的肠道中分离到可合成N-酰基氨基酸的共生菌。潜叶昆虫可以在黄色衰老的叶子上由细胞分裂素诱导形成绿岛,使昆虫能够在环境恶化的条件下创造一个营养增强的微环境并生活(Gironetal.,2007)。在斑幕潜叶蛾Phyllonorycterblancardella中发现Wolbachia可调控细胞分裂素的水平,以保证宿主的生长发育、提高宿主适应性。消除共生菌则会导致叶片无绿岛形成,昆虫死亡率上升(Kaiseretal.,2010;Bodyetal.,2013)。至于细胞分裂素的来源,推测是共生细菌直接合成或诱导昆虫或植物合成。另外也有大量证明宿主共生微生物在调控植物防御反应的报道(表3)。可以看出同一宿主的共生细菌在不同的寄主植物中会触发不同的防御反应,同一宿主的不同共生菌会诱导寄主不同的免疫反应。
2.3 共生微生物对宿主行为和生殖的调控
共生菌在昆虫体内甚至可以合成气味分子或影响宿主产生的气味分子,这些气味分子会被宿主用来合成信息素或种间激素从而影响昆虫的交流和行为。蝗虫群体可能被一组聚集信息素触发和维持,引起原本单独行动的蝗虫聚集形成一个迁徙群。沙漠蝗肠道共生菌成团泛菌Pantoeaagglomerans能够利用沙漠蝗消化废弃产物中的木质素衍生物合成聚集信息素的前体愈创木酚,促进蝗虫集群行动(Dillonetal.,2000)。与之相反,蝗虫微孢子虫可以抑制产生聚集信息素的后肠细菌的生长,从而阻止飞蝗的群集行为(Shietal.,2014)。协调的运动行为对动物的生存和繁殖至关重要,用抗生素处理去除果蝇体内的短乳杆菌Lactobacillusbrevis后会导致果蝇过度活跃的运动行为。给无菌果蝇单一植入该菌后则运动能力恢复正常。原因是短乳杆菌通过表达木糖异构酶来调节果蝇的糖代谢降低海藻糖水平,从而降低神经递质章鱼胺的活性,进而降低果蝇运动能力(Schretteretal.,2018)。在调节昆虫交配选择中果蝇体内的植物乳杆菌可能是诱导交配偏好的关键共生菌。用糖蜜和淀粉分别饲养果蝇,结果果蝇优先与相同饮食饲养的同类交配。淀粉的饲养会增加植物乳杆菌属细菌的丰度,给无菌果蝇单一植入该菌后交配偏好恢复。植物乳杆菌具体如何影响与交配行为有关的表皮碳氢化合物类激素发生改变的机制目前还不清楚(Sharonetal.,2010)。在桔小实蝇Bactroceradorsalis和瓜实蝇Bactroceracucurbitae中发现带有共生菌的雌蝇表现出比那些经抗生素处理消除细菌的雌蝇对雄性具有更高的吸引能力,其中产酸克雷伯氏菌Klebsiellaoxytoca和弗氏柠檬酸杆菌Citrobacterfreundii能够合成大量3-甲基-1-丁醇、2-苯乙醇和异氰酸丁酯等,这些物质具有吸引雌虫的作用(Damodarametal.,2016;Hadapadetal.,2016)。在蚜虫中,感染H.defensa的蚜虫比未感染的表现出较低的攻击性和逃逸反应(Dionetal.,2011)。当蚜虫被一种昆虫病原真菌感染时,会在真菌产生孢子之前从寄主植物上落下,研究发现携带Spiroplasma的蚜虫比未携带的蚜虫从寄主植物上落下的数量更多,从而降低病原菌对附近蚜虫的感染风险(ukasiketal.,2013b)。共生微生物对宿主生殖行为的调控研究较多,它们往往能够经卵实现垂直传递,可通过诱导细胞质不相容、孤雌生殖或雄性死亡等机制来提高其在雌虫中的感染比例,如Wolbachia,Cardinium,Arsenophonus,Spiroplasma和Rickettia等(Werrenetal.,2008;Engelstadter and Hurst,2009)。白背飞虱中Wolbachia与Cardinium相互作用诱导胞质不相容(Zhangetal.,2012),但在褐飞虱中Wolbachia并没有诱导胞质不相容的作用(Zhangetal.,2010)。而在果蝇中Wolbachia可能通过调节宿主嗅觉相关基因的表达,从而显著提高果蝇的嗅觉反应能力(彭宇和王玉凤,2009)。同样具有生殖调控功能的Rickettsia,不仅可以使感染的烟粉虱产生雌性的比例更高,同时会使宿主产生更多的后代,成年后存活率更高,发育更快(Himleretal.,2011)。
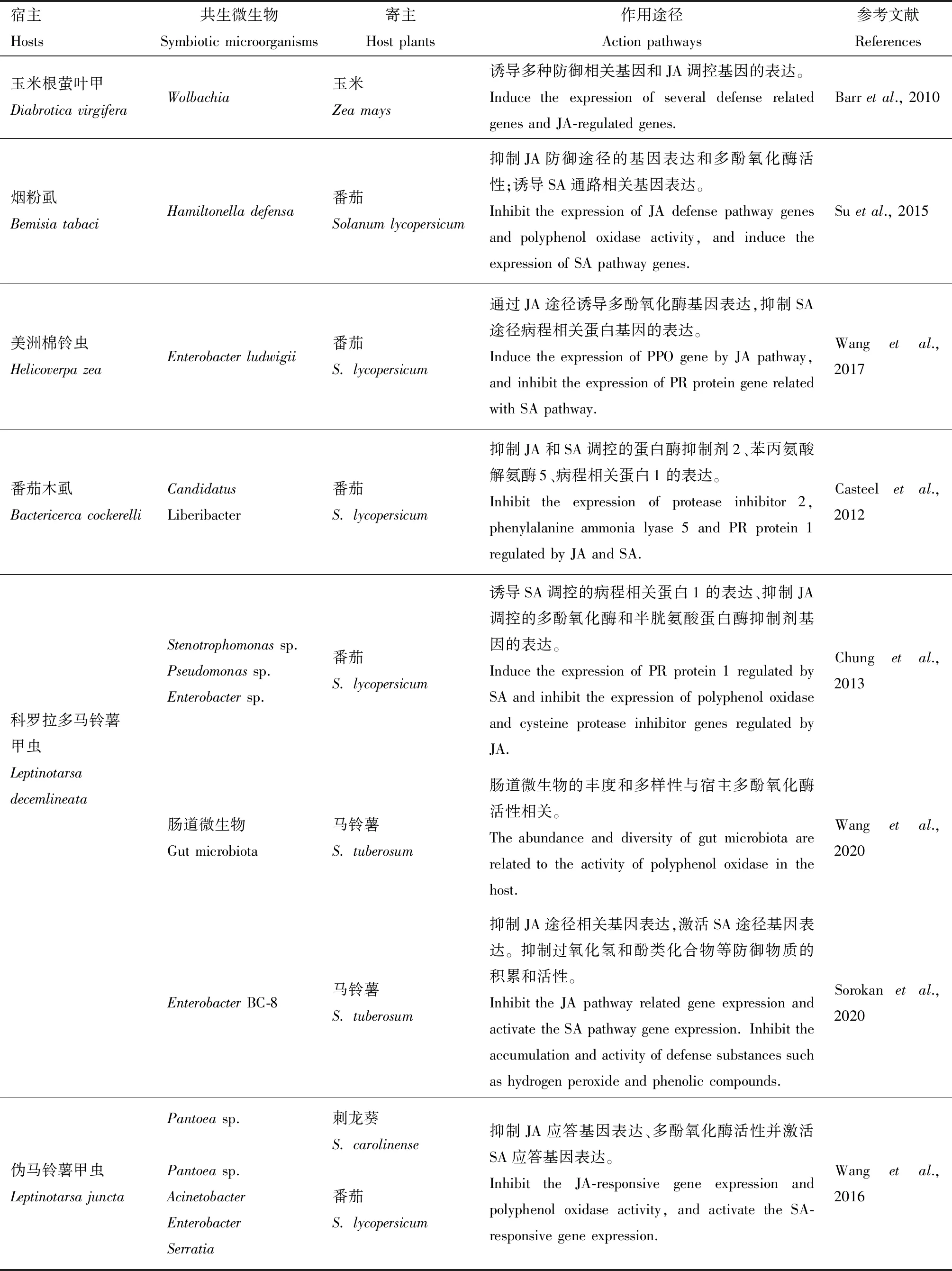
表3 昆虫共生微生物通过调控植物防御反应间接保护宿主Table 3 Indirect protection of host by symbiotic microorganisms in insects through regulating plant defense response

续表3 Table 3 continued
关于共生病毒对农业害虫生长发育的影响,研究比较少。Ryabov等(2009)在车前圆尾蚜Dysaphisplantaginea中的研究发现,当虫口密度大,食物短缺时,其体内共生有浓核病毒Dysaphisplantagineadensovirus (DplDNV)的蚜虫虽然繁殖率下降,但可产生部分有翅蚜,保证了蚜群体的生存和扩散;而没有共生病毒的蚜虫群体则不能形成有翅蚜,难以迁飞。Xu等(2014)发现,携带有棉铃虫浓核病毒(Helicoverpaarmigeradensovirus-1,HaDNV-1)的棉铃虫个体发育更快,繁殖力强,同时还表现出对Bt毒素的抗性。
2.4 共生微生物对宿主的负面作用
并不是所有的共生微生物都对宿主生存产生积极的保护效应,大部分的昆虫共生病毒表现为致病、致死等不利于宿主的表现行为。有些共生菌如果蝇体中的Spiroplasmapoulsonii反而会提高果蝇对某些病原细菌的敏感性(Herren and Lemaitre,2011)。在非洲粘虫Spodopteraexempta中发现,Wolbachia能提高宿主对核型多角体病毒的敏感性(Grahametal.,2012)。共生微生物对宿主的作用受制于环境条件,共生微生物的存在对富含蛋白质饮食的斑翅果蝇Drosophilasuzukii有害,而对缺乏蛋白质饮食的果蝇有利(Bingetal.,2018)。感染H.defensa的黑豆蚜Aphisfabae对寄生蜂有很强的保护作用,但如果没有这些天敌时,H.defensa的感染会导致宿主寿命缩短,繁殖率下降(Vorburgeretal.,2013)。在烟粉虱、柑橘木虱、小菜蛾和豌豆蚜等害虫中都发现被共生菌如Rickettsia,Arsenophonus,Wolbachia和Serratia的感染反而会增加宿主对杀虫剂的敏感性(Kontsedalovetal.,2008;Ghanim and Kontsedalov,2009;Tiwarietal.,2011;Skaljacetal.,2018;Xiaetal.,2018)。给褐飞虱人工转染源于白背飞虱的Cardinium会降低其繁殖力和孵化率(Lietal.,2020)。
3 共生体的动态平衡
昆虫体内的不同共生微生物并不是孤立存在和发生作用的,而是相互间不同程度地存在协作依存、取代或抑制现象(黄旭等,2015)。不同成员之间的相互作用可以是通过对资源和空间的竞争直接发生,也可以是通过诱导宿主免疫反应间接发生。原生共生菌与次生共生菌之间在生物合成和代谢上往往表现出很强的互补性,共同为宿主提供必需的营养物质。在共存的细菌中,许多共有的基因还会逐渐丢失,导致基因组出现精简或退化,最终使不同细菌的生物合成途径处于极少重叠的状态,从而形成协作或依存关系(Baumann,2005)。微生物组成和数量的微小变化对宿主表型都有重要影响,而宿主所处的环境变化也会影响到共生微生物之间和共生微生物与宿主之间的互作的关系。一些病原生物在特定条件下也可能与宿主和平共处,甚至带来某些好处。宿主体内共生微生物的动态变化主要受以下因素影响。
3.1 宿主与生存环境对共生微生物维持收益的权衡和调控
昆虫的地理分布、取食寄主、天敌等环境条件对其体内共生菌的种类、分布、功能等具有一定的调节作用。许多内共生菌在特定的生态条件下对宿主带来有益的影响,但也会产生相关的成本。为了最大限度地提高自身的适应度,宿主必须维持共生体的持久性,同时又要防止共生体对资源的浪费,这就需要根据特定的条件对共生菌种群进行严格的调控。宿主生理及其肠道内环境,如pH值、氧水平和氧化还原条件也可能是导致微生物群落的变化的主要驱动力(Chenetal.,2020)。如黑豆蚜和豌豆蚜,随着成虫的老化,Buchnera和Arsenophonus的丰度降低,而H.defensa的密度随之增加(Simonetetal.,2016)。推测宿主通过权衡肠道共生物的增益是否能弥补其对宿主所带来的负担,或宿主生理环境的变化等引起共生微生物实时调整丰度以便最大限度地满足宿主需求。蚜虫体内的共生菌H.defensa,S.symbiotica,R.insecticola,Rickettsiaspp.,Spiroplasmaspp.和X型肠杆菌(X-type Enterobacteriaceae)等的存在对蚜虫的生存和繁殖都有一定的负面影响,其在宿主体内的维持取决于胁迫条件的存在与否(Oliveretal.,2008;Simonetal.,2011;Heyworth and Ferrari,2015)。当黑豆蚜不受寄生蜂威胁时,维持具有较强防御作用的H.defensa菌株比较弱的菌株成本要低(Cayetanoetal.,2015)。H.defensa可通过增强对寄生蜂的抵抗力和减少成本更高的防御行为来提高蚜虫适应能力。但由于共生菌的存在降低了蚜虫的自主防御行为,结果会导致被捕食性天敌二星瓢虫Adaliabipunctata攻击风险的增加(Polinetal.,2014)。共生细菌既有可能通过产生芳香族代谢物等物质刺激共生真菌生长和繁殖,又有可能起相反的作用,即抑制共生真菌的生长,两者互作的结果受到具体的细菌和真菌种类、宿主生物学特性、环境条件和植物中某些化学成分(如蒎烯)等因素的影响(Adamsetal.,2009)。
对于同一种害虫,也因发育时期以及互作的作物、外界环境的不同,其共生微生物种类和功能也不同(Sorokanetal.,2017;Ojha and Zhang,2019;Tianetal.,2019)。如在豌豆蚜中具有抵御寄生功能的H.defensa,在麦蚜Sitobionavenae、马铃薯长管蚜Macrosiphumeuphorbiae和棉蚜中并没有表现出抗寄生功能(ukasiketal.,2013a;Clarkeetal.,2017;Ayoubietal.,2020)。这种不同有可能是由于同一菌种的不同菌株造成,也有可能是寄生蜂的种类不同引起。被公认为具有生殖调控功能的Wolbichia,因不同宿主、株系以及分布位置,可以不同的方式保护宿主免受寄生、捕食以及其他病原微生物或病毒的侵害(Barretal.,2010;Lietal.,2018;Juetal.,2020;Leietal.,2020)。在实蝇中就曾发现Wolbachia存在5个不同株系(Jamnongluketal.,2002)。最近Odden等(2020)通过广泛调查和有针对性地收集已知感染Wolbachia的物种,也发现存在新的Wolbachia株系。其他共生菌是否同样存在菌株的差异,同一种共生菌表现出不一的功能是否是由于菌株的不同引起,则有待进一步研究。
3.2 宿主体内共生微生物之间的协同互补
昆虫体内的共生菌及其功能并非一成不变,从新共生菌入侵到稳定,共生菌之间的互作关系以及对宿主的影响是不断变化的。蚜虫的自然种群中几乎每个个体都携带有Buchnera,次生共生菌的感染率也可高达80%,证明在长期的进化中宿主体内的共生微生物之间已经达成了某种平衡(Montlloretal.,2002)。当给仅感染有原生共生菌的豌豆蚜注射次生共生菌后,与原生共生菌之间的竞争起初会导致蚜虫体重下降,子代数减少。但通过反复不断地注射或者多代之后,这种负面的影响会逐渐消失。此时如果消除原生共生菌,次生共生菌甚至会占据原生共生菌的含菌体,替代原生共生菌帮助蚜虫获得必要的营养,提高其存活率和繁殖力(Kogaetal.,2003)。在玻璃翅叶蝉中共生菌Baumanniacicadellinicola与Sulciamuelleri之间也存在明显的代谢互补,其中前者提供维生素和辅因子,而后者提供必需氨基酸(Wuetal.,2006)。豌豆蚜体内的次生共生菌H.defensa可以提高蚜虫对内寄生蜂的抗性,这种抗性基因(编码毒蛋白同源产物)经研究发现位于共生菌所携带的溶原性噬菌体上,而缺乏噬菌体的H.defensa只能起到微弱的保护作用,表明蚜虫-细菌-噬菌体三者之间复杂的互作关系保障了蚜虫免受寄生危害(Degnan and Moran,2008;Oliveretal.,2009)。植食性昆虫都能作为植物病毒的媒介,植物病毒与介体昆虫之间的关系非常复杂,可通过直接或间接的作用促进介体昆虫的生长、存活和生殖能力(何晓婵等,2014)。在介体昆虫细胞内,共生菌和病毒友好相处、共享地盘,甚至可充当病毒传播的帮凶,参与植物病毒的传播(Bouvaineetal.,2011)。
除了在功能上表现互补外,有些共生微生物在位置上也表现出和平共处。不同共生微生物种类共同存在于宿主的同一组织或细胞(如含菌细胞)中,有的甚至“寄生”在另外一种细菌中,一起垂直传播。如在烟粉虱、温室粉虱和豌豆蚜中,次生细菌Hamiltonella分别和Wolbachia,Arsenophonussp.和Rickettsiella一起存在于含菌细胞中(Skaljacetal.,2010;Tsuchidaetal.,2014)。柑橘粉蚧Planococcuscitri中,γ变形菌Moranellaendobia位于一种β变形菌Tremblayaprinceps之内(von Dohlenetal.,2001)。在大青叶蝉Cicadellaviridis中,Sodalis-like菌位于另外一种共生细菌Sulciamuelleri之内(Michaliketal.,2014)。
4 利用共生微生物防控害虫
近年来,利用共生菌控制害虫的策略受到广泛关注。很多基于共生菌的害虫控制理论被提出,其中部分已成功付诸实践(王四宝和曲爽,2017)。例如,在田间条件下将果蝇共生的产酸克雷伯菌作为诱饵与杀虫剂联合应用可显着减少果蝇的侵染(Soodetal.,2010)。在褐飞虱防控实践中将抗生素与杀虫剂配伍喷施,能显著减少褐飞虱体内共生菌的数量,从而极大地提高了杀虫剂控制褐飞虱效果(Shentuetal.,2016)。
通过大量饲养和释放雄性不育昆虫降低害虫种群的数量的昆虫不育技术也是近年来使用最为有效和对环境友好的害虫综合防治技术之一。其中通过辐射导致的不育雄虫的低成本、高效率的大规模饲养技术就有可能依赖于对其共生微生物的认识。通过在饲料里添加昆虫肠道益生菌,如克雷伯氏菌K.pneumonia、肠杆菌Enterobacterspp.和弗氏柠檬酸杆菌C.freundii可以改善地中海实蝇的生活力、发育速度甚至交配竞争力等(Ben Amietal.,2010;Gavrieletal.,2011;Hamdenetal.,2013;Sacchettietal.,2014)。其中肠杆菌Enterobactersp.AA26已被证明是一种有效的啤酒酵母的替代品,在幼虫饲料中加入灭活的细菌细胞,不仅满足了实蝇幼虫日粮所需的营养需求,还保持甚至提高了不育蝇的重要生物学“品质”性状(Augustinosetal.,2015;Kyritsisetal.,2019)。在饲料中添加产酸克雷伯氏菌和弗氏柠檬酸杆菌同样也可以提高桔小实蝇和斑翅果蝇体内蛋白质水平,增加糖类和氨基酸代谢水平,促进其发育(Caietal.,2018;高欢欢等,2020)。
5 小结与展望
将昆虫及其体内共生微生物作为进化选择的一个整体对待的共生体概念的提出,使得对昆虫行为、生长发育、环境适应能力等方面的认识不再局限于仅以昆虫作为研究对象,而是将共生微生物之间以及共生微生物与宿主之间多层次、多维度互作的微生态系统给以充分的考虑,这样的研究可以系统、全面、科学地揭示昆虫行为(Feldhaar,2011;Wernegreen,2012)。共生微生物与宿主的共存是共生体成功进化的重要因素,宿主的表型是由宿主与其体内共生微生物共同决定的(Rosenbergetal.,2010)。在共生关系建立、维持和多样化的过程中共生伙伴双方都经历了遗传、生化和生理的变化,这种变化无疑对它们的生命周期和生物学有着深远的影响(Gupta and Nair,2020)。由于微生物群落与宿主相比传代时间短、基因更加灵活多变,能够对剧烈的环境变化作出迅速的反应,从而保障了共生体的生存。在不断变化的环境条件下,共生微生物群落无疑是宿主获得新性状的最重要的进化储备。共生体可塑性越高,进化的空间越大,适应性也越强,不容易灭绝。因此,在今后研究害虫时,应拓展对共生微生物的功能及其机制的研究,加深对宿主害虫的生态适应性、致害性以及抗药性变异等方面科学认识。此外,在当今害虫的可持续治理要求下,生态平衡和生物多样性的维持需要考虑到微生物的因素。比如在转基因作物环境安全评价体系中,通常将非靶标昆虫的死亡率、体重、发育历期、产卵量等表观性状作为评价指标。但这些表观性状在灵敏度方面存在欠缺,不能很好地反映外源蛋白潜在的生物学影响。Zhang等(2019b)首次将龟纹瓢虫Propyleajaponica的共生菌引入转基因环境安全评价体系中,筛选出用于环境安全评价的共生菌指示种,建立了相应的技术体系,开辟了环境安全评价新方法。
5.1 共生体形成和维持的分子机制
尽管共生微生物在塑造宿主生物方面起着至关重要的作用,但对共生组合的形成、维持和共进化的理解是有限的,而且很大程度上是由于对共生微生物的了解以及种群水平上细菌共生体与生态特性相关性研究相对较少(Stubbendiecketal.,2019)。比如,次生共生菌在保护宿主抵御寄生等方面具有积极的作用,但携带次生共生菌情况下宿主的适应度反而会降低(Russell and Moran,2006)。宿主与共生体之间通过直接的相互作用和交换复杂的化学信号来建立和维持它们的共生关系。那么这些复杂的化学信号是什么以及微生物与宿主组成的共生体在不同环境条件下的可塑性是如何建立和维持的?蚜虫体内防御性共生菌H.defensa既可以通过对寄生蜂的抗寄生保护宿主,又可能因为更高的捕食敏感性受到捕食威胁。这种次生共生菌在宿主种群中能够得以维持可能取决于:(1)提供给宿主的利益和共生的相关成本之间的平衡;(2)蚜虫种群内共生菌的传播速率;(3)生态环境,比如捕食和寄生压力之间的相互作用(Polinetal.,2014)。这些解释需要更进一步通过对更多的害虫微生物共生体进行研究,从理论上明确共生关系建立和维持的分子机制。
5.2 大尺度上多角关系揭示不够深刻,研究方法“零敲碎打”、不够系统
昆虫与其体内的共生菌显然是一个密不可分的生物群落,它们之间相互作用,共同应对各种环境的影响。在多角关系的研究中目前主要集中在共生微生物与宿主之间,尚缺乏深入的宿主内部微生物之间的互作和动态平衡、宿主微生物与寄主植物之间、宿主微生物与入侵微生物、甚至宿主微生物与寄主植物微生物之间的互作研究(Sorokanetal.,2017)。最近已有研究者通过比较烟粉虱及其寄生蜂之间共生菌多样性时发现,害虫与其天敌如寄生蜂之间就存在共生菌互相的传播和影响(Karutetal.,2020)。在害虫取食植物的过程中,共生菌积极参与了致害过程,同时也需要注意的是植物本身和害虫的天敌也有与其新陈代谢密切相关的微生物群,它们也参与到与害虫的防御斗争中。双边相互作用的研究掩盖了复杂生态环境中生物间不断相互作用的集体作用,这种作用不仅影响宿主的反应,而且也影响着微生物相互之间的反应。
共生细菌与病原物之间的关系同样受到多种因子的影响,如昆虫的种类和遗传背景(基因型)、昆虫生育期、共生细菌的种类及其与宿主的进化关系、体内其他共生细菌的存在状况和环境温度等,但是这些因子具体是如何起作用的,都有待进一步研究。由此不难想象,害虫与共生微生物之间的复杂性和多样性,生长在不同生态区域的不同害虫其共生微生物种类不同,其功能也不尽相同。对于同一害虫种类也因发育时期以及面对的不同作物、不同外界环境其共生物种类功能同样也会不同。
因此,要建立共生体的生态观,从生态学的角度出发,研究共生关系的形成、维持和进化。需要开展不同微生物之间、微生物与宿主之间以及与环境非生物因子多维度的互作研究。需要明确共生微生物是如何突破宿主的免疫防线,与其建立密切的共生关系。微观上需要了解宿主与共生微生物之间相互作用的受体和信号分子,大尺度上需要明确在特定生态条件下的共生体的动态平衡。但是,目前的对害虫共生菌以及共生体的研究中,研究方法“零敲碎打”,对特定研究对象体系缺乏长期性、系统性。今后,通过建立不同害虫种类的共生体研究模型和体系,改进微生物分离培养方法并结合宏基因组测序,综合分析宿主害虫生物学性状、致害性等关键性功能发挥中共生微生物核心种群的形成以及演变规律,有望加深对植物害虫共生体的认识。
5.3 定向调控共生体,开发新型防治策略
共生体具有可塑性,共生微生物种群处于动态变化中,很多时候我们很难简单地把共生菌判断为兼性共生菌还是专性共生菌,因为它们之间存在着转化关系,在长期的进化过程和环境适应过程中兼性共生微生物可以转化为专性共生菌,病原微生物可以转化为共生微生物等。通过探究共生体网络的建立和维持的内在规律以及外在生态条件等关键因子,找到定向调控共生微生物群落的措施,有助于开发新型的植物害虫可持续绿色防控策略。
