抑咽侧体素基因在大猿叶虫生殖滞育准备中的功能分析
2021-03-09王小平
田 忠,刘 茜,朱 莉,刘 文,朱 芬,王小平
(华中农业大学植物科学技术学院,昆虫资源利用与害虫可持续治理湖北省重点实验室,武汉 430070)
滞育是昆虫借以度过不良环境、维持种群延续的一种生存对策,主要由遗传因子和环境因子共同调控(Danks,1987)。依据昆虫进入滞育的生活史阶段可分为胚胎滞育、幼虫滞育、蛹滞育和成虫滞育,成虫滞育又称作生殖滞育(Danks,1987)。当具生殖滞育特性的昆虫接受到光周期、温度等外部环境信号的刺激后,会通过内分泌系统调节昆虫激素滴度的变化以促进滞育的发生(Denlingeretal.,2012)。保幼激素(juvenile hormone,JH)是由昆虫咽侧体(corpus allatum,CA)中合成的一种倍半萜类化合物,参与了昆虫发育、变态、生殖、滞育等诸多生理事件(周树堂等,2012;Jindraetal.,2013)。前人在淡色库蚊Culexpipiens(鲁加龙等,1993;Kangetal.,2014)、始红蝽Pyrrhocorisapterus(Smykaletal.,2014)、七星瓢虫Coccinellaseptempunctata(刘梦姚等,2019)等众多生殖滞育型昆虫中已经证实,保幼激素信号的缺乏是雌成虫顺利进入并维持滞育的关键因素,而咽侧体内JH的合成调控对昆虫顺利完成生殖滞育准备至关重要(Denlingeretal.,2012)。
促咽侧体素(allatotropin,AT)和抑咽侧体素(allatostatin,AST)是由昆虫脑分泌的两种重要的CA活性调节剂,虽然只在较短的时段内发挥效应,却能有效激活或抑制一系列酶促反应,从而促进或抑制CA中JH的合成(刘艳等,2007;Stay and Tobe,2007)。前人的研究发现,对烟草天蛾Manducasexta的CA外源施加AT能显著促进JH的合成(Lietal.,2002),沉默淡色库蚊的AT也能有效抑制雌成虫卵巢的发育,促使个体由生殖向生殖滞育的转变(Kangetal.,2014)。而抑咽侧体素(ASTs)分别属于AST-A(Cockroach ASTs或FGL amides),AST-B[Cricket ASTs或W(X)6W amides]和AST-C(ManducaASTs或PISCFs) 3个不同的家族(Bendenaetal.,1999;Gilbertetal.,2000),其种类和功能在不同的昆中存在较大的差异。例如,红头丽蝇Calliphoravomitoria的AST-A对自身CA不具敏感性,却对太平洋折翅蠊Diplopterapunctata的CA中JH合成具有显著的抑制效果(Duveetal.,1994);双斑蟋蟀Gryllusbimaculatus的AST-A和AST-B虽然均对自身JH合成具有明显的抑制效果,但AST-B的抑制效果显著高于AST-A(Lorenzetal.,1995);而对埃及伊蚊Aedesaegypti的离体CA施加纯化获得内源性的AST-C也能明显抑制CA活性(Lietal.,2006)。这些研究表明,AT和AST确实可以增强或抑制CA的活性以调节JH的合成速率,但其是否也能通过调控JH合成以促进或抑制昆虫的生殖滞育准备,仍缺乏明确证据。
本研究以一种可被长光照诱导进入生殖滞育的十字花科蔬菜害虫——大猿叶虫Colaphellusbowringi为模型开展研究。前期研究发现,JH信号在大猿叶虫生殖和滞育的决定的调控中发挥着举足轻重的作用,低水平的JH通过抑制大猿叶虫雌成虫卵黄原蛋白(vitellogenin,Vg)基因Vg1和Vg2的表达以抑制卵巢的发育,从而促进滞育的发生(Liuetal.,2016)。本研究克隆大猿叶虫CbAT,CbAST-B和CbAST-C基因,再通过RNAi和qRT-PCR等技术,明确CbAT和CbASTs在滞育与非滞育雌虫头部的表达差异;检测其对JH合成途径的乙酰-CoA乙酰转移酶(acetyl-CoA acetyltransferase)基因AACT,法尼基焦磷酸合酶(farnesyl diphosphate synthase)基因FPPS,以及JH合成限速酶保幼激素酸O-甲基转移酶(juvenile hormone acid O-methyltransferase)基因JHAMT以及受JH的诱导表达Krüppelhomolog1(Kr-h1)基因和保幼激素酯酶(juvenile hormone esterase)基因JHE1的表达变化以指示JH信号水平的变化(Noriega,2014;Zhuetal.,2017);同时检测卵黄原蛋白合成基因Vg1和Vg2表达量变化,探究其在其生殖滞育准备期对JH信号以及卵黄积累的调控功能,以期为进一步明确昆虫滞育的上游调控路径、挖掘害虫防治新靶标提供了新思路。
1 材料与方法
1.1 供试昆虫
供试大猿叶虫Colaphellusbowringi成虫(约500头)于2017年11月采自江西省修水县(29°1′N,114°4′E)。在智能人工气候箱(HP-250-GS,武汉瑞华仪器设备有限公司)中,以新鲜的长羽裂萝卜Raphanussativusvar.longipinnatus叶片饲养2019年秋季滞育解除的大猿叶虫成虫,获得繁殖个体。在温度25℃和RH 70%的饲养条件下,大猿叶虫幼虫期约为8 d,蛹期约为4 d(薛芳森等,2002),蛹期可进行雌雄鉴别(Wangetal.,2006)。饲养温度25℃和光周期12L∶12D时,可获得注定非滞育个体,雌成虫4日龄前为产卵前期,期间卵巢内卵黄原大量积累而脂肪积累较少;饲养温度25℃和光周期16L∶8D时,可获得注定滞育个体,雌成虫4日龄前为滞育准备期,此期间卵巢发育受到抑制而脂肪体内积累大量脂质(Xueetal.,2002;Wangetal.,2004;Tanetal.,2016)。
1.2 基因鉴定、克隆及序列分析
利用前期建立的大猿叶虫转录组数据库(Tanetal.,2015),鉴定大猿叶虫CbAT和CbASTs基因,通过NCBI网站在线工具ORFfinder(https:∥www.ncbi.nlm.nih.gov/orffinder/)搜索其开放阅读框(ORFs),并利用ExPASy在线翻译工具Translate(http:∥web.expasy.org/translate/)对其进行氨基酸的序列转换。利用Premier 5.0软件设计试验所需引物(表1)。克隆目的基因PCR反应体系及条件参照TransTaqDNA Polymerase High Fidelity试剂盒(TransGen Biotech)说明书,将目标片段进行胶回收(AxyPrep DNA凝胶回收试剂盒,Axygen)并连接pMD18-T载体(TaKaRa)后测序以验证序列正确性。
基于NCBI的Protein数据库(https:∥www.ncbi.nlm.nih.gov/protein/)中检索获得的不同物种AT和AST氨基酸序列,并利用Blast工具(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)与其他物种氨基酸序列进行相似度比较,再通过MEGA 6.6软件中邻接(neighbor-joining)法进行系统进化分析。利用ExPASy在线软件pI/Mw(https:∥web.expasy.org/compute_pi/)分别对大猿叶虫CbAT,CbAST-B和CbAST-C蛋白质的等电点和分子量进行预测。
1.3 总RNA提取与反转录
对1.1节饲养的供试大猿叶虫注定滞育与注定非滞育2-3日龄雌蛹、初羽化雌成虫(定义为0日龄)和1-4日龄雌成虫头部(去除触角)剪下,液氮速冻于无RNA酶离心管中,每样本大于10头,重复3次。将样品用液氮研磨至粉末后,利用Trizol法进行总RNA的提取,具体步骤可参考RNAiso Plus(TaKaRa)说明书。
利用1.0 μg获得的总RNA进行cDNA合成,具体方法与步骤参照Prime Script RT Reagent Kit with gDNA Eraser(TaKaRa)进行。
1.4 qRT-PCR检测目的基因表达
将1.3节反转录获得的cDNA用ddH2O稀释20倍后,用于目的基因表达量检测。供试qRT-PCR引物序列及扩增效率等信息参考(表1)。qRT-PCR方法参照实验室前期在大猿叶虫中建立的平台(Liuetal.,2016),以RPL19和Actin1作为内参基因(Tanetal.,2015),利用SYBR Premix Ex Taq II(TaKaRa)进行体系配制,并在LightCycler 96(Roche)程序上完成数据采集及分析。
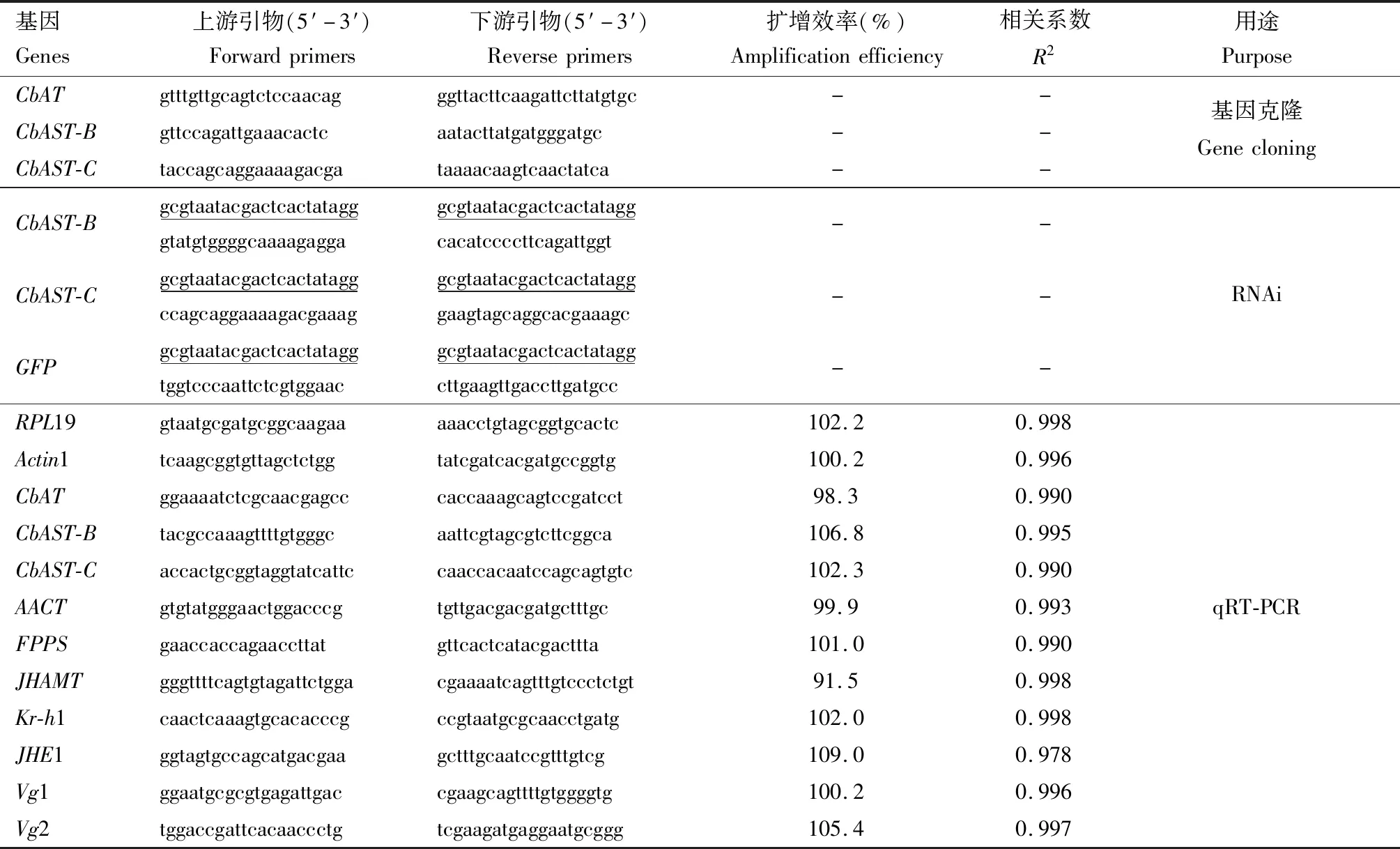
表1 本研究所用引物Table 1 Primers used in this study
1.5 RNA干扰
基因的RNAi试验方法参考前期建立的大猿叶虫RNAi平台(Liuetal.,2016)。利用表1中RNAi引物对CbAST-B和CbAST-C的dsRNA区段进行PCR扩增,连接pMD18-T载体(TaKaRa)后测序以验证序列正确性。参照1.2节方法,利用测序正确后的pMD18-T-CbAST-B和pMD18-T-CbAST-C以及实验室前期构建的pGEX-4T-GFP为模板,分别对CbAST-B,CbAST-C和GFP基因进行PCR扩增后,切胶回收获得3个基因的dsRNA合成模板,并测定浓度;分别取1.0 μg的CbAST-B,CbAST-C和GFP的dsRNA合成模板,参照T7 RNA Polymerase(Invitrogen)方法合成dsRNA。
将200.0 nL的质量为2.0 μg的CbAST-B和CbAST-C的dsRNA注射至注定滞育2日龄雌蛹腹腔。对于CbAST-B和CbAST-C基因的混合RNA干扰试验,每个基因2.0 μg的dsRNA均匀混合为200.0 nL,然后注射到虫体中。所有RNAi实验均以dsGFP为对照。RNAi后,按1.1节方法饲养至4日龄雌成虫,剪下雌成虫头部(去除触角)并解剖脂肪体,均置于无RNA酶离心管中,每样本组织大于10头,液氮速冻置于-80℃冰箱保存,同时观察卵巢发育情况。依据1.3节方法对样品进行总RNA提取和反转录反应,再利用qRT-PCR(同1.4节)检测头部(去除触角)样品中的目标基因的沉默效率以及JH合成基因AACT(GenBank登录号:MT977124),FPPS(GenBank登录号:MT977125)和JHAMT(GenBank登录号:MT977123)以及脂肪体中JH应答基因Kr-h1(GenBank登录号:KX753345.1)和JHE1(GenBank登录号:KY229689.1)和卵黄原蛋白基因Vg1(GenBank登录号:KU516007.1)和Vg2(GenBank登录号:KU516008.1)的表达量变化。
1.6 数据分析
基因的相对表达量计算采用2-ΔΔCT法(Schmittgen and Livak,2008),基于3次生物学重复。基因的相对表达量数据呈现为平均值±标准差,其差异显著性分析均采用SPSS 11.5软件中独立样本t测验(independent samplest-test)进行,再利用GraphPad Prism 8.0绘图。
2 结果
2.1 大猿叶虫CbAT和CbASTs基因的鉴定与序列特征
在大猿叶虫转录组中,鉴定到一个促咽侧体素基因CbAT(GenBank登录号:MT977128)和两个抑咽侧体素基因CbAST-B(GenBank登录号:MT977126)和CbAST-C(GenBank登录号:MT977127),ORF分别长408,600和303 bp,分别编码135,199和100个氨基酸,预测等电点分别为9.57,6.53和9.18,预测蛋白分子量分别为15.67,23.21和11.64 kD。
2.2 大猿叶虫CbAT和CbASTs蛋白的系统进化分析与多重序列比对
为了进一步鉴定大猿叶虫中CbAT,CbAST-B和CbAST-C的同源基因,本研究分别对这3个基因的氨基酸序列进行系统进化分析和序列的同源比对。研究发现,利用不同物种AT蛋白构建的有根的系统发育进化树中,不同目的昆虫之间在分支上彼此分离,大猿叶虫的CbAT与赤拟谷盗Triboliumcastaneum的TcAT聚为一支,所有昆虫AT均与非昆虫外群物种大型溞Daphniamagna亲缘关系最远(图1:A)。与鞘翅目、双翅目、膜翅目以及直翅目等昆虫AT进行氨基酸序列多重比对发现,大猿叶虫CbAT的氨基酸序列具备保守的TARGF(Y)G区域以及典型的KR位点(Veenstra and Costes,1999),其序列与赤拟谷盗、埃及伊蚊以及欧洲熊蜂Bombusterrestris的AT的序列一致性分别为32.6%,22.5%和20.8%(图2:A)。再分别以大型溞的DmAST-B和挪威龙虾Nephropsnorvegicus的NnAST-C为外群构建昆虫的ASTs进化树,大猿叶虫CbAST-B和CbAST-C分别处于昆虫AST-B和AST-C两大基因家族分支下,并与鞘翅目昆虫在小分支上距离最近(图1:B,C)。同时,通过氨基酸序列的多重序列比对发现,大猿叶虫CbAST-B和CbAST-C的氨基酸序列中均具备多个经典的KR位点,其中CbAST-B具有6个典型的W(X)6W结构,分别为WNRDLSMW-amide,WNNIHGGW-amide,WQKFQGGW-amide,WNKFTDGW-amide,WDNFRGTW-amide和WTNLKGMW-amide,且大多W(X)6W的碳(C)端都具有一个甘氨酸(Glycine,G)残基(图2:B);而CbAST-C同样具备典型序列区段RFRA(Q)CYFNPV(I)SCF(图2:C),且在YFNPVS两端的两个半胱氨酸(Cysteine,C)形成一个二硫键桥(Mengetal.,2015)。另外,CbAST-B与马铃薯甲虫Leptinotarsadecemlineata、赤拟谷盗以及堆沙白蚁Cryptotermessecundus序列一致性分别为62.0%,52.7%和27.0%(图2:B),而CbAST-C与赤拟谷盗、黑腹果蝇Drosophilamelanogaster和家蚕的AST-C氨基酸序列一致性分别为30.9%,23.6%和25.0%(图2:C)。以上进化树和氨基酸序列比对分析结果表明,本研究获得的3个基因分别是大猿叶虫CbAT,CbAST-B和CbAST-C的同源基因。
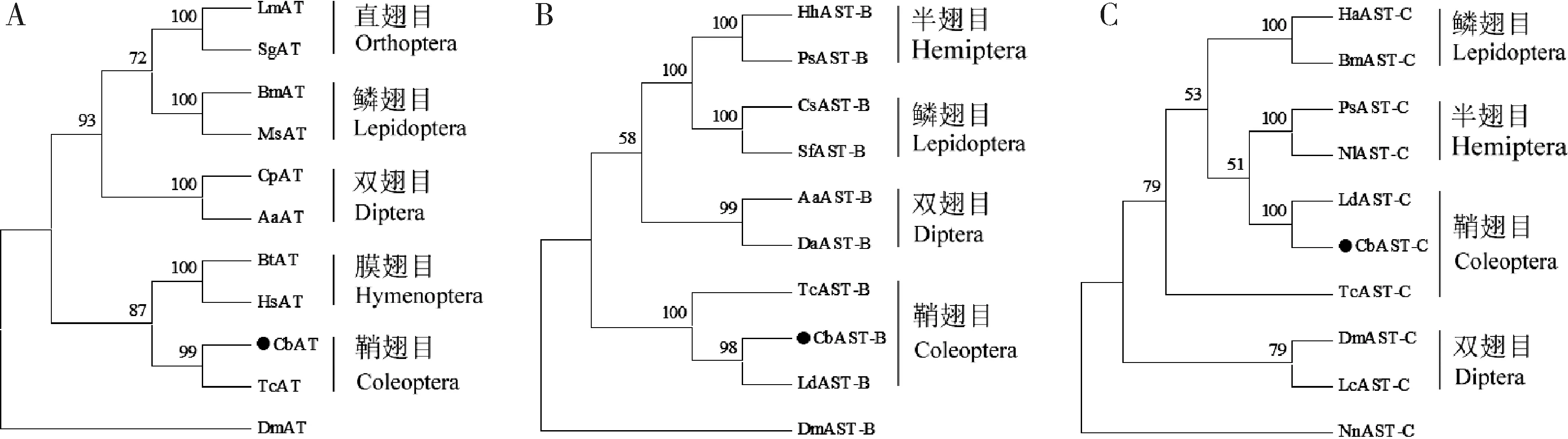
图1 基于氨基酸序列的大猿叶虫CbAT (A),CbAST-B (B)和CbAST-C (C)蛋白的系统进化分析(邻接法)Fig.1 Phylogenetic analysis of CbAT (A),CbAST-B (B) and CbAST-C (C) proteins in Colaphellus bowringi based on the amino acid sequences by neighbor-joining method蛋白来源物种及GenBank登录号Origin species of proteins and their GenBank accession numbers:LmAT:东亚飞蝗Locusta migratoria (AKN21240.1);SgAT:沙漠蝗虫Schistocerca gregaria (AKC92815.1);BmAT:家蚕Bombyx mori (XP_021207265.1);MsAT:烟草天蛾Manduca sexta (AAB08759.1);CpAT:淡色库蚊Culex pipiens (AHG94987.1);AaAT:埃及伊蚊Aedes aegypti (AAB06179.1);BtAT:欧洲熊蜂Bombus terrestris (XP_003398476.1);HsAT:印度跳蚁Harpegnathos saltator (XP011135972.1);CbAT:大猿叶虫Colaphellus bowringi (QNT17938);TcAT:赤拟谷盗Tribolium castaneum (EFA09244.2);DmAT:大型溞Daphnia magna (JAN79122.1);HhAST-B:茶翅蝽Halyomorpha halys(XP_024219541.1);PsAST-B:小珀椿象Plautia stali (BAU88428.1);CsAST-B:二化螟Chilo suppressalis (ALM30300.1);SfAST-B:草地贪夜蛾Spodoptera frugiperda (ALM30300.1);AaAST-B:埃及伊蚊Aedes aegypti (AAB06179.1);DaAST-B:银额果蝇Drosophila albomicans (XP_034105339.1);TcAST-B:赤拟谷盗Tribolium castaneum (XP_008191729.1);CbAST-B:大猿叶虫Colaphellus bowringi (QNT17936);LdAST-B:马铃薯甲虫Leptinotarsa decemlineata (AIW62335.1);DmAST-B:大型溞Daphnia magna (XP_032788834.1);HaAST-C:棉铃虫Helicoverpa armigera (AGH25547.1);BmAST-C:家蚕Bombyx mori (BAG68396.1);PsAST-C:小珀椿象Plautia stali (BAV78790.1);NlAST-C:褐飞虱Nilaparvata lugens (BAO00971.1);LdAST-C:马铃薯甲虫Leptinotarsa decemlineata (AIW62334.1);CbAST-C:大猿叶虫Colaphellus bowringi (QNT17937);TcAST-C:赤拟谷盗Tribolium castaneum (EFA09152.2);DmAST-C:黑腹果蝇Drosophila melanogaster (NP_523542.1);LcAST-C:铜绿蝇Lucilia cuprina (XP_023293632.1);NnAST-C:挪威龙虾Nephrops norvegicus (BX89028.1).
2.3 CbAT和CbASTs在注定滞育和注定非滞育大猿叶虫不同发育阶段头部中的表达差异
CbAT在大猿叶虫注定非滞育3日龄雌成虫头部出现表达高峰(图3:A),而CbAST-B和CbAST-C分别在注定滞育2和4日龄雌成虫头部出现表达高峰(图3:B,C)。在整个注定滞育与注定非滞育2日龄雌蛹到4日龄雌成虫期间,CbAT基因始终无表达差异(图3:A);而CbAST-B和CbAST-C分别自雌成虫1和2日龄开始在注定滞育个体显著高表达(P<0.05),且表达差异一直持续到滞育准备期结束(图3:B,C)。

图3 CbAT (A),CbAST-B (B)和CbAST-C (C)在注定滞育和注定非滞育大猿叶虫不同发育阶段雌虫头部中的相对表达量Fig.3 Relative expression levels of CbAT (A),CbAST-B (B) and CbAST-C (C) in the head of the diapause-destined and non-diapause-destined females of Colaphellus bowringi at different developmental stages2-3dP:分别为2-3日龄雌蛹2-day-old and 3-day-old female pupa,respectively;0dA:初羽化雌成虫Newly emerged female adult;1-4dA:分别为1-4日龄雌成虫1-4-day-old female adult,respectively.图中数据为平均值±标准差,基于3次生物学重复。nsP>0.05;*P<0.05;**P<0.01(独立样本t检验)。Data in the figure are mean±SD based on three biological replicates.nsP>0.05;*P<0.05;**P<0.01 (independent samples t-test).下同The same below.
2.4 沉默CbASTs基因对JH信号基因表达的影响
为进一步明确CbASTs基因在大猿叶虫滞育准备调控中的功能,本研究分别沉默CbAST-B,CbAST-C以及共同沉默CbAST-B+CbAST-C,并检测JH合成基因AACT,FPPS和JHAMT以及JH的应答基因Kr-h1和JHE1的表达量变化。研究发现,无论是单独沉默CbAST-B和CbAST-C,还是同时沉默CbAST-B和CbAST-C,均有较高的沉默效率,达到72.8%~96.8%(图4)。另外,AACT,FPPS,JHAMT,Kr-h1和JHE1的表达均被不同程度显著上调(图5)。这些结果表明,沉默CbAST-B或CbAST-C基因可显著促进JH合成基因的表达。

图4 注定滞育大猿叶虫4日龄雌成虫头部的CbAST-B (A),CbAST-C (B)和CbAST-B+CbAST-C (C) RNAi效率检测Fig.4 RNAi efficiency of CbAST-B (A),CbAST-C (B) and CbAST-B+CbAST-C (C) in the head of the diapause-destined 4-day-old female adults of Colaphellus bowringi dsGFP为对照。dsGFP was used as the control.下同The same below.

图5 沉默CbAST-B (A,D),CbAST-C (B,E)和CbAST-B+CbAST-C (C,F)对注定滞育大猿叶虫4日龄雌成虫JH信号基因表达的影响Fig.5 Effects of knocking down CbAST-B (A,D),CbAST-C (B,E) and CbAST-B+CbAST-C (C,F) on the expression of JH signaling genes in the diapause-destined 4-day-old female adults of Colaphellus bowringi检测去除触角的头部样品中JH合成基因AACT,FPPS和JHAMT以及脂肪体样品中JH应答基因Kr-h1和JHE1的表达量。The expression levels of JH biosynthesis genes AACT,FPPS and JHAMT in head samples without antenna and JH-responsive genes Kr-h1 and JHE1 in fat body samples were determined.
2.5 沉默CbASTs基因对大猿叶虫卵黄原蛋白基因表达和卵巢发育的影响
为了进一步明确CbAST-B和CbAST-C介导的保幼激素信号能否调节大猿叶虫滞育准备,在注定滞育的大猿叶虫中沉默CbASTs观察卵巢发育程度并检测了卵黄原蛋白基因Vg1和Vg2的表达量变化。研究发现,沉默干扰CbAST-B,CbAST-C和CbAST-B+CbAST-C后,大猿叶虫4日龄注定滞育雌成虫脂肪体中Vg1和Vg2的表达均被显著上调(图6:A,B,C),但雌成虫卵巢发育程度均未没有明显的促进效果,卵巢管仍呈现丝状或膨大状且无明显的卵黄积累(图6:D)。推测在注定滞育的大猿叶虫中,CbAST-B和CbAST-C抑制了脂肪体内Vg1和Vg2的表达,有限地抑制了雌成虫卵巢的发育,促进滞育准备的完成。
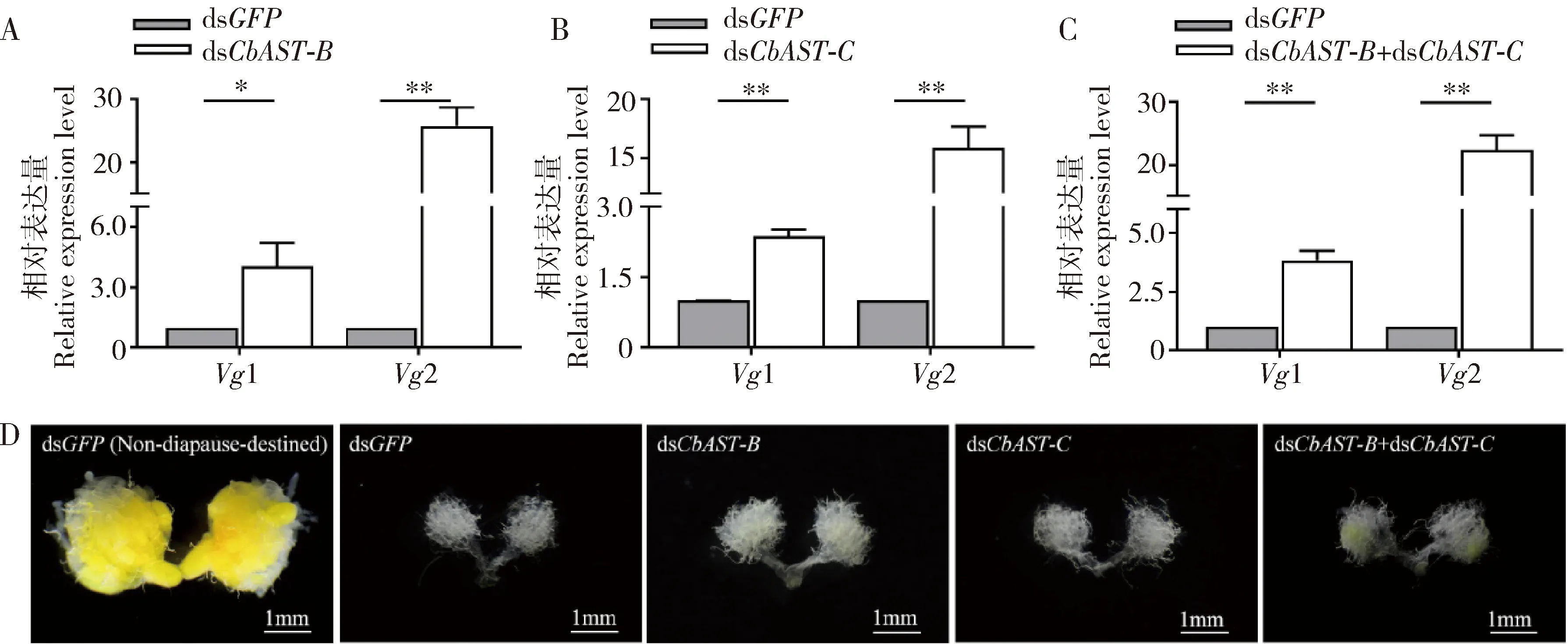
图6 沉默CbAST-B (A),CbAST-C (B)和CbAST-B+CbAST-C (C)对注定滞育大猿叶虫4日龄雌成虫脂肪体中Vg1和Vg2表达以及卵巢发育(D)的影响Fig.6 Effects of knocking down CbAST-B (A),CbAST-C (B) and CbAST-B+CbAST-C (C) on the expression of Vg1 and Vg2 in the fat body and ovarian development (D) in the diapause-destined 4-day-old female adults of Colaphellus bowringi
3 讨论
在具生殖滞育特性的昆虫中,活化的咽侧体会生成更多的JH来促进昆虫的产卵并繁殖后代,而抑制其咽侧体的活性来维持较低的JH水平是昆虫顺利进入生殖滞育的先决条件(Denlingeretal.,2012)。在许多昆虫中发现,由脑分泌的AT和AST在成虫CA的活化和JH的合成调控中扮演了重要的角色(Weaver and Audsley,2009)。AT作为一种重要的昆虫JH合成生物促进因子,已经在烟草天蛾、埃及伊蚊等多种昆虫中均被成功鉴定(Kataokaetal.,1989;Veenstra and Costes,1999)。ASTs在昆虫中分化为A,B和C 3个不同的家族,在家蚕和双斑蟋蟀中可以鉴定到AST-A和AST-B,马铃薯甲虫中鉴定到AST-B和AST-C,而烟草天蛾和黑腹果蝇中可以同时鉴定到3种ASTs的同源基因(Stay and Tobe,2007;Mengetal.,2015)。本研究在大猿叶虫中鉴定到了一个CbAT和两个CbAST-B和CbAST-C的同源基因,其氨基酸序列均能在进化树上与鞘翅目物种聚为一支(图1)。同时,大猿叶虫CbAT,CbAST-B和CbAST-C的序列分别具备保守结构域TARGF(Y)G,W(X)6W以及PV(I)SCF以及经典的KR位点(图2),但与赤拟谷盗同源基因的氨基酸序列一致性却分别仅为32.6%,52.7%和30.9%。这是由于昆虫AT和AST作为神经肽基因,编码肽链氨基酸数量较少,因此在物种间序列分化程度较高,这也进一步验证了其序列上保守的结构与区段在物种进化过程中的高度保守性。
对于淡色库蚊、始红蝽以及大猿叶虫等具生殖滞育特性的昆虫而言,JH对雌成虫卵粒的成熟具有明显的促进作用,而JH缺乏会导致雌成虫卵巢发育停滞并进入生殖滞育(Kangetal.,2014;Smykaletal.,2014;Liuetal.,2016)。但关于JH合成是如何被促进或抑制的机制一直未能明确,而神经肽作为昆虫生命活动的重要调节因子,其在JH合成中的调控功能被广泛关注。研究发现,AT可以刺激烟草天蛾CA产生大量的JH,促进雌成虫卵粒的成熟(Nijhout and Riddiford,1974;Kataokaetal.,1989),沉默AT基因可导致淡色库蚊雌成虫卵巢发育停滞,引发生殖向滞育的转变(Kangetal.,2014),但在大猿叶虫中,CbAT基因对滞育诱导光信号的变化并不敏感,其表达水平在滞育诱导末期到滞育准备期结束均与生殖个体无显著的分化(图3),据此推测其对生殖和滞育的决定不起主要作用。然而,CbAST-B和CbAST-C在滞育准备期的表达量均显著高于产卵前期(图3),暗示CbASTs基因可能参与了大猿叶虫注定滞育个体中JH含量的下调和滞育准备,随后的RNAi实验进一步验证了这一推测。当沉默注定滞育大猿叶虫的CbAST-B和CbAST-C后,JH合成起始步骤基因AACT以及限速酶基因JHAMT的表达也被显著上调(图5),这可能是由于沉默CbASTs基因打破了其对CA中柠檬酸从线粒体到细胞质的转运的阻隔作用,促进了JH合成初级底物乙酰-CoA的生成(Nouzovaetal.,2015),进而有效激活了JH合成及其信号通路,从而进一步促进了下游转录因子Kr-h1基因以及受JH诱导的JHE1的表达(图5)。另外,本研究沉默大猿叶虫CbAST-B和CbAST-C后均能促进脂肪体内卵黄原蛋白基因Vg1和Vg2的表达,却不能逆转雌成虫卵巢的发育状态(图6)。这是由于卵巢的发育是多层次的,包括卵母细胞、滤泡细胞、滋养细胞等的组织器官自身发育以及卵黄原蛋白的合成及卵母细胞对其的摄取等诸多过程。研究发现,昆虫卵黄原蛋白在脂肪体中合成,并通过囊泡运输至昆虫血淋巴,从而被卵母细胞吸收积累与卵巢小管(龚和和翟启慧,1979)。另外,JH可以促进滤泡细胞膜的开放以及卵黄原蛋白受体(vitellogenin receptor)基因VgR的表达,从而促进卵黄原蛋白的吸收(Davey,1981;Liuetal.,2018),而大猿叶虫CbAST-B和CbAST-C通过抑制了JH的合成限制了卵黄原蛋白的生成和吸收,而对于卵巢细胞自身的分化和发育并没有明显的调控功能。综上所述,CbAST-B和CbAST-C作为重要的JH合成调控因子,在长光照诱导的大猿叶虫滞育准备阶段抑制了JH的合成,进而抑制了卵黄的生成、促进了滞育的发生;而促咽侧体素基因CbAT不在表达水平上响应滞育诱导光周期,因此可能不是生殖和滞育转变的关键调控因子。本研究进一步揭示了昆虫生殖滞育准备期保幼激素信号的调控机制,有助于进一步理解昆虫对环境的季节性适应策略,为开发害虫防控新靶标提供了理论借鉴。
