牛瘤胃纤维素酶eg 基因在乳酸菌中的克隆表达及酶学性质分析
2021-03-02邹爱爱魏亚琴杨宇泽孙康永杰万学瑞
邹爱爱,魏亚琴,杨宇泽,曹 磊,孙康永杰,万学瑞,王 川
(1.甘肃农业大学动物医学院, 甘肃 兰州 730070;2.甘肃省科学院生物研究所/甘肃省微生物资源开发利用重点实验室 / 厌氧微生物中心, 甘肃 兰州 730000;3.北京市畜牧总站,北京 100107)
纤维素(cellulose)是植物细胞壁的主要成分,木质纤维素生物质包括农作物和森林残留物,是地球上最丰富的生物质资源[1]。随着我国畜牧业的发展,农作物秸秆等的纤维素产量越来越多,为缓解环境污染和促进能源循环利用,纤维素的生物降解现在已经开始被广泛研究。相比于化学和物理方法降解纤维素,生物降解法更加环保和高效,纤维素酶在生物降解利用纤维素的过程中起着关键作用[2]。牛瘤胃液中的微生物能分泌出活性较高的纤维素酶[3]。纤维素酶是纤维素降解的基础生物酶,主要由外切β-葡聚糖酶(1, 4-β-D-glucan cellobilhydrolase,EC 3.2.1.91)、β-葡 萄 糖 苷 酶(β-1, 4-glucosidase, EC 3.2.1.21, BG)和 内 切β-葡 聚 糖 酶(1, 4-β-D-glucan glucanohydrolase, EC 3.2.1.4)组成[4]。由eg基因所编码的内切葡聚糖酶作为纤维素酶系的主要成分,其结构包括纤维素结合结构域(cellulose binding domain)、连接桥(linker)和催化结构域(catalytic domain),这3 种结构在纤维素降解中起着至关重要的作用[5],该酶通过切割纤维素分子内部的非结晶随机水解β-1, 4糖苷键,将长链的纤维素分子截断,产生大量含非还原性末端的小分子纤维素,之后在外切葡聚糖酶(由cbh基因编码)和β-葡萄糖苷酶(BG)的共同作用下将纤维素彻底降解成葡萄糖[6],从而实现纤维素的彻底降解,目前纤维素酶已被广泛用于许多工业领域[7]。
目前,常见内切葡聚糖酶基因的表达系统有原核和真核表达系统,其中大肠杆菌(Escherichia coli)表达系统具有价格低廉、生长速度快、培养要求简单、重组子稳定等的优势,在科研中得到广泛的应用[8]。但大肠杆菌表达系统存在着表达的蛋白常以包涵体的形式出现,导致蛋白纯化困难和活性降低等一些问题[9]。乳酸菌为一种兼性厌氧菌,在厌氧环境下可以大量繁殖,它们产生的乳酸会导致生存环境中的pH 下降从而阻断有害细菌的生长,将乳酸菌添加至饲料中可以提高饲料的营养价值,同时也可以防止饲料腐败变质[10]。作为食品级的菌株,具有GRAS (generally recognized as safe)认证资格[10],可被用作表达异源基因和抗原的递送载体,并且在蛋白表达过程中不以包涵体的形式出现[11]。科研中常利用乳酸菌构建的基因工程菌株在活菌疫苗、活性酶、细胞因子以及各种蛋白和多肽类等生产领域中显现出独特的优势和应用价值[12]。为获得高产重组内切葡聚糖酶的乳酸菌,本研究通过提取牛瘤胃液全基因组作为模板,克隆纤维素酶eg基因,构建原核表达载体,在乳酸菌中表达内切葡聚糖酶,该工程菌株的构建为重组内切葡聚糖酶乳酸菌在饲料工业上的开发及利用提供了参考。
1 材料与方法
1.1 材料
1.1.1 试验材料
乳酸菌(L.lactisNZ9000)、大肠杆菌(E.coliDH5α)、载体pMG36e 均为甘肃农业大学动物医学院微生物实验室保藏;牛瘤胃液(插管抽取)来源于天祝县某养殖场雄性黄牛。
1.1.2 培养基
LB 液体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,加水定容至1 L,121 ℃高压灭菌30 min;LB 固体培养基添加16 g 琼脂粉。GM17 液体培养基:胰蛋白胨5 g,大豆蛋白胨5 g,牛肉膏5 g,酵母粉2.5 g,葡萄糖5 g,蔗糖171 g,MgSO4·7H2O 0.25 g,β-磷酸甘油二钠(索莱宝公司) 19 g,加水至1 L,115 ℃高压灭菌20 min;GM17 固体培养基加16 g 琼脂粉。GM17-CMC-Na 固体培养基:在1 L 的GM17 固体培养基中加入10 g 羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na,来源于索莱宝公司),边加热边搅拌,待CMC-Na 溶解后,115 ℃灭菌20 min,用于刚果红染色。
1.2 试验方法
1.2.1 牛瘤胃液微生物全基因组的提取及eg基因的克隆及序列分析
采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide, CTAB)法提取牛瘤胃液微生物全基因组[13]。根据美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库公布的芽孢杆菌属的内切纤维素酶序列设计引物,采用DNAStar7.1 生物学软件设计引物:F:5’ -CGAGCAAGAAGGAGATATACATGCAAAAAA AAGATTATCTCAGCTAATGAAACGGTCAATCTCT AA-3’(下划线为SacⅠ的酶切位点,波浪线为添加的信号肽序列),R:5’-GCTCTAGACTAATTTGGTTC TGTTCCCCA-3’(下划线为XbaⅠ的酶切位点),将扩增出的eg基因与pMD-18T 质粒连接后送至天津金唯智公司测序后进行Blast 比对并下载同源性相近的序列构建系统发育进化树。以牛瘤胃液微生物全基因组为模板用Taq 酶(诺唯赞有限公司)扩增目的基因eg,PCR 反应体系为94 ℃ 预变性5 min,94 ℃变性30 s,56 ℃ 退火30 s,72 ℃ 延伸90 s,35 个循环,72 ℃ 延伸10 min;PCR 产物通过1%琼脂糖凝胶进行电泳检测,并用DNA 纯化回收试剂盒(北京天根生化科技有限公司)回收。
1.2.2 重组表达质粒的构建
使用两种内切酶SacⅠ和XbaⅠ (TaKaRa 公司)在37 ℃同时酶切eg基因和载体pMG36e 1 h,用T4 DNA 连接酶(Thermo Fisher 公司) 22 ℃过夜连接后转化至大肠杆菌E.coliDH5α 感受态细胞,挑取单克隆菌落进行菌液PCR 和提取质粒后用SacⅠ和XbaⅠ双酶切验证,酶切验证正确后并送至金唯智公司进行测序分析。
1.2.3 重组质粒转化乳酸菌及阳性转化子的筛选
挑取划线培养的乳酸菌NZ9000 单菌落接种于5 mL GM17 液体培养基中,30 ℃静止培养2 d,然后参照Holo 和Nes[14]的方法制作乳酸菌的感受态细胞,取测序正确的重组质粒DNA 1 μL (100 ng·uL-1)加入到10 μL 的感受态细胞中混合均匀后转移至预冷的电击杯中,电击条件为2 200 V,200 Ω,25 μF,菌液复苏3~4 h 后,涂布于GM17 (含2.5 μg·mL-1红霉素)的固体平板上,置于30 ℃培养48 h 后,挑取GM17 平板上的单个菌落,将菌液煮沸10 min 后进行PCR 验证,验证正确的重组乳酸菌NZ9000 用于后续试验。
1.2.4 重组质粒在乳酸菌中的表达
取验证正确的菌液按1 ∶ 100 的比例接种在GM17培养液中30 ℃静止培养48 h 后,将菌液在4 ℃、12 000 r·min-1条件下离心10 min,取发酵上清液用预冷的10% TCA/丙酮沉淀蛋白质,-20 ℃放置3 h 后于4 ℃、12 000 r·min-1离心10 min,用预冷的丙酮洗涤沉淀2 次,室温放置30 min,晾干彻底去除丙酮后加入1 mL ddH2O 溶解沉淀,分别将重组乳酸菌的菌液、培养液的上清液、菌体超声破碎后的沉淀及重组蛋白和空质粒重组菌的菌液、培养液的上清液、菌体超声破碎后的沉淀制样后进行SDS-PAGE 检测。
1.2.5 重组内切葡聚糖酶的酶活检测
采用刚果红(索莱宝公司)染色法检测该蛋白酶有无活性[15],用DNS 法测出重组内切葡聚糖酶OD550nm值(分光光度计)并计算出酶活值[16],试验组为重组乳酸菌发酵上清液浓缩蛋白,对照组为空质粒重组菌发酵上清液的浓缩蛋白,使用滤纸酶活力(FPA)法检测总酶活[17],利用刚果红染色法观察水解圈及其直径大小。
1.2.6 重组内切葡聚糖酶酶学性质初步研究
最适反应pH:在50 ℃的条件下,以1%羧甲基纤维素钠(CMC-Na)作为底物,溶解在磷酸盐缓冲液(购于索莱宝公司)中,在pH 4、5、6、7、8、9、10 的条件下用DNS 法测定重组内切葡聚糖酶酶活值并计算出相对酶活力,最高酶活值记为100%[16]。
最适反应温度:在pH 为6 的条件下,设置30、50、60、70、90 ℃的温度梯度,以1% CMC-Na 为底物,溶解在磷酸盐缓冲液中,用DNS 法在各温度下测定重组蛋白的酶活力,最高酶活力记为100%[16]。
底物水解能力分析:在pH 为6、反应温度为50 ℃的条件下分别以CMC-Na、滤纸(FPA)、脱脂棉、微晶纤维素(Avicel)为底物,溶解在磷酸盐缓冲液中,用DNS 法测定重组蛋白酶活力,分析重组EG 蛋白对不同底物的水解能力[16]。
不同金属离子对重组内切葡聚糖酶活性的影响:在pH 为6、反应温度为50 ℃的条件下,以1% CMC-Na为底物,溶解在磷酸盐缓冲液中,反应体系中添加5 mmol·L-1的 金 属 离 子(BaCl2、CaCl2、NaCl、HgCl2、FeCl2、MgCl2、MnCl2、CoCl2、ZnCl2、CuCl2、KCl),用DNS 法测定重组内切葡聚糖的酶活力,同时以未加金属离子的重组乳酸菌粗酶液作为对照组,其酶活力计为100%,以此确定各种金属离子对重组内切葡聚糖酶酶活的影响[16]。
1.3 数据分析
将以上数据用SPSS 19.0 软件的ANOVA 进行单因素方差分析,并用Duncan 法进行多重比较后,用Graph Prism 8.0 软件绘制折线图和柱状图。
2 结果与分析
2.1 eg 基因的克隆及表达载体构建
经PCR 扩增和核苷酸序列测定后可知该基因大小为1 500 bp (图1);在NCBI 上通过Blast 进行同源性比对,发现该基因序列与枯草芽孢杆菌(Bacillussubtilisstrain SRCM102748)的eg基因相似性达100%;根据基因序列通过MEGA 7.0 软件构建系统进化树(图2),发现试验所扩增的eg序列是来自Bacillussubtilisstrain SRCM102748 菌 株(登 录 号 为CP028212.1)。分别用SacⅠ和XbaⅠ内切酶同时酶切重组质粒pMG36e::eg和pMG36e 空质粒进行验证,pMG36e::eg质粒切出大小为1 500 bp 左右的条带(图1),获得的基因片段大小与预期大小相符,表明表达载体pMG36e::eg构建成功。
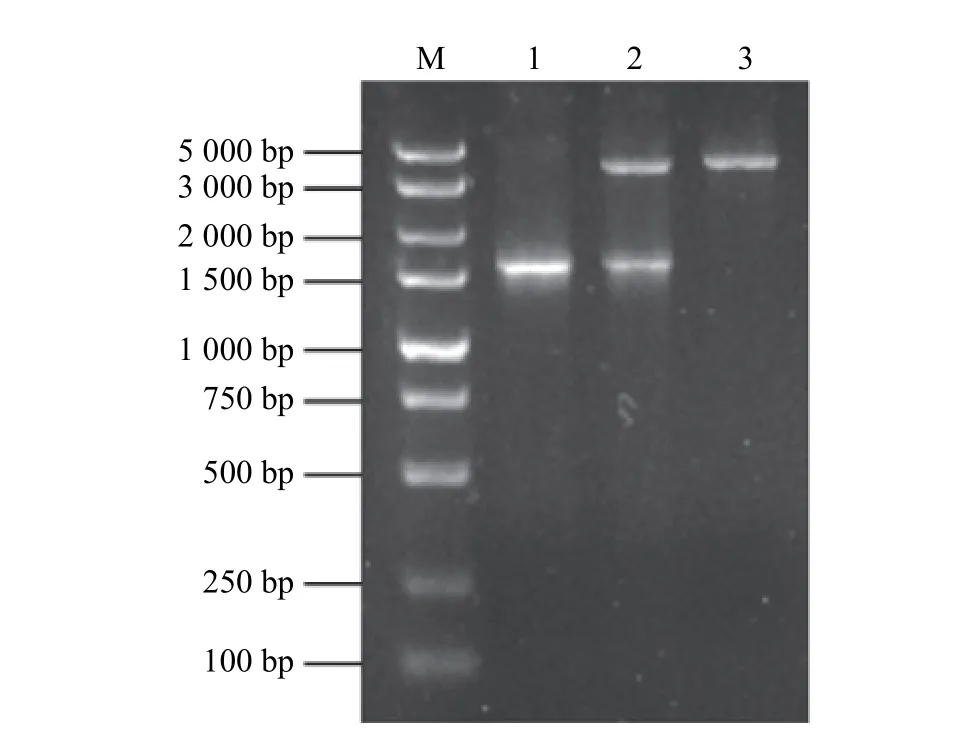
图1 目的基因的PCR 扩增产物及重组质粒双酶切鉴定Figure 1 PCR amplification products of the target gene and identification of the recombinant plasmid bydouble enzyme digestion
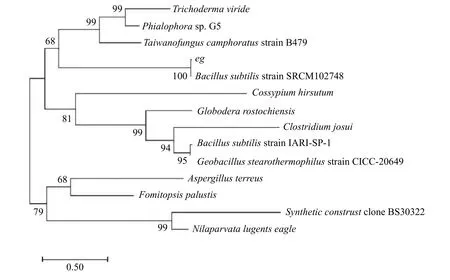
图2 eg 序列系统发育树Figure 2 A phylogenetic tree of the eg gene in different microbial species
2.2 eg 基因在乳酸菌中表达的SDS-PAGE 分析
通过10% TCA/丙酮沉淀法浓缩重组乳酸菌发酵上清液中的蛋白后,将重组乳酸菌的菌液、培养液的上清液、菌体超声破碎后的沉淀及空质粒重组菌的菌液、培养液的上清液和菌体超声破碎后的沉淀分别制样进行SDS-PAGE 分析,结果表明:空质粒重组菌的菌液、上清液和沉淀均无目的蛋白出现,而重组乳酸菌培养液的上清液浓缩蛋白在50 kDa附近有明显的条带(图3),表明有目的蛋白表达。
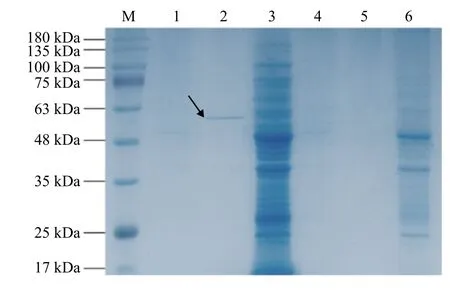
图3 SDS-PAGE 电泳Figure 3 SDS-PAGE electrophoresis
2.3 重组内切葡聚糖酶酶活力的测定
2.3.1 DNS 法和滤纸法测定重组内切葡聚糖酶的酶活力
用DNS 法测得内切葡聚糖酶酶活为12.401 9 U·mL-1,滤纸法测得总酶活为12.246 9 U·mL-1,通过SPSS 19.0 软件分析比较重组内切葡聚糖酶和对照组酶活力值发现,试验组显著高于对照组酶活(P<0.05) (表1),说明该酶具有良好的酶活性。
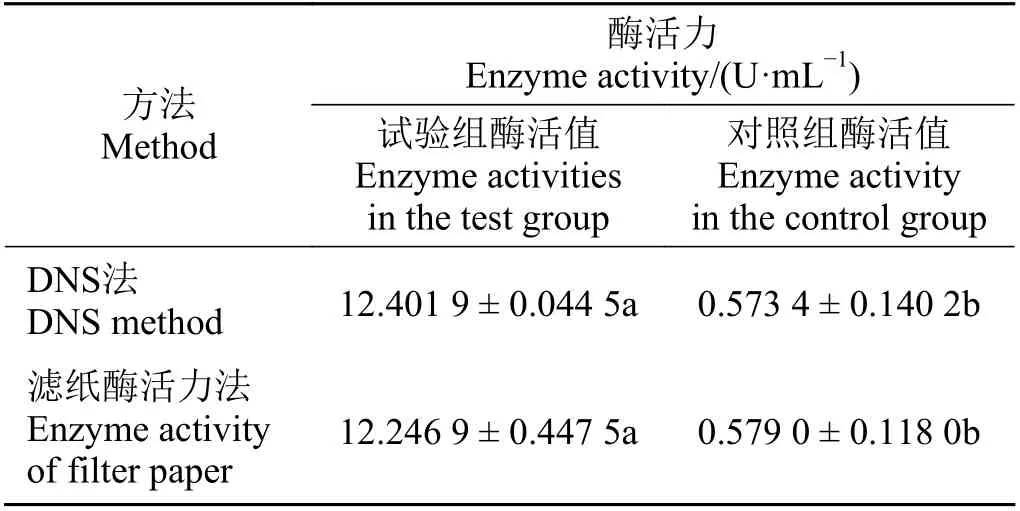
表1 二硝基水杨酸法和滤纸法测定酶活力值Table 1 Determination of enzyme activity using the 3,5-dinitrosalicylic acid (DNS) and filter paper methods
2.3.2 重组内切葡聚糖酶刚果红染色
分别将经SDS-PAGE 分析的样品和ddH2O 作为空白对照加入GM17-CMC-Na 固体培养基中30 ℃孵育反应12 h 后,发现空质粒pMG36e 重组菌的菌液、培养液的上清液、菌体破碎后的沉淀和ddH2O空白对照均无水解圈,但重组菌培养液的上清液和重组蛋白酶出现明显的水解圈,直径分别为1.98 和2.32 cm (图4),说明该蛋白为分泌型表达且具有酶活力。
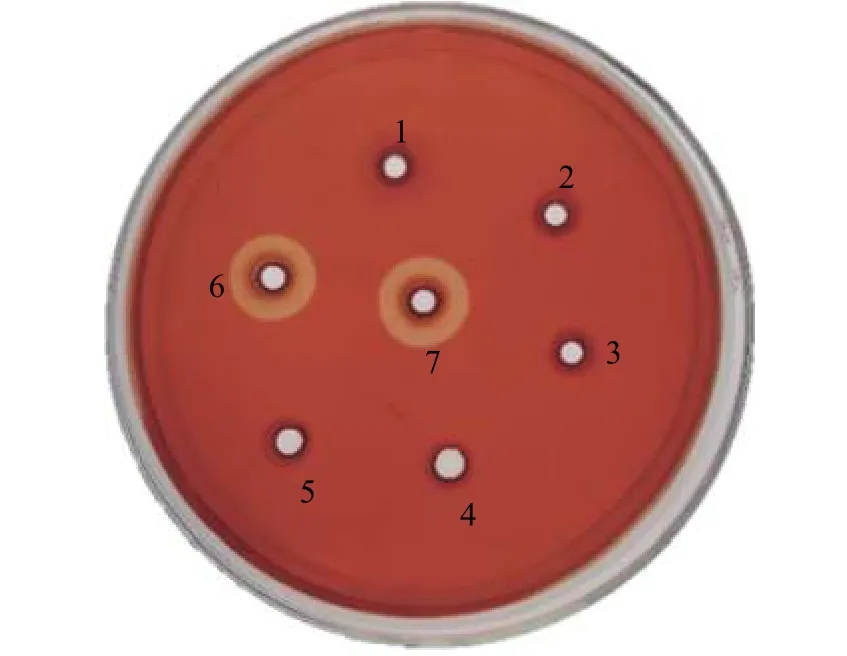
图4 刚果红染色水解圈Figure 4 Congo red stain zones of hydrolysis
2.3.3 重组内切葡聚糖酶的酶学性质分析
以CMC-Na 为底物测定重组内切葡聚糖酶在不同pH 下的酶活,结果显示最适反应pH 为6;在pH为5~7 时耐受性良好;在反应pH 低于5 时,酶活性降到很低(图5A)。因此在研究重组蛋白酶的最适反应温度、不同底物的水解能力、不同金属离子对重组蛋白影响的试验中反应pH 均为6。
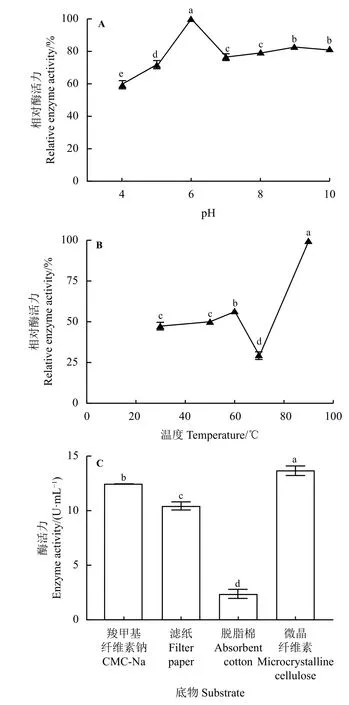
图5 重组内切葡聚糖酶酶学性质分析Figure 5 Analysis of the enzymatic properties of the recombinant endoglucanase
重组内切葡聚糖酶以CMC-Na 为底物,在反应pH 为6 的条件下,当反应温度低于70 ℃时,相对酶活力均低于60%,之后随着温度不断升高,酶活力也不断升高,当温度达90 ℃时重组内切葡聚糖酶的酶活值达到最高,最适反应温度为90 ℃(图5B)。
重组内切葡聚糖酶以CMC-Na、微晶纤维素、滤纸、脱脂棉为底物时均有一定酶活力,但以脱脂棉为底物时酶活力利用能力最低(图5C)。
重组内切葡聚糖酶以CMC-Na 为底物,在反应pH 为6、温度为50 ℃的条件下,Cu2+、Mn2+、Ba2+、Zn2+、Co2+、Hg2+、K+等均可以提高重组酶的酶活力,而Fe2+抑制重组内切葡聚糖酶的酶活力(表2)。
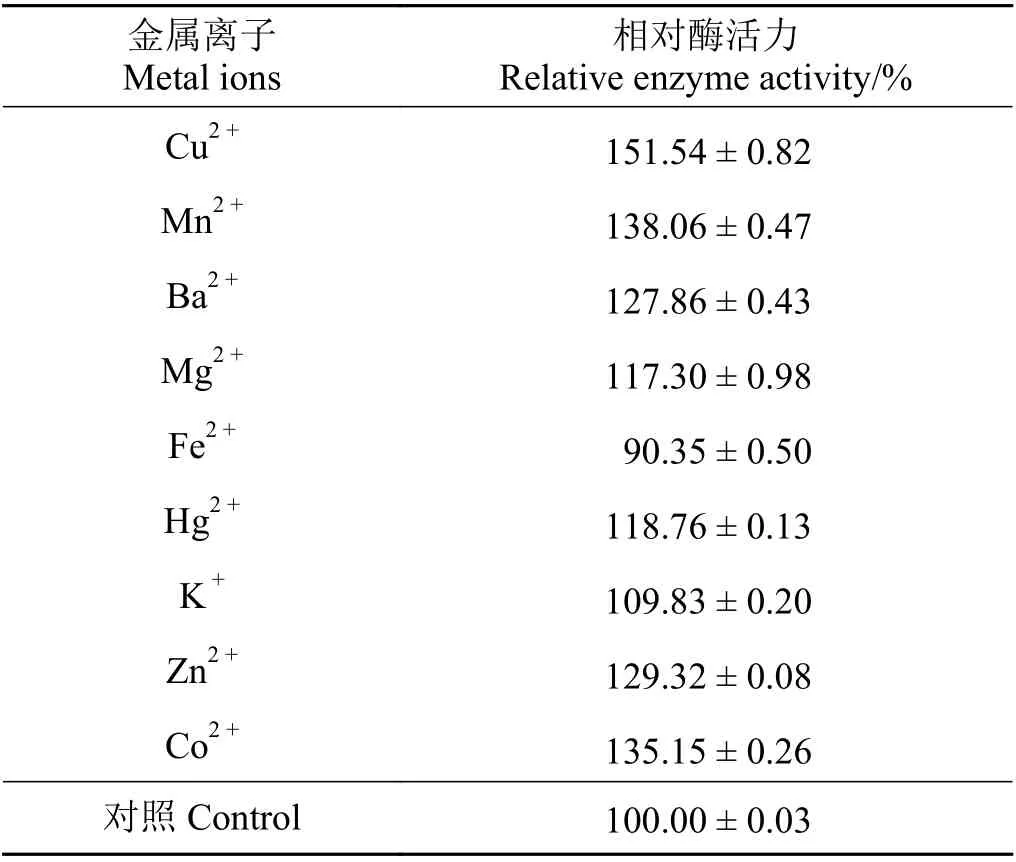
表2 各种金属离子对重组内切葡聚糖酶相对酶活力的影响Table 2 Effects of different metal ions on the relative enzyme activity of the recombinant endoglucanase
3 讨论
研究表明补充酶制剂可提高反刍动物的饲料利用效率,减轻环境污染并控制某些疾病[18]。据报道瘤胃微生物产生的纤维素酶是迄今为止最活跃的酶之一[19],其中瘤胃中的芽孢杆菌(Bacillus)可分泌多种纤维素酶和淀粉酶,本研究成功地克隆到Bacillus的纤维素酶eg基因并在乳酸菌中完成了表达。但因自然来源Bacillus所产内切葡聚糖酶产量低、活性低、难回收等问题,可将内切葡聚糖酶基因在外源宿主中表达来解决这一问题。大肠杆菌表达系统因细胞快速生长、廉价的培养基和相对简单的培养方法等优点在科研中得到广泛应用。汤斌等[20]在大肠杆菌系统中表达了eg2基因,酶活值为1.321 U·mL-1,但蛋白不能分泌至胞外;宝力德等[21]通过在大肠杆菌中克隆表达枯草芽孢杆菌(Bacillus subtilis)的eg基因,酶活力值达683 U·L-1,大多蛋白为包涵体表达。刘原子等[22]扩增出多粘类芽孢杆菌(Paenibacillus polymyxa)eg基因,并在大肠杆菌中表达,测得酶活值为2.427 U·mL-1。虽然在该系统中可表达出重组内切葡聚糖酶,然而一些报告描述了重组蛋白在大肠杆菌表达系统中不能正确折叠且纯化困难,可能会产生非功能性蛋白质[23],且大肠杆菌易引起动物机体损伤(如腹泻等),不易达到食品级的标准而难以满足工业生产需求。乳酸菌作为食品级的菌株,在蛋白表达过程中不以包涵体的形式出现,科研中常利用乳酸菌作为宿主细胞已成功表达出各种外源蛋白。Ozkose 等[24]克隆了来源于牛瘤胃厌氧真菌的Neocallimastixsp.的纤维素酶基因并在乳酸菌中完成表达,并将该重组蛋白酶添加至青贮饲料发现可提高纤维素的降解率。乳酸菌表达系统L.lactisNZ9000 是食品级安全表达系统且已被广泛应用,本研究所用质粒pMG36e 来源于pWV01 载体,该载体的强启动子p32 具有可供多种细菌识别的核糖体位点可供表达蛋白,该质粒大小约为3 600 bp,方便宿主菌携带[25]已在细菌表达系统中成功表达出各种酶[26-28]。王翠艳等[29]通过克隆绿色木霉(Trichoderma viride)纤维二糖水解酶基因cbhⅡ并利用质粒pMG36e完成在乳酸菌中的表达,测得重组蛋白酶活值达16.7 U·mL-1。本研究设计引物时在引物上游添加了一段信号肽序列,该段序列在基因表达过程中可引导蛋白向胞外持续分泌,实现高表达,将已克隆得到的eg基因序列连接表达质粒pMG36e 后电转至乳酸菌中,成功分泌表达出内切葡聚糖酶,蛋白分子大小为50 kDa 左右,与预期大小相符,1%羟甲基纤维素钠GM17 培养基验证时产生明显的水解圈,说明成功构建了分泌型表达载体,该内切葡聚糖酶活力值为12.401 9 U·mL-1。而王瑾等[30]扩增出eg基因,并在乳酸菌中表达,但测得蛋白酶无活性。本研究获得的内切葡聚糖酶的酶活与Nakazawa 等[31]测定的酶活相比,提高了24 倍,具有良好的酶活力。野生型的乳酸菌作为一类益生菌,是动物肠道的正常菌群,将其添加至饲料中可促进动物消化,提高动物免疫力,但无降解纤维素的能力[32]。谢骜李畅等[33]通过构建重组乳酸菌并将其添加至饲料中进行发酵,结果表明重组乳酸菌可对秸秆植物性饲料均发挥一定的降解作用。本研究所获得的重组内切葡聚糖酶的最适反应pH 为6,在pH 为5~7时耐受性良好,pH 稳定性的结果高于在枯草芽孢杆菌IARI-SP-1 (Bacillus subtilisIARI-SP-1)、地衣芽孢杆菌AU01 (B.licheniformisAU01)、解淀粉芽孢杆菌DL-3 (B.amyloliquefaciensDL-3)等细菌上的报道[34-36];各种金属离子对该重组内切葡聚糖酶的影响结果与朱泾等[37]试验结果相一致;该重组蛋白酶对不同底物的水解能力结果与Hakamada 等[38]报道的在Bacillussp.KSM-S237 上的试验结果相似;该重组内切葡聚糖酶的最适反应温度可达90 ℃,是一种耐高温酶,市场潜力巨大,可广泛应用于多种耐高温的工业生产中。
4 结论
本研究成功将来源于牛瘤胃微生物的内切葡聚糖酶在乳酸菌系统中进行了克隆和表达,成功构建了分泌型重组内切葡聚糖酶的乳酸菌,并进行了酶学性质分析。重组内切葡聚糖酶的分子量约为50 kDa,所用表达载体pMG36e 不需要添加诱导剂诱导,只需正常培养重组乳酸菌就可在培养基上清液中获得持续分泌的内切葡聚糖酶,检测到内切葡聚糖酶活力为12.401 9 U·mL-1;重组内切葡聚糖酶对CMC-Na、滤纸、微晶纤维素和脱脂棉均具有酶活力;最适反应温度为90 ℃;最适反应pH 为6,在pH 5~7 内具有较好的pH 耐受性;Cu2+、Mn2+、Ba2+、Zn2+、Co2+等均可以提高重组蛋白的酶活力,而Fe2+抑制重组内切葡聚糖酶活力。甘肃农业大学动物医学院微生物实验室正在将该重组内切葡聚糖酶作为纤维素酶制剂进行青贮发酵试验,将其添加至饲料中是否达到提高动物免疫力和饲料消化率的双重效果,还需要进一步验证。
