复发性子宫苗勒腺肉瘤伴肉瘤过度生长1例及文献复习
2021-03-01阮珞珊高利昆李新
阮珞珊,高利昆,李新*
子宫苗勒腺肉瘤(Mullerian adenosarcoma,MA)属于上皮-间叶混合性肿瘤类别,WHO将此种肿瘤分为腺纤维瘤、腺肌瘤、非典型性息肉样腺肌瘤、腺肉瘤和恶性苗勒混合瘤(癌肉瘤)五大类[1]。腺肉瘤的发病率占子宫肉瘤的5%~10%[2],是一种低度恶性潜能的混合型肿瘤,由良性的腺上皮和低级别肉瘤混合而成,肉瘤常为子宫内膜间质成分,其恶性程度与低级别子宫内膜间质肉瘤相似[3]。当腺肉瘤中无上皮的纯肉瘤成分所占比例>25%时,即诊断为苗勒腺肉瘤伴肉瘤过度生长(Mullerian adenosarcoma with sarcomatous overgrowth,MASO)[4],MASO易侵入深肌层并局部复发、远处转移[5],术后复发率高[4],影响生存,且无特异性治疗方法[6]。本文报道武汉大学人民医院妇Ⅱ科收治的1例复发性子宫MASO的患者,旨在复习MASO的临床表现、诊断要点、病理特点、治疗方法及预后,为该病的诊治提供临床依据。
1 病例摘要
患者张XX,女,64岁,因下腹胀痛15 d,超声检查发现盆腔巨大囊实性包块,于2019年11月6日入院。患者既往月经规律,17岁初潮,5/30天,月经量中等,无痛经,已绝经15年,G1P1,足月顺产1次,无特殊病史及治疗。绝经7年后于2011年11月在当地医院因“子宫肌瘤”行腹腔镜全子宫切除+双附件切除术+盆腔淋巴结清扫术,术后病检结果为子宫恶性潜能未定的平滑肌瘤,盆腔淋巴结未见转移,子宫内膜萎缩改变,双附件未见异常。术后未治疗随访。本次入院后查患者一般情况可,腹软,下腹稍膨隆,轻压痛,无反跳痛,无肌紧张。妇科检查:外阴发育正常,阴道畅,残端愈合可,三合诊盆腔扪及囊实性包块,约儿头大小,活动欠佳,轻压痛,与周围组织边界欠清晰。泌尿系超声提示:左肾结石伴左肾积水,集合系统分离2.0 cm。全腹部+盆腔MRI平扫及增强结果提示:1.上中腹部未见异常改变。2.盆腔内见团块状混杂T1、T2信号,边界欠清晰,范围大小约10 cm×11.2 cm×9.1 cm,其内可见囊状长T1长T2信号,增强扫描实性部分明显强化,囊性部分未见强化,膀胱充盈欠佳,呈受压改变,膀胱壁不厚,腔内未见异常信号,盆腔未见肿大淋巴结,直肠未见异常强化信号,骨质部分信号未见异常(见下页图1、图2)。血分析,生化指标,肺部CT未见异常。肿瘤标记物:AFP 11.30 ng/mL,轻度增高,CA125、CA199、HE4、CEA结果均正常。我院病理科会诊2011年子宫切除病理玻片结果:1.子宫腺肉瘤,子宫内膜囊性萎缩,子宫内膜息肉,宫颈管浆膜平滑肌瘤,慢性宫颈炎伴纳氏囊肿;2.左右盆腔淋巴结未见肿瘤;3.免疫组化SMA(+,散在少许),desmin(+,大部分),CD10(+,少部分),ER(+,5%),PR(+,5%),CD117(-),DOG1(-),vimentin(+),Ki67(+,热点区约40%)。
于2019年11月11日行经腹探查,术中见盆腔内一大小约12 cm×10 cm×11 cm实质性肿瘤,呈分叶状,占满整个盆腔,质中、活动度差,肿瘤侵犯乙状结肠及直肠上段浆肌层、膀胱底部浆肌层,左侧输尿管盆壁入口处瘢痕狭窄,该段输尿管折叠成角,肠管与侧腹壁粘连,余盆腹腔未见转移病灶,未扪及肿大淋巴结。联合胃肠外科以“卷地毯法”自周边将肿瘤整体切除,包括乙状结肠及直肠上段,并行断端肠吻合。切除膀胱底部病灶,切除输尿管梗阻狭窄段并行双J管植入术,行满意的肿瘤细胞减灭术达R0。术后病检:1.盆腔肿物:子宫腺肉瘤伴肉瘤过度生长,肉瘤成分为高级别梭形细胞肉瘤(图3);2.直肠及部分乙状结肠:肠管切除标本,肠管内壁未见肉瘤;膀胱底部病灶为腺肉瘤伴肉瘤过度生长;3.免疫组化CD10(+,部分),SMA(+,灶性),desmin(-),H-caldesmon(+,小部分),ER(+5%),PR(-),Ki67(+,约70%),MDM2(-),CDK4(-),Myogenin(-),TLE-1(+,大部分强)(图4~图6)。4.SS18基因FISH检查提示:阴性,基因未发生断裂。术后患者恢复好。术后诊断复发性子宫腺肉瘤伴肉瘤过度生长,膀胱直肠累及(FIGO 2015子宫腺肉瘤分期IV期)。术后9 d出院,一月后返我院肿瘤科行综合放化疗,为最大程度控制复发,先行盆腔外照射(40~50 Gy/25~28次),后续给予AIM方案6疗程:多柔比星(75 mg/m2,第1天)/异环磷酰胺(2.5 mg/m2·d,第1~3天),美司钠静脉注射(异环磷酰胺量20%),在异环磷酰胺给药前15 min,给药后4 h和8 h给药,静脉三周疗方案,化疗期间出现重度骨髓抑制,给予对症处理后缓解,目前患者病情稳定,未见复发征象。
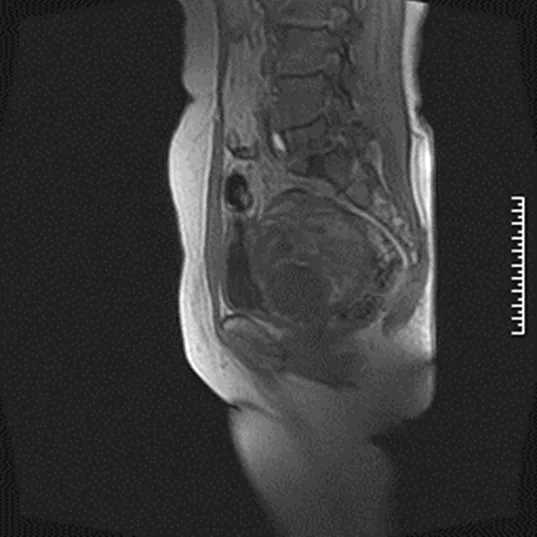
图1 全腹部+盆腔MRI平扫图
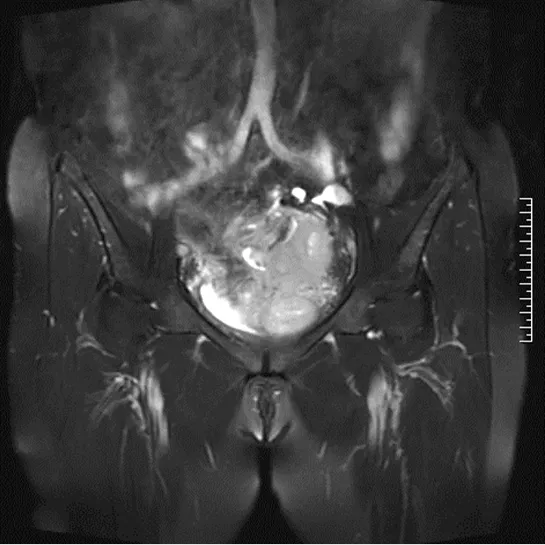
图2 全腹部+盆腔MRI增强图
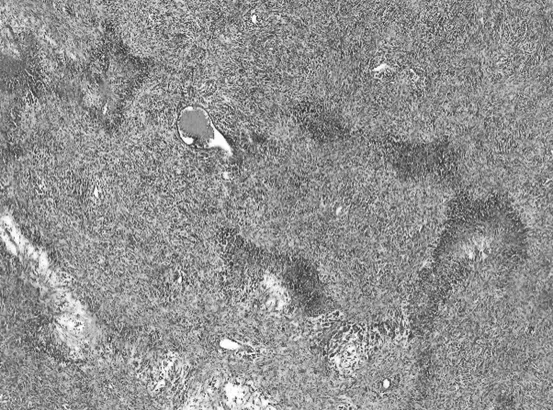
图3 盆腔肿物:肿瘤组织见部分区域呈肉瘤过度生长,肿瘤细胞呈梭形,细胞异型,伴大片坏死,肉瘤成分为高级别梭形细胞肉瘤(HE染色,×40)
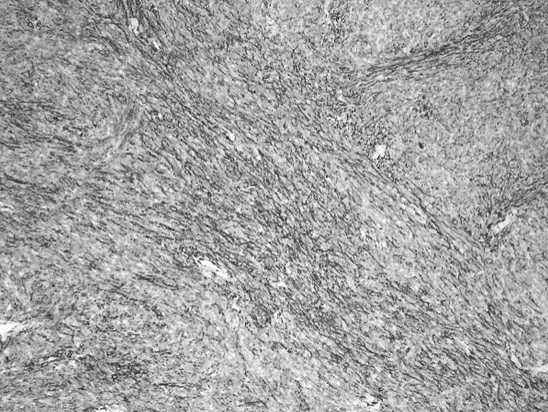
图4 IHC示 H-caldesmon阳性(×100)

图5 IHC示 ER阴性(×100)
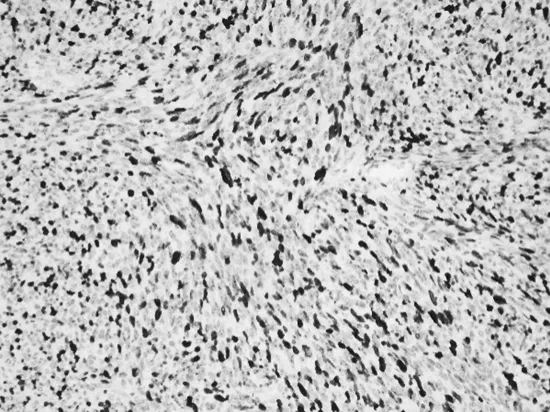
图6 IHC示Ki-67指数约70%(×200)
2 讨论
2.1 概况
子宫MA的发生率占子宫恶性肿瘤的0.2%以下[7],Carroll A等[8]报道的100例子宫腺肉瘤患者平均年龄为54岁(15~84岁),而Goh C等[9]报道100例患者发病平均年龄为48岁(21~87岁)。一般认为其多发于绝经后或围绝经期女性,年轻女性发病率低。但有学者认为种族和基因差异可能导致该病发病率和发病年龄有所不同。腺肉瘤伴肉瘤过度生长的发生率文献报道不一,从8%到65%不等[8]。已明确的是肉瘤过度生长会随着腺肉瘤疾病进展、复发次数和分期增加而增大[10]。有学者提出子宫腺肉瘤可能与子宫内膜异位症和子宫腺肌病关系密切[4],Nannini M等[10]发现其发生常和卵巢外的子宫内膜异位症同时存在,虽然二者的直接因果关系尚待证实,但子宫内膜异位症出血诱发持续性氧化应激及DNA损伤,被认为是潜在的发病原因之一。另有报道认为他莫昔芬的使用[11]、高雌激素血症、盆腔照射史、肥胖及糖尿病[4]也是腺肉瘤发病的高危因素。多篇文献中提及MA患者既往有长期口服避孕药史,提示外源性雌激素的使用也是一个值得关注的诱因[4, 10, 12]。
2.2 诊断
子宫腺肉瘤最常见的临床表现是阴道出血,伴下腹疼痛,阴道流液,以及因子宫增大导致的压迫症状[10],但上述症状均不具有临床特异性,术前易误诊或漏诊。多表现为盆腔肿物(37%)、子宫息肉(22%)和增大的子宫(22%)等形式[12]。多呈广基息肉样肿物发生于子宫内膜层[13](包扩子宫下段),少数发生于宫颈管内膜(5%~10%)以及子宫外部位,约1/4可侵入子宫肌层[5]。但复发可发生于宫颈、卵巢、输卵管、阴道或盆底腹膜等所有部位甚至远处转移[5]。腺肉瘤外观为息肉样肿瘤占据宫腔致宫腔膨大,最大径线约5~6 cm(1~20 cm不等)[14]。伴肉瘤过度生长时体积可能更大,外观为鱼肉状,出血,切面有坏死灶,更易侵犯肌层。发生于宫体外的肿瘤多见于青少年和年轻女性[13]。大部分子宫腺肉瘤在超声下的表现为实性或囊性、或混合囊实性,呈现为低、中回声图像,而在宫体外的腺肉瘤常为囊性高回声。此外,3D超声的敏感性和特异性均优于2D超声[4]。与超声相比,MRI提供的术前诊断和临床分期更为准确,宫体腺肉瘤在MRI下常表现为子宫增大和子宫正常肌层变薄,巨大的息肉状肿物突向宫腔,肿物信号强度混杂,因此易与妊娠滋养细胞疾病相混淆。在T2权重图像中,高信号强度的小病灶散布于肿块中,指向腺上皮或肿瘤坏死灶。在应用钆增强MRI之后,实性成分信号强度增强至接近于子宫肌层。MASO可能会伴有深肌层侵犯和局灶出血坏死,在扩散加权成像的b值往往表现出低信号强度表现[15]。不过,腺肉瘤的确诊必须依靠术后病理检查,并且要尽可能全面地对标本进行取材,来确定肉瘤成分的位置及与其他上皮-间叶肿瘤鉴别[12]。
2.3 病理特征
病理形态上,MA由良性上皮成分和恶性间质成分组成,是一种双相性肿瘤[16]。腺体良性或异型,间质细胞丰富,有异型性和腺体周围密集性。与腺纤维瘤的鉴别主要是,腺肉瘤腺体周围的“袖套样”富细胞性间质结构。其间质成分的同源性形态变化包括子宫内膜间质样(核分裂大于2/10 HPFs)、纤维肉瘤样、平滑肌(梭形或上皮样)、性索样分化,常可见泡沫细胞、破骨样巨细胞。在10%~15%的病例中可发现异源性间叶成分,异源性分化常包括横纹肌(最多见)、脂肪、软骨[5]。此外,镜下可存在水肿、出血、炎症和黏液样改变的病灶[12]。腺肉瘤伴肉瘤过度生长时,其肉瘤成分发生细胞异型性和核分裂更明显,约1/4伴有异源性成分[5],肉瘤过度生长和异源性分化是 MA的重要不良预后因素[1]。任何高级别成分在腺肉瘤中的存在都应该被关注,因其与预后密切相关。
免疫组化中,ER、PR染色常位于上皮成分,CD10染色多位于间质成分。高级别肉瘤成分中,ER、PR和CD10的阳性表达率较低级别肉瘤低,Ki67阳性细胞明显多于低级别肉瘤[17]。与常见腺肉瘤相比,在伴随肉瘤过度生长的腺肉瘤会表达更强的细胞增殖相关标志物,如Ki67和p53,ER、PR、CD10可能都为阴性[18]。而细胞分化相关标志物如CD10和PR则在常见腺肉瘤中表达更高。故肿瘤成分中ER、PR阳性染色率越低,存在肉瘤过度生长的可能性越大[10]。有研究提示同为I期的患者中,Ki67≥30%的预后比Ki67<20%的预后要差[4]。
分子水平上,在72%伴随肉瘤过度生长的病例中存在PIK3CA/AKT/PTEN通路改变,并且基因拷贝数的变异数量显著增加,尤其以CDK4和MDM2基因扩增的频率最高[17]。CDK4和MDM2是参与细胞周期调控和进展的癌基因,与许多癌症相关。Lee J C等[19]利用二代测序平台,检测到在染色体12q13-15中,CDK4和MDM2两个位点的同时增加是最常见的拷贝数变异,且二者的扩增仅限于间质成分,这与腺肉瘤中的腺体成分为非肿瘤性的定义是一致的。另外,据Hodgson A等[20]报道,在78%的高级别腺肉瘤病例的测序显示,TP53通路存在频繁异常,免疫组化表达P53与突变状态高度相关,提示高级别腺肉瘤可能是分子遗传学上一个独特的子集,P53免疫组化可用于确认高级别成分的存在。
2.4 治疗
腺肉瘤的治疗首选手术治疗,一般行经腹全子宫+双附件切除(TAH+BSO)(FIGOⅠ期)和肿瘤细胞减灭术(FIGOⅡ~Ⅳ期),不推荐行腹腔镜手术,避免可能导致的肿瘤盆腹腔转移[3],建议完整取出子宫,避免碎粉组织导致播散转移。然而,对于绝经前的女性,行TAH+BSO会导致生育能力缺失、性功能下降、盆腔疼痛、抑郁焦虑等更年期症状[21]。有学者提出,对于年轻、有生育要求的女性患者,仅在IA期且无深肌层浸润、肉瘤过度生长等危险因素,可仅行病灶切除术,但术后要密切随访,定期复查,当完成生育要求后,再行全子宫及双附件切除[16]。另外,也有学者提出可对绝经前女性进行保留卵巢的手术,因为腺肉瘤的卵巢转移概率非常低[21]。目前不推荐对腺肉瘤患者进行淋巴结清扫术,因为腺肉瘤的淋巴结转移概率仅为0~6.5%,仅在有证据表明存在淋巴结转移时再进行[22]。Carroll A等[8]研究显示,淋巴结清扫术对患者的无进展生存期和总生存期并没有影响。
除了手术治疗外,目前尚未确定系统性辅助治疗方案,因此广大学者对化疗、放疗以及激素治疗等辅助治疗的作用进行了讨论。《FIGO 2018癌症报告》子宫肉瘤诊治指南提出,对于低度恶性潜能的腺肉瘤,不需要进行辅助治疗[23]。Tanner EJ等[22]于2013年提出,阿霉素和异环磷酰胺可能对腺肉瘤及腺肉瘤伴肉瘤过度生长的患者有效。Margherita Nannini等[10]在2018年的单中心实验证实了MA及MASO对表阿霉素和异环磷酰胺的敏感性。放疗对于腺肉瘤患者的治疗价值同样存在争议。2017年,Tanner等[22]认为,鉴于低级别腺肉瘤患者复发率不高(7%),所以对于此类患者不推荐进行盆腔外照射。NCCN专家组在《软组织肉瘤临床实践指南》中提出对于腹膜后肉瘤的治疗,强调可手术切除、可达到足够阴性手术切缘的患者,不可用放疗替代手术;不推荐常规对腹膜后和腹腔内肉瘤术后补充外照射治疗[24]。仅术前未接受放疗者发生局部复发时,可考虑应用外照射治疗。激素治疗的疗效目前可以作为参考的资料较少。一方面,ER、PR受体阳性表达在伴随肉瘤过度生长的肿瘤中较少,限制了激素治疗的应用;另一方面,目前的文献中,接受激素治疗的多为全身系统化疗失败的患者,因此激素治疗的疗效较差也有病例选择的偏倚[22]。分子靶向治疗药物、PD-1等免疫治疗药物研究用于子宫肉瘤并未显著获益[25]。
目前尚无标准的治疗方法来控制复发转移。有学者认为,由于无术后肿瘤残留患者可随访,因此复发腺肉瘤按照低级别子宫内膜间质肿瘤处理[14]。Manoharan M等[26]提出对免疫组化结果提示有高复发风险的患者进行异环磷酰胺+顺铂化疗和盆腔外照射。Nathenson MJ等[27]提出,对于复发性或转移性肿瘤,除了进行病灶切除外,阿霉素/异环磷酰胺和吉西他滨/多西他赛化疗方案可能是最敏感的。
Carroll A等[8]回顾性研究认为辅助治疗对于FIGOⅠ期且伴有肉瘤过度生长的患者并不能够延迟复发。Yuan Z等[28]报道了1例腺肉瘤伴肉瘤过度生长复发并远处转移患者,放化疗等辅助治疗并没有提高总体生存率,但他们也指出可能是由于入选的患者往往具有更多危险因素,从而预后更差。故放化疗和激素治疗对腺肉瘤的影响,还需要更多的研究。
2.5 预后
与腺肉瘤预后有关的因素包括:年龄、深肌层浸润、肉瘤过度生长、淋巴血管间隙浸润、淋巴结转移[4]、异源性分化、临床分期[16]、肿瘤坏死[29]。诊断的年龄每提高一岁,复发的风险就上升2%[8]。深肌层浸润和异源性分化是不能单独评估预后的,因为它们常伴随有肉瘤过度生长,不伴随肉瘤过度生长的患者,两年无进展生存期和总生存期均为100%,而伴随肉瘤过度生长的患者,则降至20%[22]。
通常认为子宫腺肉瘤是一种惰性的肿瘤,远处转移率较低,但复发率高达26%~30%,即使分期较早,复发率也非常高[29],因此需长期随访。20%~25%的患者会因肿瘤复发导致并发症死亡[15],伴有肉瘤过度生长的腺肉瘤,复发率常达70%,其中血运转移占40%,60%的患者会因肿瘤侵袭而死亡[30]。
2.6 病例分析
本文报道了1例复发性子宫腺肉瘤并伴肉瘤过度生长的病例,回顾分析如下:① 由于子宫腺肉瘤无特异性临床症状和体征,无敏感肿瘤标志物,影像学诊断特异性不高,术前难以诊断,故需重视绝经后继续增大及快速增大、影像学血供丰富的的宫体肿瘤,尽量采取经腹手术,完整取出组织,术中剖视,避免碎粉导致播散种植。② 强调病理标本的全面取材并病理科专家会诊。肌层侵犯及肉瘤过度生长是腺肉瘤重要预后不良因素,应术后严格随访。③ 经腹子宫及双附件切除术为标准治疗方案(FIGOⅠ期),FIGOⅡ-Ⅳ期行肿瘤细胞减灭术,不推荐行腹腔镜手术,不推荐行淋巴结清扫。无肿瘤残留者术后可观察。④ 参照低级别子宫内膜间质肿瘤处理。2020年NCCN《子宫肿瘤临床实践指南》对于子宫肉瘤复发的治疗建议,认为排除了远处转移的阴道和盆腔局部复发、且既往未接受放疗的患者的选择有:① 手术探查+病灶切除±术中放疗(3级证据)及考虑术前外照射±全身治疗;② 外照射放疗±阴道近距离放疗±全身治疗[25]。本例患者腺肉瘤复发并肉瘤过度生长,侵犯膀胱及直肠,恶性肿瘤晚期并肌层侵犯,预后极差,故术后采用阿霉素和异环磷酰胺联合化疗可能有临床获益。盆腔外照射放疗也可能控制其复发,但考虑到ER、PR阳性率较低,故激素治疗的疗效可能有限。对此类患者,指南均推荐参考临床实验,并个体化治疗。靶向药物及免疫治疗药物的应用参考分子诊断指标,在必要时使用,以控制复发,提高生存率。
