高通量测序技术在水生态污染监测中的应用
2021-02-27李继影
景 明, 陈 瑜, 高 昕, 李继影
(江苏省苏州环境监测中心,江苏苏州215000)
0 引 言
张家港位于江苏省苏州市,区域范围内水系发达,随着区域经济发展,人类活动一定程度上影响了河道水质。本研究主要针对张家港某生态污染河道河水呈赤红色,经显微镜初步鉴定发现该现象是由微生物爆发导致的生态污染事件。微生物是指示水生态环境变化的敏感指标[1]。目前,微生物分类主要依靠光学根据细胞的形态结构特征确定其种类[2]。但显微镜检测适用于鉴定细胞体积较大,具有显著形态学的大型细胞,对于部分个体较小的细胞无法有效鉴定[3]。
随着基因测序技术不断地发展与普及,大数据分析能力不断提高,基因组研究手段正越来越多地应用于鉴定形态学难以辨别的物种[4]。原核生物和真核生物的基因组都含有保守区和可变区,其中可变区能够区分物种之间的差异,适用于进行测序和分类鉴定,是研究环境样品中微生物物种群落的重要手段。目前高通量测序技术已经广泛应用于研究蓝藻水华的形成及其爆发原因的机理。本研究通过Illumina 测序对该河道的原核生物及真核生物分别进行测序,分析其群落结构及成因。
1 材料与方法
1.1 样品采集及前处理
本次采样地点为张家港污染河道(坐标为120°38′15.43E,31°48′32.11N),采样时间2019-12-23,每个采样点使用垂直采样器在水面下0.5 m处收集5 L水样,储存在塑料瓶内,置于4 ℃冷藏箱后运回实验室,在24 h内完成水样中微生物的富集。采用标准方法[5]测定以下常规水质指标:叶绿素a、氨氮、总磷、总氮、化学需氧量、色度和pH。
样品浓缩采用膜过滤法,将样品通过醋酸纤维素滤膜(孔径0.45 μm、直径50 mm),用PBS(0.01 mol/L)对滤膜进行洗脱。然后将洗脱液进行高速离心浓缩(14 000 r/min,10 min),最后去掉上层清液,用1 mL PBS进行洗脱,然后进行DNA提取。
1.2 DNA提取及高通量测序
DNA提取采用CTAB[6]法标准化操作流程,然后采用琼脂糖凝胶电泳进行DNA 浓度和纯度检测。最后取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL作为基因组DNA 模板。根据待测序区域的选择,使用带Barcode 的特异引物(New England Biolabs 公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer)和高效高保真酶进行PCR,确保扩增效率和准确性。本研究选择针对原核生物16S rRNA基因中高度变化的V4 区域[7]以及真核生物18S rRNA的V4 区域[8]的引物作为扩增子,详见表1。PCR的反应条件为:95 ℃5 min,94 ℃60 s,57 ℃45 s,72 ℃60 s,共34 个循环,最后72 ℃ 终延伸10 min,16 ℃5 min。PCR产物通过2%的琼脂凝胶电泳检测。根据PCR产物的浓度对样品进行等量混合,然后使用1 ×TAE 浓度2%的琼脂糖胶电泳对PCR 产物进行纯化,将剪切得到的目标条带使用试剂盒回收产物,试剂盒为Thermo Scientific 公司GeneJET 胶回收试剂盒。
使用建库试剂盒(Ion Plus Fragment Library Kit 48 rxns,Thermofisher)进行文库的构建,构建好的文库经过Qubit 定量和文库检测合格后,进行上机测序(Ion S5TMXL,Thermofisher)。

表1 本研究PCR扩增引物引物序列
1.3 数据分析
使用Cutadapt[9]先对原始数据的reads 进行低质量部分剪切,去掉干扰数据,再根据Barcode 从处理后的数据中拆分出各样品数据,然后进行去除嵌合体序列处理,即对截去Barcode 和引物序列初步质控得到原始数据Reads 序列[10]通过与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列[11],得到最终的有效数据(Clean Reads)。
用Uparse 软件[12]对样品进行聚类分析,以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),选取OTUs 中出现频数最高的序列作为OTUs的代表序列。对OTUs序列进行物种注释,用RDP Classifier 方法与Silva132 数据库进行物种注释分析(设定阈值为0.6 ~1.0)。使用MUSCLE 软件进行快速多序列比对,得到所有OTUs 序列的系统发生关系。最后,以样品中数据量最少为标准对测序数据进行均一化处理,后续的Alpha 多样性分析和Beta多样性分析都是基于均一化处理后的数据。
2 结果与分析
2.1 测序数据分析及多样性指数
本次扩增的第1 轮PCR扩增产物如图1 所示,所扩增的基因片段条带单一,长度分别约为300 bp 及350 bp,真核生物的生物量显著高于原核生物。
图1 扩增产物电泳图
测序共获得16S rRNA 基因V4 可变区的88 968条原始序列,通过数据筛选后共得到80 148 个高质量序列;18S rRNA 基因V4 可变区的88 510 条原始序列,通过数据筛选后,共得到87 841 个高质量序列。
将序列进行随机抽样,并通过对所抽到的序列数和代表的OTU数来构建稀释性曲线,如图2 所示。由图可知,原核生物得到的注释为548 种OTU,真核生物得到的注释为33 种,两个样品的稀释曲线趋于平坦,说明原核生物与真核生物的测序结果都较为完整,原核生物的物种分布较为均匀种群组成较为丰富;真核生物的种群组成比较单一。
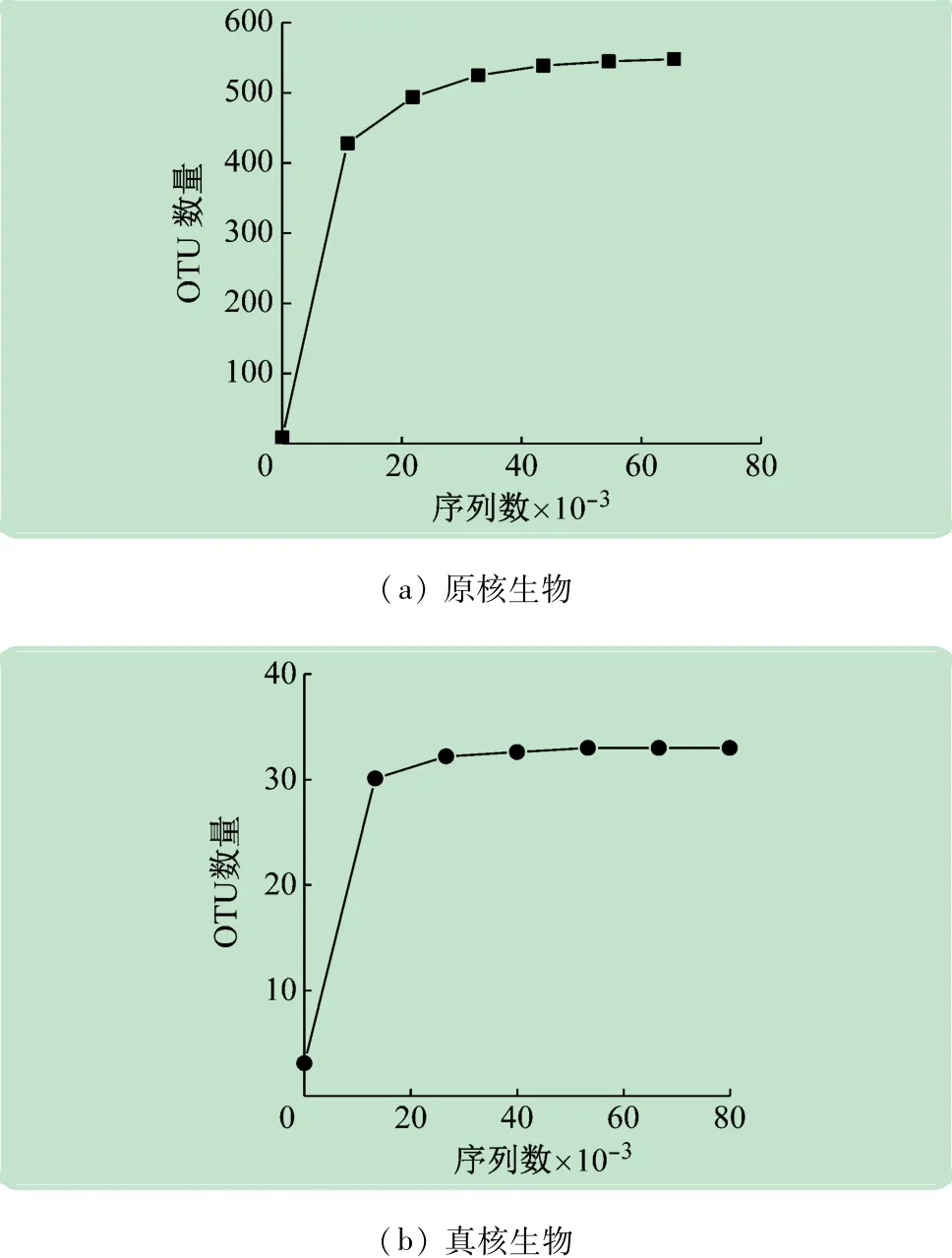
图2 OTUs稀释曲线
对不同样本在97%一致性阈值下的Alpha Diversity 分析指数进行统计,结果见表2(均一化时选取的数据量:cutoff =65 446(原核生物);cutoff =79 939(真核生物))。Shannon-Wiener指数和Simpson指数表示个体分布的均匀度,各物种之间个体分布越均匀,指数越高,如果每一个体都属于不同的物种,指数则达到极值,由表可知真核生物的物种组成比原核生物单一。

表2 Alpha Indices 统计表
2.2 原核生物的多样性和群落结构分析
对样品中的原核生物OTUs 进行注释后发现,本次样品原核生物多样性丰富,涵盖了22 门74 种。其中,变形菌门(Proteobacteria)21 种,占54.5%;拟杆菌门(Bacteroidetes)24 种,占15.77%;放线菌门(Actinobacteria)1 种,占12.37%:厚壁菌门(Firmicutes)15 种,占8.19%,如图3 所示。原核生物OTUs前6 的属占总测序量的百分比见表3,6 个属OTUs总百分比仅为32.18%,表明原核生物种类分布较为均匀。

图3 原核生物门水平上的物种相对丰度饼状图

表3 原核生物主要物种注释(前6 种)
2.3 真核生物的多样性和群落结构分析
对所得到真核生物的OTUs序列进行物种注释后发现,本次采集的样品中真核生物种类比较单一,共发现4 个门12 种,其中金藻门(Chrysophyta)占93.95%,如图4 所示,样品中核心OTU 是Pedospumella encystans占93.94%,3 种微生物占真核生物的95%以上(见表4)。
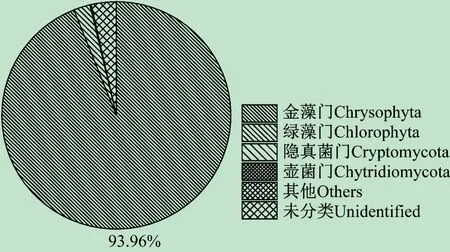
图4 真核生物门水平上的物种相对丰度饼状图

表4 真核生物主要物种注释(前3 种)
显微镜观察结果如图5 所示,藻体呈棒状及螺旋状,游动速度较快。且棒状藻体中含5 ~10 个颗粒状色素体。几乎所有的可见细胞均为该微生物,细胞颜色为紫红色,水体中大量出现,导致河道水面呈现为紫红色,形态学鉴定无法准确判断该微生物种类。
根据高通量测序结果中真核生物和原核生物生物量以及物种丰度的区别,导致本次河道生态污染的微生物为Pedospumella encystans。筛选真核生物中特别关注的物种(相对丰度前10 的种)进行物种分类树统计,进行展示,其物种分类树如图6 所示。

图5 显微镜观察结果

图6 样本中特定物种分类树
3 讨 论
3.1 高通量测序技术的应用
该河道微生物的优势种个体较小,通过显微镜难以准确判断其类别,而高通量测序技术具有能够检测数量较少、体积微小且不宜培养的微生物的能力[13],用于检测环境样品中微生物群落结构的生物多样性[4]。目前江苏省浮游藻类监测主要建立在形态学鉴定的基础上,本研究采用高通量测序技术对河道原核生物及真核生物的群落组成进行研究,同时结合形态学检测结果,发现引起本次河道生态污染的微生物为一种体积较小,难以通过传统显微镜鉴定种类的真核浮游藻类。高通量测序技术可以弥补显微镜观察中难以判断的物种信息,从而提高了浮游藻类监测的综合能力[14]。
3.2 水环境因子对生物群落结构的影响
本研究中,河道的水质参数如表5 所示。由表5可知,该河道水体属于劣5 类水体,相比其他指标化学需氧量浓度较低(5 类水40 mg/L),氨氮(5 类水2.0 mg/L)与总磷(5 类水0.4 mg/L)浓度较高,均超过5类水要求5 倍以上,可生化性较差(可生化处理的水质推荐的碳氮比为100∶5,该河道碳氮比为1∶1,推测有工业废水排入),对活性微生物繁殖造成影响,致使水体的自净能力得到影响,当有少数微生物能够适应该水质条件时,该微生物易成为优势种。
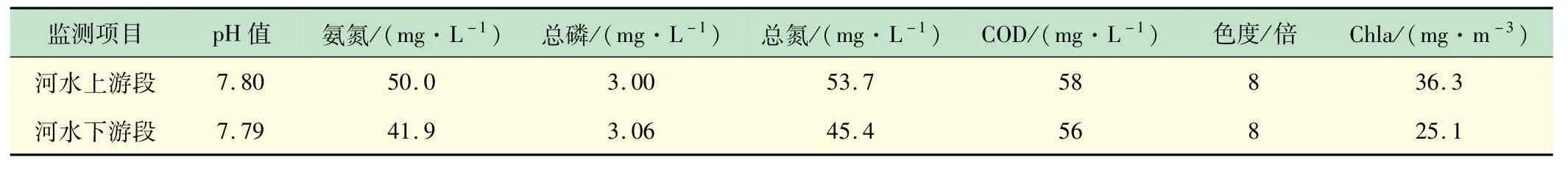
表5 该河道水质理化指标
3.3 优势种Pedospumella encystans
金藻是生态学和生态生理学的原生模式种,一部分种类是水体中的初级生产力,另一部分是水体中部分细菌的捕食者,通常最佳生长条件为温度较低,透明度较好且有机物含量较低的水体[15],在初春、晚秋或冬季多有发现,多数存活于水体的中下层,有研究表明在冰面下某些金藻种类仍能存活[16]。
近几年,系统发育树和大系统分类学显示了金藻门所包含种类的复杂性,许多种类为光合自养和异养生物之间的过渡[17],其中异养型金藻与自养型金藻相比,具有较小的基因组和细胞体积,相对表面积较大,能够高效利用环境中的营养盐且所需代谢时间短于其它藻类。Pedospumella encystans 属于金藻纲(Chrysophyceae),色金藻目(Chromulinales),Chromulinales科,Pedospumella 属,属于一种异养型微型浮游藻类[15],细胞无细胞壁,仅含有一条鞭毛,Pedospumella encystans在中国发现较少,在已有研究中有报道,当水质的可生化性较差时,自养型微生物难以生存的条件下该种类易成为优势种[18]。
4 结 论
本研究结果表明,运用高通量测序技术结合形态学鉴定能够揭示水环境中微生物的多样性及群落组成,得到更客观、更准确的监测结果,在水生态监测和水质评价方面具有较好的应用潜力。
(1)对张家港生态污染河道进行形态学鉴定,群落组成单一,可见的微生物基本为同一种类。
(2)用高通量测序技术对18S rRNA 基因V4 区测序,结果显示数量较多且群落组成单一,Pedospumella encystans 占93.94%。用高通量测序技术对16S rRNA 基因V4 区测序,结果显示数量相对较少且群落分布较为均匀,由此得出主要的微生物为Pedospumella encystans。
(3)对该河道水质进行分析,推测该河道有工业废水混入,可生化性较差,同时冬季河道水质不利于常规藻类生长,使得Pedospumella encystans 成为优势种,导致了本次河道生态污染事件。
