miR-93在肿瘤发生发展中的作用机制
2021-02-27祝永月李翠香李秦瑞沈体静蒋自文李东旭殷德福李高峰梅加林
张 兵,祝永月,林 涛,陈 磊,李翠香,李秦瑞,沈体静,蒋自文,何 乔,李东旭,赵 斌,殷德福,李高峰,梅加林
miRNAs是长度为20~25个核苷酸的非编码RNA,通过抑制mRNA翻译和诱导mRNA降解而调节靶基因的表达,人类大约30%的基因受miRNAs调节。研究发现,大量miRNAs在肿瘤中表达失调,发挥癌基因或抑癌基因的作用,参与调节肿瘤细胞的生长和转移等过程。miR-93是miR-106b-93-25簇的成员,定位于7q22.1微小染色体维持复合蛋白(Minichromosome Maintenance Complex Component 7,MCM7)基因的第13号内含子中,其在多种肿瘤中表达升高,发挥癌基因作用。本文将综述miR-93在肿瘤发生发展中的作用机制以及临床应用方面的研究进展。
1 miR-93参与调控肿瘤细胞增殖和凋亡
miR-93通过调节特定靶基因调控肿瘤细胞增殖、分化和凋亡,广泛参与肿瘤发生、发展等多种生物学过程。miR-93在胃癌组织中的表达量显著升高,发挥促进增殖和抑制凋亡的作用。Guan等[1]使用荧光素酶报告基因和蛋白免疫印迹分析验证了miR-93在胃癌中表达上调,发现miR-93通过靶向TIMP2促进胃癌的增殖和转移并诱导胃癌细胞上皮-间质转化(Epithelial-Mesenchymal Transition,EMT)。miR-106b-93-25簇在50%以上胃癌中表达增高,其中miR-93和miR-106b与转录因子E2F1存在反馈调节。高表达的miR-106b-93-25簇通过抑制靶基因周期素依赖性蛋白激酶抑制因子1A(Cyclin-Dependent Kinase Inhibitor 1A,CDKN1A/p21)和BCL2样蛋白11(BCL2-like 11,BCL2L11/BIM),阻断转化生长因子(Transforming Growth Factor,TGF)信号通路,最终促进胃癌的发生。反之,降低miR-106b-93-25簇的表达,则可以抑制胃癌细胞的增殖和细胞贴壁能力[2]。PI3K/AKT信号传导途径的改变在调控细胞增殖、凋亡以及迁移等过程中发挥重要作用[3]。研究发现miR-93过表达与PI3K/AKT信号通路激活相关。PTEN、CDKN1A是miR-93的靶基因。Yuan等[4]发现miR-93高表达与肿瘤大小、TNM分期及淋巴结转移相关,体外功能学实验表明高表达miR-93可通过靶向调控p21、PTEN表达显著促进胃癌细胞增殖、侵袭及迁移能力。Katsuya等[5]通过PCR检测,证实了晚期肝细胞癌(Hepatocellular Carcinoma,HCC)患者中miR-93表达水平升高与预后不良有显著相关性。通过生物信息学分析揭示了miR-93通过靶向抑制PTEN和CDKN1A表达,进而激活c-Met/PI3K/AKT信号通路刺激细胞增殖、迁移和侵袭、抑制细胞凋亡。此外,在肺癌细胞中,Li[6]等发现抑癌基因LKB1也是miR-93的靶基因。进一步研究发现miR-93通过靶向抑制LKB1、PTEN、CDKN1A表达进而激活PI3K/AKT信号通路促进肿瘤细胞增殖、转移和侵袭。Li等[7]发现在乳腺癌中miR-106b和miR-93通过PTEN/PI3K/AKT信号通路的调控促进体内细胞的迁移和增殖。在神经胶质瘤中,miR-93通过靶向结合PTEN、PHLPP2和FOXO3的3′-UTR从而抑制其表达,进而激活PI3K/AKT信号通路,最终增强细胞克隆增殖以及迁移等能力[8-9]。高迁移率蛋白A2(High Mobility Group A2,HMGA2)是一类DNA非组蛋白,在细胞的增殖、分化、凋亡中扮演重要角色,研究发现HMGA2在多种肿瘤中表达异常,发挥癌基因作用。miR-93在胰腺癌中通过靶向调节致癌基因HMGA2发挥抑癌作用。研究发现RUNX1通过直接与miR-93启动子中的DNA结合位点相互作用而对miR-93进行负调控,最终导致miR-93在胰腺癌组织中表达下调,miR-93过表达或敲除HMGA2均可降低胰腺癌的侵袭性[10]。在肾细胞癌中,miR-93通过靶向抑制RUNX3的表达,进而激活依赖Smad的TGF信号通路,最终抑制细胞凋亡,促进细胞增殖、入侵和迁移[11]。Yeung等[12]通过比较人T细胞白血病病毒1(Human T-Lymphotropic Virus 1,HTLV-1)转化的T细胞和外周血单核细胞的miRNA表达谱,发现miR-93表达上调。功能实验揭示miR-93通过抑制靶基因肿瘤蛋白53诱导的核蛋白1(Tumor Protein p53 Inducible Nuclear Protein 1,TP53INP1),而最终抑制细胞的凋亡。Singh等[13]通过用17-雌二醇处理的大鼠乳腺组织和人乳腺癌细胞系中发现miR-93表达升高,核因子E2相关因子2(Nuclear Factor Erythroid 2-Related Factor 2,NRF2)表达降低,而维生素C可以逆转17-雌二醇对miR-93的诱导作用,以及miR-93对NRF2的抑制作用。
此外,研究发现miR-93是抑癌基因失活的重要机制。定位于3p21的抑癌基因融合肉瘤蛋白(Fused in Sarcoma,FUS1)在肺癌中表达降低。研究发现FUS1的低表达受miR-93的调控,同时在非小细胞肺癌组织标本中,miR-93的表达与FUS1的表达呈负相关[14]。肝细胞癌中miR-93通过直接抑制靶基因PTEN和CDKN1A表达,激活c-Met/PI3K/AKT通路,发挥促进增殖和抑制凋亡作用。鼻咽癌中,miR-93可以直接抑制靶基因TGF-R2的表达,进而激活依赖Smad的TGF信号通路和PI3K/AKT信号通路,最终促进鼻咽癌细胞增殖、浸润和转移等恶性表型。DAB2是近年来鉴定的肿瘤抑制基因,在多种肿瘤中表达下调。Du等[15]发现在肺癌中,DAB2的低表达与患者的不良预后相关,而细胞中过表达DAB2可以有效抑制肺癌细胞增殖。研究发现miR-93通过直接结合DAB2 mRNA的3′-UTR进而抑制DAB2的表达,是DAB2失活的重要机制。
综上所述,miR-93在大多数肿瘤中表达升高并通过调节CDKN1A、BIM、LKB1、TGFBR2、ITGB8、TP53INP1、TGF-R2和DAB2等靶基因的表达发挥促增殖和抗凋亡的功能。高表达miR-93可以抑制结肠癌干细胞的增殖和克隆形成能力[16],发挥类似抑癌基因的功能,因此揭示miR-93在不同肿瘤背景中的不同作用机制将是未来研究的重点。
2 miR-93促进肿瘤细胞转移
miR-93除了可增加肿瘤细胞的生存能力外,也发挥促进肿瘤转移和血管生成的作用。高表达miR-93的脑胶质瘤细胞(U87细胞系)与内皮细胞共培养,可以促进内皮细胞的迁徙、生长、转移和血管形成。研究发现,miR-93促进肿瘤生长和刺激血管形成的作用与其抑制integrin-8的表达有关[17]。Fabbri等[18]报道,miR-93通过抑制靶基因IL-8和VEGF的表达,进而调节参与神经胶质瘤的血管生成细胞因子、趋化因子和生长因子的分泌。
miR-93在乳腺癌细胞系中高表达,其通过抑制靶基因巨大肿瘤抑制基因同源物2(The Large Tumor Suppressor,Homology 2,LATS2),发挥促进血管的生成和肿瘤细胞肺转移的作用[19]。在肺癌细胞系H1299中,过表达miR-93可以抑制靶基因F-box和WD重复结构域蛋白11(F-Box and WD Repeat Domain Containing 11,FBXW11)的表达,进而上调Snail家族锌指蛋白1(Snail Family Zinc Finger 1,SZF1),最终诱导上皮-间质转化的发生,并促进肺癌细胞的迁移和血管生成[20]。TGF在肿瘤发生发展过程中具有促进和抑制两方面的功能,而转移调节因子SIX同源异型盒1(SIX homeobox 1,SIX1)基因在TGF功能决定中起到分子开关的作用。研究发现SIX1通过增加miR-106b-93-25簇的表达,可诱导上皮-间质转化和肿瘤发生。而miR-106b-93-25簇不仅可以通过调控靶基因p21和Bim,降低TGF介导的生长抑制作用,而且还可通过调节靶基因SMAD家族成员7(SMAD Family Member 7,Smad7),增加TGF受体的表达量,最终激活TGF通路。虽然截至目前,我们对miR-93促进肿瘤转移的分子机制有了一定的认识,但考虑到不同肿瘤间组织和细胞类型具有较大的差异,因此阐释miR-93在肿瘤转移中的作用机制仍是未来研究的重点。此外,由于miR-93的促增殖和促转移作用,以miR-93为靶点的抗肿瘤治疗研究也将是未来研究的趋势。
3 miR-93在肿瘤临床治疗中的应用
miR-93在弥漫大B细胞淋巴瘤、食管癌、喉鳞癌、宫颈癌和肾细胞癌等多种肿瘤中表达升高[21-24]。Pineau等[25]发现肝脏经肝硬化发展为肝癌的过程中,miR-93表达逐渐升高。在宫颈癌中,miR-93的表达与宫颈癌淋巴结转移和肿瘤浸润程度显著相关[26]。在胃癌组织中,miR-93的高表达与临床分期、浸润程度和淋巴结转移相关,同时高表达miR-93的患者,其术后总生存期和无疾病生存期较低表达者短[27-28]。同时,研究发现miR-93也是非小细胞肺癌早期诊断的生物标志物[29]。然而,与大多数肿瘤中的miR-93表达不同,其在结肠癌中低表达,并且其低表达与肿瘤分期、淋巴结转移、远处转移和不良预后相关。多因素分析进一步显示,结肠癌中miR-93的低表达是临床分期、阳性淋巴结转移和远处转移的独立预测因子[30]。Xu等[12]通过研究发现,肝癌组织中miR-93呈高表达,在对其表达进行抑制后,HepG2细胞的增殖能力明显下降,而且克隆增殖以及迁移等能力也受到较大影响,从而判断抑制miR-93的药物可用于肝癌治疗。miR-93的表达水平可作为预测经化疗后的食管癌3年生存率的有效生物标志物[9]。
此外,研究发现根据血浆中miR-93、miR-409-3p和miR-7的表达水平,可区分正常人与结直肠癌患者;根据血浆中包括miR-93在内的6个miRNAs的表达情况,可以区分急性髓样白血病患者与正常人,提示其有可能成为结直肠癌和急性髓样白血病的诊断标志物[31-33]。同时研究发现在卵巢癌患者血清中miR-93的表达显著升高,而miR-93在高表达CA125的患者血清中的表达水平要显著低于CA125低表达的患者[34]。Espinosa-Parrilla等[35]研究发现miR-106b-93-25簇的两个SNP与贲门胃癌的发病相关。综上所述,miR-93无论在预后判断还是早期诊断方面都有较大的应用前景,但尚缺乏大样本和多中心的系统研究。
4 miR-93与肿瘤耐药性的关系
大量研究发现在肿瘤药物耐受的细胞中,miR-93表达升高,而体外过表达miR-93也可诱导肿瘤细胞产生耐药性;同时抗肿瘤药物可以降低肿瘤细胞中miR-93的表达量,进而抑制细胞的增殖或诱导其凋亡,这些均表明miR-93在肿瘤产生耐药性的过程中发挥重要作用。
表没食子儿茶素(Epigallocatechin,EGC)和表没食子儿茶素-3-没食子酸酯(Epigallocatechin Gallate,EGCG)是两种具有抗肿瘤活性的化合物,体外研究发现两种化合物均可以下调miR-93的表达并诱导神经母细胞瘤细胞系SH-SY5Y和SK-N-DZ发生凋亡。而过表达miR-93则会降低两种化合物的抗肿瘤活性[36]。抗肿瘤活性化合物4-羟苯基维甲酰胺(4-Hydroxy(Phenyl)Retinamide,4-HPR)和EGCG联合使用,可以降低神经母细胞瘤细胞系SK-N-BE2和IMR-32中miR-93的表达量,过表达miR-93则增加肿瘤细胞的耐药性[37]。在顺铂耐药的卵巢癌细胞中,miR-93高表达,miR-93通过直接调节靶基因同源性磷酸酶张力蛋白(Phosphatase and Tensin Homolog,PTEN),进而调节蛋白激酶B(Protein Kinase B,PKB)/AKT信号通路来调节耐药性的产生[38]。此外,顺铂通过下调miR-93来降低CDKN2A的表达进一步有效抑制肺腺癌细胞的增殖[39]。Katsuya等[5]通过抑制miR-93的表达,可以显著改善肝癌细胞对5-Fu、CDDP、索拉非尼和Tivantinib的药物敏感性。Zhou等[40]发现用5-Fu和奥沙利铂处理结肠癌细胞系HCT-8和HCT-116后,miR-93的表达下降。Jing等[41]发现,在膀胱癌中降低miR-93表达能增强膀胱癌化疗的敏感性,其作用机制可能是抑制miR-93的生物学作用上调抗肿瘤基因LASS2表达,进而增强化疗敏感性,推测miR-93可以作为治疗膀胱癌的新的治疗靶点。替莫唑胺(Temozolomide,TMZ)是一种常用的治疗胶质瘤的化疗药物。Chen等[42]研究发现下调miR-93的表达能增强U87细胞对TMZ的化学敏感性。但是潜在的分子机制尚未明确,推测miR-93可能直接作用于靶基因P21从而介导胶质瘤细胞对TMZ的化学耐药作用。如上所述,miR-93与抗肿瘤药物的耐药性产生密切相关。
5 小结与展望
综上所述,我们已经认识到miR-93在多数肿瘤中表达升高,并通过调节靶基因参与肿瘤的增殖、转移、凋亡、预后及耐药性等诸多生物学过程(图1),但是miR-93参与肿瘤发生发展各阶段的分子机制尚未完全揭示,尤其针对miR-93的抗肿瘤治疗研究尚处于初级阶段,因此未来仍需要更加深入的研究以致力于揭示其分子机制和推动其临床应用。
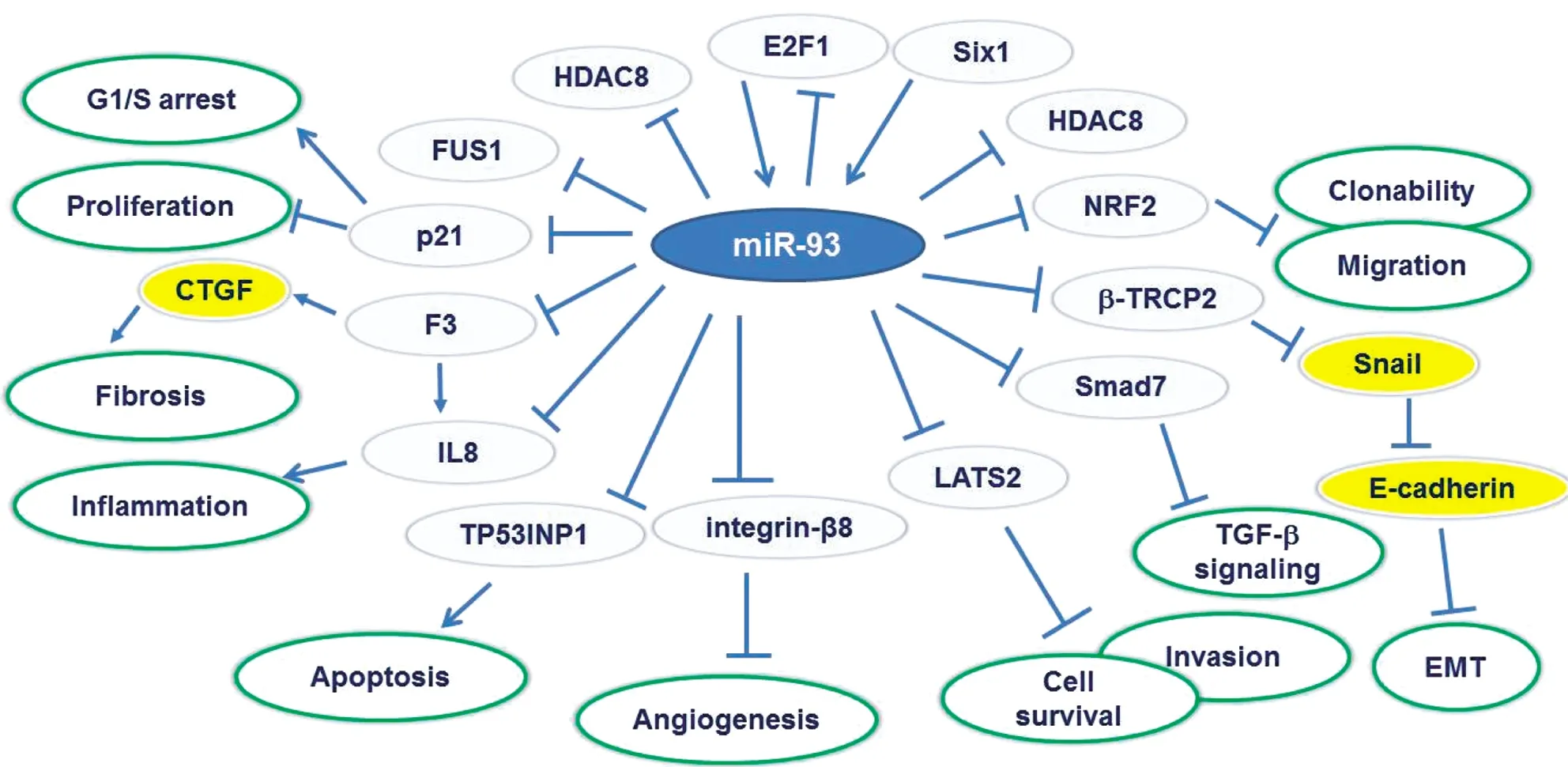
图1 miR-93参与调控肿瘤发生发展的信号通路
