环状RNA叉头框蛋白O3靶向微小RNA-122-5p对结直肠癌细胞恶性生物学行为的影响▲
2021-02-26赵彦焕张东姣樊丽伟汪景坤付晓霞赵玉红
赵彦焕 张东姣 樊丽伟 汪景坤 李 洵 付晓霞 张 磊 赵玉红
(中国人民解放军第八十二集团军医院消化内科,河北省保定市 071000,电子邮箱:muf67d@163.com)
结直肠癌是临床常见的一种恶性肿瘤,目前结直肠癌的治疗技术已取得巨大进步,但结直肠癌晚期患者的预后仍较差。局部浸润与远处转移是导致结直肠癌患者死亡率升高的主要原因,因而探究结直肠癌细胞增殖及转移的分子机制对寻找新的治疗靶点具有重要意义[1]。环状RNA(circular RNA,circRNA)是一类特殊的非编码RNA分子,是在mRNA剪接过程中上游5′端与下游3′端拼接在一起形成的闭合环状结构,大部分circRNA具有普遍性、稳定性与保守性等特点。研究表明circRNA可参与结直肠癌的发生及发展过程,其可通过碱基配对的原则与微小RNA(microRNA,miRNA)结合从而调控靶基因的表达,因此其有可能成为结直肠癌的治疗靶点[2-4]。环状RNA叉头框蛋白O3(circular RNA forkhead box protein O3,circFOXO3)在胃癌组织中高表达,并可促进胃癌细胞增殖及转移[5]。但circFOXO3与结直肠癌之间关系的相关研究报告尚少。一项生物信息学分析显示circFOXO3与miRNA-122-5p存在结合位点,研究表明miRNA-122-5p在结直肠癌组织与细胞系中表达下调,上调其表达可抑制结直肠癌的进展[6]。但circFOXO3/miRNA-122-5p分子轴是否参与结直肠癌的发生及发展过程尚未可知。因此,本研究探讨circFOXO3是否可通过靶向调控miRNA-122-5p从而影响结直肠癌细胞的恶性生物学行为。
1 材料与方法
1.1 样本来源与试剂 选取2018年12月至2020年1月本院收治的38例结直肠癌患者为研究对象。所有患者均经病理诊断证实为结直肠癌,其中男性28例、女性10例,年龄53~70(61.03±6.11)岁。术中切除患者的癌组织及其相应癌旁组织标本后立即置于液氮中保存。人结直肠癌细胞HCT116购自中国科学院上海细胞库;杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)购自美国Gibco公司(批号:20190203);胎牛血清(批号:20181118)、Lipofectamine2000(批号:20181215)、TRIzol试剂(批号:20181203)购自美国Thermo Fisher公司;反转录试剂盒(批号:20190103)与荧光定量PCR试剂盒(批号:20181225)购自北京天根生化公司;细胞计数检测(cell counting kit-8,CCK-8)试剂购自上海碧云天生物公司(批号:20190208);Transwell小室(批号:20181212)、Matrigel基质胶(批号:20190211)购自北京索莱宝公司;si-NC、si-circFOXO3、miRNA-NC、miRNA-122-5p模拟物、抗miRNA-122-5p-NC、抗miRNA-122-5p购自广州锐博生物公司;兔抗人基质金属蛋白酶(matrix metalloproteinase,MMP)-2(批号:20190216)、MMP-9抗体(批号:20190218)与辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗(批号:20181206)购自美国Santa Cruz公司。
1.2 实验分组及干预 取对数生长期人结直肠癌细胞HCT116用胰蛋白酶消化后,按照1×104个/孔的密度接种于6孔板,加入DMEM培养基,于37℃、5% CO2培养箱内培养,待细胞生长融合度达到80%时,更换无血清的培养基,用Lipofectamine2000试剂(10 μL)进行转染。实验分组:si-NC组(转染终浓度为50 nmol/L的si-NC)、si-circFOXO3组(转染终浓度为50 nmol/L的si-circFOXO3)、miRNA-NC组(转染终浓度为50 nmol/L的miRNA-122-5p-NC)、miRNA-122-5p组(转染终浓度为50 nmol/L的miRNA-122-5p-模拟物)、si-circFOXO3+抗miRNA-NC组(共转染终浓度为si-circFOXO3与终浓度为50 nmol/L的抗miRNA-122-5p-NC)、si-circFOXO3+抗miRNA-122-5p组(共转染终浓度为50 nmol/L的si-circFOXO3与终浓度为50 nmol/L的抗miRNA-122-5p)。转染6 h后更换为含有10%胎牛血清的正常DMEM培养基,置于37℃、5% CO2的培养箱内培养48 h。
1.3 实时定量PCR检测circFOXO3、miRNA-122-5p的相对表达水平 用TRIzol法分别提取癌旁组织、结直肠癌组织与转染后HCT116细胞的总RNA,取1 μg RNA反转录合成cDNA,运用荧光定量PCR试剂盒分析circFOXO3[以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参]、miRNA-122-5p(以U6内参为内参)的相对表达水平。检测仪器为StepOnePlus实时荧光定量PCR仪,采用2-ΔΔCt法进行计算。circFOXO3正向引物序列为5′-GTGGGGAACTTCACTGGTGCTAAG-3′,反向引物序列为5′-GGGTTGATGATCCACCAAGAGCTCTT-3′;GAPDH正向引物序列为5′-GGAGCGAGATCCCTCCAAAAT-3′,反向引物序列为5′-GGCTGTTGTCATACTTCTCATGG-3′;miRNA-1225-5p正向引物序列为5′-ACAGTGCGGTCTACGCATGCGTTCGGTAGACAGTCGTAG-3′,反向引物序列为5′-GCGACAGCTGCTTACGTAGGATGCGCGCATAGCTTGCAG-3′;U6正向引物序列为5′-ATTGGAACGATACAGAGAAGATT-3′,反向引物序列为5′-GGAACGCTTCACGAATTTG-3′。实时定量PCR反应体系包括10×PCR 缓释液2.5 μL、MgSO42.5 μL、dNTPs 2.5 μL、正反向引物各0.5 μL,cDNA 2 μL,RNase-Free ddH2O补足体系至25 μL。反应条件为95℃预变性2 min,95℃变性60 s,60℃退火30 s,72℃延伸30 s,共40次循环。实验重复3次,每组设置3个复孔。
1.4 CCK-8法检测细胞增殖 收集转染后的HCT116细胞,用胰蛋白酶消化后,3 000 r/min离心10 min,收集重悬细胞,按照1×103个/孔的密度接种于96孔板,分别加入CCK-8试剂10 μL和DMEM培养液100 μL,于37℃、5% CO2培养箱内培养2 h,用SpectraMax化学发光型酶联免疫检测仪(北京悦昌行科技有限公司)检测各孔在波长450 nm处的吸光度值。实验重复3次,每组设置3个复孔。
1.5 平板克隆形成实验 收集转染后的HCT116细胞,按照1×103个/孔的密度接种于6孔板,于37℃、5% CO2培养箱内培养,每隔2 d更换一次培养液,直至出现细胞集落时终止培养,弃培养液,用磷酸缓冲盐溶液洗涤,用4%多聚甲醛固定30 min,用0.1%结晶紫染色液染色20 min,蒸馏水冲洗后晾干,观察细胞克隆形成数量。实验重复3次,每组设置3个复孔。
1.6 Transwell实验检测细胞迁移与侵袭 进行迁移实验时直接将各组HCT116细胞悬液加入Transwell小室上层(密度4×104个/mL,200 μL/孔),进行侵袭实验时需要预先在Transwell小室上层铺Matrigel基质胶稀释液(3 mg/mL,40 μL/孔),将Transwell小室置于37℃、5% CO2培养箱内孵育1 h后,在上层加入各组HCT116细胞悬液(密度为6×104个/mL,200 μL/孔);下层加入600 μL含有10%胎牛血清的DMEM培养液,于37℃、5% CO2培养箱内培养24 h后取出Transwell小室,磷酸缓冲盐溶液冲洗,用4%多聚甲醛固定下层细胞20 min,用0.1%结晶紫染液染色10 min,用倒置显微镜观察小室下层细胞数。实验重复3次,每组设置3个复孔。
1.7 双荧光素酶报告基因检测circFOXO3与miRNA-122-5p的靶向关系 通过生物信息学数据库starBase(https://starbase.sysu.edu.cn/agoClipRNA.php?source=lncRNA&flag=target&clade=mammal&genome=human&assembly=hg19&miRNA=all&clipNum=1&deNum=0&panNum=0&target=DLGAP4)预测circFOXO3的靶基因,将含有circFOXO3与miRNA-122-5p的结合位点序列片段(由美国Promega公司构建)导入pGL3双荧光素酶报告载体(美国Promega)中构建野生型载体WT-circFOXO3,用基因突变技术对结合位点进行点突变,将含有突变位点的序列片段导入pGL3双荧光素酶报告载体中构建突变型载体MUT-circFOXO3,用80 ng荧光素酶报告载体(美国Promega)分别与miRNA-122-5p-NC、miRNA-122-5p模拟物利用Lipofectamine 2000转染试剂共同转染至对数生长期的HCT116细胞,24 h后用Dual Luciferase Reporter System(美国Promega)检测荧光素酶活性。以海肾荧光素酶报告基因活性值为内参,计算各组细胞荧光素酶活性值(萤火虫荧光素酶报告基因活性值/海肾荧光素酶报告基因活性值)。实验重复3次,每组设置3个复孔。
1.8 蛋白质印迹法检测MMP-2、MMP-9蛋白的相对表达水平 用含有蛋白酶抑制剂的RIPA裂解液提取1.2转染后的HCT116细胞总蛋白,用二喹啉甲酸法定量蛋白,取10 μg蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,结束后转移至聚偏氟乙烯膜,5%脱脂牛奶封闭1 h,加入MMP-2(1 ∶1 000)、MMP-9(1 ∶1 000)一抗与内参GAPDH(1 ∶1 000),4℃反应24 h,TBST洗涤,加入二抗(1 ∶2 000),室温反应1 h,TBST洗膜,电化学发光显影后采集蛋白图像,目的蛋白条带灰度值与GAPDH条带灰度值的比值即为目的蛋白相对表达水平。实验重复3次,每组设置3个复孔。
1.9 统计学分析 采用SPSS 21.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用独立样本t检验;采用Pearson法进行相关性分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 circFOXO3与miRNA-122-5p在结直肠癌中的表达情况及相关性 与癌旁组织比较,结直肠癌组织中circFOXO3的表达水平升高,miRNA-122-5p的表达水平降低(均P<0.05),见表1。结直肠癌组织中circFOXO3与miRNA-122-5p的表达水平呈负相关(r=-0.719,P<0.001)。

表1 circFOXO3与miRNA-122-5p在结直肠癌和癌旁组织中的相对表达水平(x±s)
2.2 干扰circFOXO3表达对HCT116细胞生物学行为、相关基因和蛋白表达的影响 与si-NC组比较,si-circFOXO3组的miRNA-122-5p表达水平升高,circFOXO3表达水平下调,细胞活力降低,克隆形成数、迁移及侵袭细胞数减少,MMP-2、MMP-9蛋白表达水平下降(均P<0.05),见图1、表2。

图1 干扰circFOXO3表达后HCT116细胞MMP-2、MMP-9蛋白的表达情况

表2 两组HCT116细胞生物学行为、相关基因和蛋白表达的比较(x±s)
2.3 circFOXO3与miRNA-122-5p的靶向关系 circFOXO3与miRNA-122-5p存在结合位点,见图2。转染miRNA-122-5p模拟物可明显降低野生型载体WT-circFOXO3的荧光素酶活性(P<0.05),而对突变型载体MUT-circFOXO3的荧光素酶活性无明显影响(P>0.05),见表3。

图2 starBase数据库预测显示circFOXO3与miRNA-122-5p存在结合位点

表3 双荧光素酶报告基因实验结果(x±s)
2.4 miRNA-122-5p过表达对HCT116细胞生物学行为、相关基因和蛋白表达的影响 与miRNA-NC组比较,miRNA-122-5p组的细胞miRNA-122-5p表达上调,活力降低,克隆形成数、迁移及侵袭细胞数均减少,MMP-2、MMP-9蛋白表达水平降低(均P<0.05),见图3、表4。
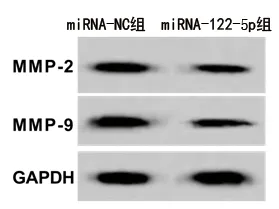
图3 miRNA-122-5p过表达后HCT116细胞MMP-2、MMP-9蛋白的表达情况
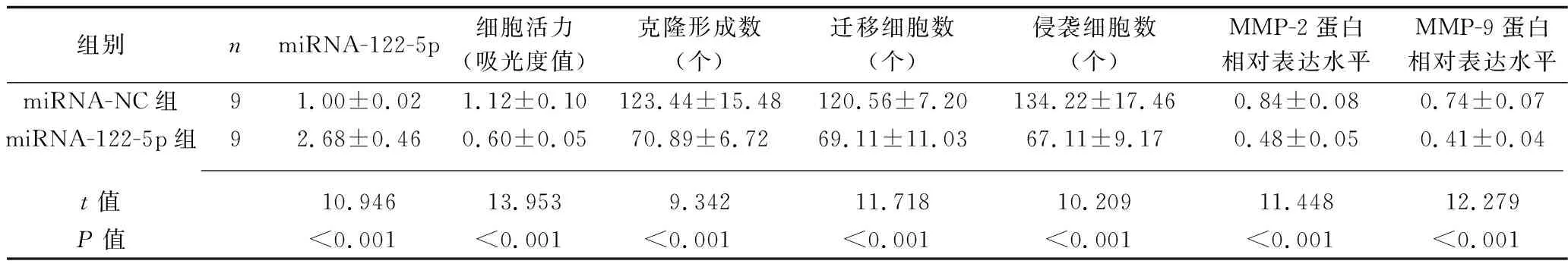
表4 miRNA-122-5p过表达后HCT116细胞生物学行为、相关基因和蛋白表达的比较(x±s)
2.5 抑制miRNA-122-5p表达联合干扰circFOXO3表达对HCT116细胞生物学行为、相关基因和蛋白表达的影响 与si-circFOXO3+抗miRNA-NC组比较,si-circFOXO3+抗miRNA-122-5p组的miRNA-122-5p表达水平下调,细胞活力升高,克隆形成数、迁移及侵袭细胞数均增多,MMP-2、MMP-9蛋白表达水平升高(均P<0.05),见图4、表5。
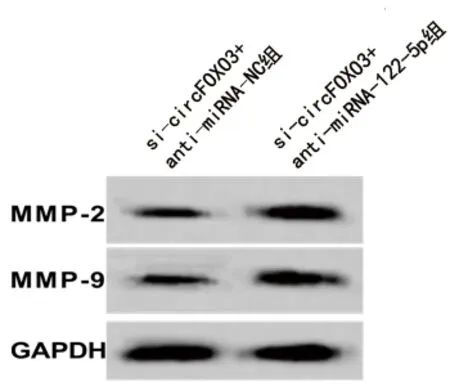
图4 抑制miRNA-122-5p表达联合干扰circFOXO3表达后HCT116细胞MMP-2、MMP-9蛋白的表达情况
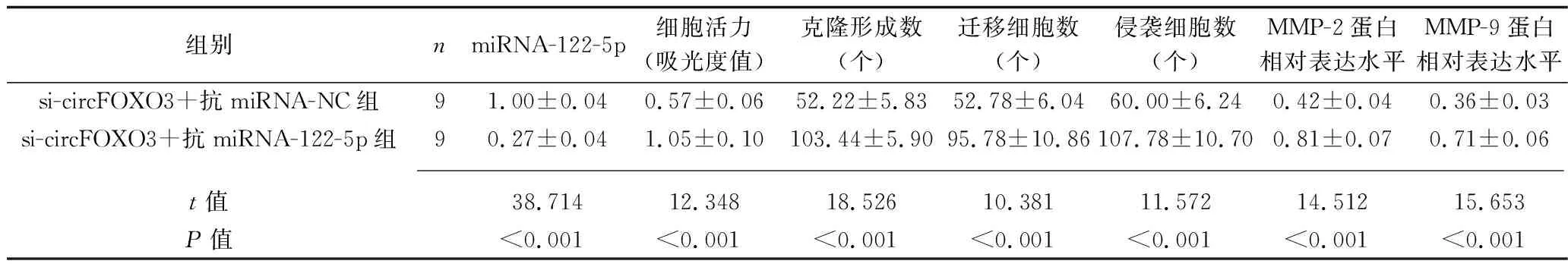
表5 抑制miRNA-122-5p表达联合干扰circFOXO3表达对HCT116细胞生物学行为、相关基因和蛋白表达影响的比较(x±s)
3 讨 论
circRNA广泛存在于生物细胞中,目前已发现多个circRNA的表达异常与结直肠癌有关,主要分为促癌circRNA与抑癌circRNA,可调控结直肠癌细胞生物学行为。例如,hsa-circRNA-102958通过miRNA-585/CDC25B轴促进结直肠癌的发生[7];circHIPK3通过充当miRNA-7的海绵分子促进结直肠癌的生长和转移[8];circRNA-0000392通过miRNA-193a-5p促进结直肠癌的进展[9];circRNA CBL.11通过充当miRNA-6778-5p的海绵分子抑制结直肠癌细胞增殖[10]。circRNA在结直肠癌发生及转移过程中的作用机制成为研究热点。
本研究结果显示,结直肠癌组织中circFOXO3的表达水平升高,干扰circFOXO3表达可降低结直肠癌细胞活力,且使细胞克隆形成数减少(P<0.05),提示干扰circFOXO3表达可抑制结直肠癌细胞增殖及克隆形成。MMP与肿瘤细胞转移能力有关,其中MMP-2、MMP-9在结直肠癌中的水平升高,可通过降解细胞外基质沉积而促进细胞转移[11-12]。本研究结果显示,干扰circFOXO3表达后结直肠癌迁移及侵袭细胞数均减少,MMP-2、MMP-9蛋白表达水平降低(P<0.05),提示干扰circFOXO3表达可抑制结直肠癌细胞迁移及侵袭。
本研究结果显示,结直肠癌组织中miRNA-122-5p的表达水平降低,circFOXO3与miRNA-122-5p的表达水平呈负相关,且干扰circFOXO3表达后可明显促进结直肠癌细胞中miRNA-122-5p的表达(P<0.05),提示circFOXO3可能通过负向调控miRNA-122-5p的表达从而参与结直肠癌的发生及发展过程。研究表明,miRNA-122-5p通过下调双特异性磷酸酶4抑制胃癌细胞迁移和侵袭[13],并可通过靶向LYN激酶抑制胃癌细胞增殖、迁移和侵袭[14]。此外,miRNA-122-5p还可通过靶向特异AT序列结合蛋白1抑制鼻咽癌细胞增殖、迁移和侵袭[15]。这些研究表明miRNA-122-5p在肿瘤的生长及转移过程中可能发挥抑癌基因作用。本研究结果通过双荧光酶报告基因检测进一步证实,结直肠癌细胞中circFOXO3与miRNA-122-5p存在结合位点,并可竞争性结合miRNA-122-5p。此外,miRNA-122-5p过表达可降低结直肠癌细胞活力、克隆形成、迁移及侵袭能力,而抑制miRNA-122-5p表达可明显拮抗干扰circFOXO3表达对结直肠癌细胞恶性生物学行为的作用。提示circFOXO3靶向miRNA-122-5p促进结直肠癌进展。
综上所述,结直肠癌组织中circFOXO3表达水平升高,而miRNA-122-5p表达水平降低,干扰circFOXO3表达可通过负向调控miRNA-122-5p从而抑制结直肠癌细胞增殖、克隆形成、迁移及侵袭。由此可见circFOXO3可充当miRNA-122-5p的海绵分子而参与结直肠癌发生及发展过程,其或可作为结直肠癌的治疗靶点。这为进一步阐释结直肠癌的发病机制奠定了实验基础,下一步实验将进行体内动物实验验证circFOXO3/miRNA-122-5p分子轴在结直肠癌发生过程中的作用机制,进一步探寻miRNA-122-5p的可能作用靶点,以明确circRNA-miRNA-mRNA分子轴在结直肠癌发生及转移过程中的作用机制。
