中药靶向制剂的研究进展
2021-02-25蒋沅岐董玉洁陈金鹏周福军田成旺陈常青
蒋沅岐,董玉洁,陈金鹏,刘 毅,周福军,田成旺*,陈常青
·综 述·
中药靶向制剂的研究进展
蒋沅岐1,董玉洁1,陈金鹏2, 3, 4,刘 毅2, 3, 4,周福军2, 3, 4,田成旺2, 3, 4*,陈常青2*
1. 天津中医药大学,天津 300193 2. 天津药物研究院,天津 300462 3. 天津市中药质量标志物重点实验室,天津 300462 4. 释药技术与药代动力学国家重点实验室,天津 300462
靶向制剂亦称靶向给药系统,将药物浓集于病变部位,并使药物保持一定浓度在靶部位滞留一定的时间,从而减少用药剂量,在一定程度上可减少药物不良反应的发生,提高药物的安全性和患者用药的顺应性,故靶向制剂在药剂学领域受到广泛的关注。对近年来中药靶向制剂应用的相关研究进行综述,主要从中药被动靶向、主动靶向和物理化学靶向3个方面阐述中药靶向给药的研究进展,以期为靶向制剂技术在中药靶向制剂中的应用研究提供参考。
中药;制剂;有效成分;靶向给药系统;靶向制剂;应用
中药种类繁多,且大多来源于植物、动物、矿物的非人工制品,其化学成分十分复杂。随着对中药活性物质研究的深入,中药中的天然成分或其衍生物在新药研发领域和临床应用中取得了较好的成果。中药天然成分具有高效、低毒、多靶点的优势,但因其溶解度低、稳定性差导致生物利用度低,靶点多而体内特异性分布低,限制了其临床应用。
靶向制剂亦称靶向给药系统,通过载体使药物选择性的浓集于病变部位。病变部位被称为靶部位,靶部位可以是器官、组织、细胞或细胞内的某靶点。中药靶向制剂是将中药提取分离,得到活性成分单体或有效部位,采用不同的制剂载体制成的一类制剂[1],具有药理活性专一、不良反应小、生物利用度高等特点。现代靶向概念与中医药传统的引经和归经理论不谋而合,都有引导药物去预定目标之意,正如吴鞠通《医医病书》中所言:“药之有引经,如人之不识路径者用向导也。”同时,现代药理学和药动学研究为中医引经理论与现代靶向理论的相似性提供了依据。已有研究证实冰片具有脑靶向性,可增强其他药物的脑分布[2]。在安宫牛黄丸等方剂中,冰片助牛黄和麝香“内透包络”,实现其引经的作用,现代药理学也证明冰片能促进槲皮素、栀子苷等多种药物在脑内的浓集。近年来中药活性成分的靶向制剂尤其受到重视,随着靶向制剂研究的不断深入及相关领域的持续发展,中药靶向治疗为疑难杂症的治疗提供了新的思路。按靶向给药系统的作用原理不同,可将靶向制剂分为3类:被动靶向制剂、主动靶向制剂和物理化学靶向制剂。近年来,中药靶向制剂在微球、脂质体、纳米粒、磁性靶向制剂、热敏靶向制剂等方面都取得了较大的进展。并且,随着各种新型材料的出现,将使被动靶向的载体更安全、靶向性更精确、疗效更好,未来靶向制剂的前景十分广阔。
1 被动靶向制剂
被动靶向制剂又称自然靶向制剂,其可被单核巨噬细胞系统的巨噬细胞摄取,通过正常的生理过程将药物传递至靶部位,从而实现靶向性[3],其与被动靶向制剂最大的区别在于被动靶向制剂的载体上不含有特异性作用的配体。
1.1 微球
微球的粒径一般在1~250 μm,是药物分散或被吸附在高分子聚合物基质中而形成的微粒分散系统[4],是常用的具有靶向作用的药物载体之一,一般供注射或口服用。通过控制微球的粒径可实现其对不同靶部位的靶向性。一般情况下,小于7 μm的微球可被肝、脾中的巨噬细胞摄取;7~10 μm以及粒径更大的微球通常会被肺部的最小毛细血管床机械性摄取,从而使药物浓集于肺[5]。与传统的中药制剂相比,中药微球制剂能在靶器官或血液维持较高的浓度,给药途径更多样化,疗效持久,安全性高。靶向微球多以生物可降解材料为载体,可降低药物不良反应,生物相容性好,可提高药物的靶向性,同时能掩盖药物的不良口味,现已广泛应用于肝癌等多种恶性肿瘤的栓塞治疗[6]。斑蝥素是斑蝥中具有抗肿瘤作用的有效成分,但其具有强烈泌尿系统刺激作用,不易被患者接受。王广生[7]首次制备了其双去甲基类似物去甲斑蝥素,有效解决了这一问题,现已应用于临床多年,疗效较好。但去甲斑蝥素在体内不稳定,且应用剂量稍大时易产生不良反应。为了提高去甲斑蝥素制剂的靶向性和安全性,许多学者开始着眼于新的载药材料来改善靶向给药。Ma等[8]采用浓缩均质法和磷脂复合物法制备了去甲斑蝥素脂质微球,药物包封率达80%以上,稳定性明显提高,药物在肝、脾、肺中的分布显著增加,而在肾脏中的分布略有减少。说明脂质微球的应用可提高靶向性,降低肾毒性。宋玉玲[9]以壳聚糖为载体,采用乳化-化学交联法制备去甲斑蝥素壳聚糖微球,用于肝动脉栓塞治疗研究。结果显示,给药组兔VX2肝癌的肿瘤体积、生长曲线在观察期内受到抑制,说明去甲斑蝥素壳聚糖肝动脉栓塞微球对兔VX2肝癌有一定的治疗作用。同时,微球可减小药物的不良反应,延长释药时间,降低给药频率。
1.2 脂质体
脂质体是由一层或多层的脂质双分子构成的囊状小球,结构与生物膜类似。其作为中药药物的载药材料,能包埋不同极性的药物,可携带大量药物,有提高疗效、增加药物稳定性、降低药物毒性等优点。脂质体在体内可被巨噬细胞摄取,在骨髓、肝、脾等单核巨噬细胞较为丰富的部位浓集,从而发挥靶向作用。脂质体的颗粒大小、电荷、层数、脂质成分以及聚合物和配体的表面修饰情况,都会影响其在体外和体内的稳定性。楼一层等[10]用多肽angiopep修饰复方脂质体,制备了复方舒郁健脑脑靶向脂质体。该脂质体可透过血脑屏障,与普通脂质体相比,其在大鼠脑部的药物浓度明显升高,具有良好的脑靶向性。槲皮素是一种天然的黄酮类化合物,除具有抗氧化作用外,还表现出对肿瘤细胞显著的促凋亡活性,在细胞周期的不同阶段控制肿瘤细胞生长。但因存在口服生物利用度低、水溶性差等问题,槲皮素的应用受到了限制。在被脂质体包裹后,槲皮素的靶向性、安全性、生物相容性、生物降解性和毒性均得到了改善[11],说明槲皮素脂质体载药系统作为一种肿瘤化疗药物有很好的应用前景。尽管脂质体有诸多优点,但仍受到一些限制,如肿瘤环境复杂,单一成分药物不能取得令人满意的治疗效果;胆固醇作为脂质体制备不可或缺原料之一,由于宗教传统和素食主义相关问题而受到质疑;另外,曾有研究发现,脂质体中的胆固醇能够调节血清脂蛋白水平,使部分患者发生“补体介导的假过敏反应”,从而导致肺动脉高压和其他不良反应[12],这无疑给脂质体的应用蒙上阴影。为解决上述弊端,Hong等[13]开发了一种基于人参皂苷Rh2的多功能脂质体系统(Rh2-Lipo),创新性地挑战了胆固醇作为脂质体成分的地位。与传统的脂质体不同,Rh2-Lipo中的胆固醇和PEG都被人参皂苷Rh2取代,人参皂苷Rh2同时起到膜稳定剂、长循环潜伏剂、活性靶向配体和化疗佐剂的作用,是一种多功能载体,可谓“一石四鸟”。在乳腺癌4T1细胞异种移植瘤模型实验中,紫杉醇Rh2-脂质体对肿瘤生长显示出了高效抑制。Rh2-Lipo为抗癌药物载药系统提供了一种全新的潜在的研究思路,为解决脂质体的局限性提供了可能。
1.3 纳米粒
纳米粒是由天然高分子物质或合成高分子物质制成的固状胶态粒子,直径在10~500 nm,包封率高、稳定性好,可生物降解。其经iv后,一般被单核-巨噬细胞摄取,主要分布于肝、脾、肺。与脂质体相比,纳米粒具有更强的靶向能力,越来越多的纳米制剂被应用于临床[14]。姜黄素是从姜黄中提取的一种多酚类化合物,具有抗炎、抗菌、抗病毒、抗肿瘤等多种药理作用[15-16]。在实际应用中发现,姜黄素的溶解度较低、稳定性差、吸收率低,导致其生物利用度低,很大程度上限制了它的应用。Rachmawati等[17]以二氯甲烷为溶剂,维生素E聚乙二醇琥珀酸酯为表面活性剂,采用乳化-溶剂挥发法制备了姜黄素聚乳酸纳米粒,并对其进行工艺优化,得到了性能最佳的高分子纳米载体,为姜黄素纳米制剂的研发提供了参考。洪峰等[18]将姜黄素和光热剂装载于血管内皮生长因子(vascular endothelial growth factor,VEGF)靶向修饰的介孔二氧化硅纳米载药系统,并对其肿瘤细胞杀伤效果进行评估。结果显示,该系统可提高姜黄素的水溶性、体内稳定性以及细胞摄取量,姜黄素和光热剂联用可起到协同作用,杀伤肿瘤细胞效果可达99%。同时,这种介孔二氧化硅纳米载药系统显示出了优良的载药效果,并且可以装载大部分药物,为药物体内稳定性差、溶解性差、缺乏靶向性等问题提供了新的解决思路。Almutairi等[19]以真菌壳聚糖纳米粒为姜黄素的载体,制备了姜黄素纳米粒,观察其对人结肠癌HCT-116细胞和肺癌A-549细胞的作用效果。72 h后,大多数癌细胞进入凋亡期,96 h后,HCT-116和A-546细胞的死亡率分别为67.6%、73.8%,证实了真菌壳聚糖纳米粒子能作为姜黄素的载药材料并增强其对不同人类癌细胞的抗癌活性,并促使其自噬和凋亡。
2 主动靶向制剂
主动靶向制剂是对载药微粒的表面进行修饰,使之不被巨噬细胞摄取,防止其在肝、脾内浓集,从而改变载药微粒在体内的自然分布,将药物运送至特定的靶部位发挥药效。主动靶向制剂主要分为表面修饰制剂和前体药物制剂2大类,前者是将药物载体进行修饰,从而使药物定向到达靶部位发挥疗效,后者是把药物修饰成前体药物,使药物在靶部位激活而发挥作用。
2.1 表面修饰制剂
按载药载体的不同,表面修饰制剂主要可分为修饰的脂质体、修饰的微球(囊)和修饰的纳米粒3大类,见图1。

图1 表面修饰制剂的分类
20世纪90年代,有学者[20-21]证实了肝细胞表面存在大量的甘草次酸受体,使甘草次酸有较强的肝靶向性和肝分布特征,为肝主动靶向制剂的研究提供了新思路。毛声俊等[22]首次成功制备得到了甘草次酸表面修饰脂质体,可与肝细胞表面的甘草次酸受体特异性结合,为肝细胞主动靶向给药系统进一步的研究与开发奠定了基础。在此基础上,吴超等[23]对甘草次酸分子进行修饰,合成了甘草次酸硬脂醇酯-3--半乳糖两亲性导向分子,并用其修饰去甲斑蝥素脂质体。所制得的修饰脂质体包封率达56.29%,肝靶向指数为5.213。张莉等[24]用甘草次酸修饰紫杉醇透明质酸纳米粒并评价其体外特性,载药量和包封效果良好,四甲基偶氮唑蓝实验显示其对多种肿瘤细胞均有杀伤作用,细胞摄取实验表明,其易被肿瘤细胞摄取,增加了药物在肿瘤部位的蓄积,增强了治疗效果,为其应用于临床提供了参考。莪术醇是莪术的主要抗癌活性成分,但水溶性较差,阻碍了其临床应用。莪术醇脂质体已有文献报道,但均为被动靶向制剂,Li等[25]首次将莪术醇包埋于半乳糖脂质体基质中,制备了半乳糖化莪术醇脂质体。脂质体上的半乳糖残基可与肝细胞表面的去唾液酸糖蛋白受体特异性结合,是一种主动肝靶向制剂。该课题组对制备工艺进行优化,得出采用2步法制备的脂质体包封率、粒径和稳定系数均有提高,为莪术醇肝靶向制剂的研究提供了参考。Hasanpoor等[26]用蛋白程序性死亡配体1(protein programmed death ligand 1,PDL1)对人血清蛋白-姜黄素纳米粒进行功能化,以期增强其对乳腺癌细胞的靶向性,细胞存活率和细胞凋亡检测显示,经PDL1修饰的人血清蛋白-姜黄素纳米粒对乳腺癌细胞的细胞毒性高于游离的姜黄素,药物摄取率也有所改善,说明PDL1有望成为选择性药物传递的靶点,并用于治疗表达PDL1的乳腺癌。张慧迪[27]用VEGF抗体修饰脂质体包裹丹皮酚,能增加药物在真皮层的滞留量,阻断VEGF的生物效应。对丹皮酚VEGF抗体修饰脂质体透皮制剂进行皮肤刺激性及治疗效果考察,结果显示,其对家兔皮肤无刺激性,并且能很好地治疗兔耳的增生性瘢痕。醒脑静注射液由经典名方“安宫牛黄丸”化裁而来,但其给药不方便、不良反应发生率高、入脑较慢。为弥补上述缺点,温然[28]制备了醒脑静mPEG2000-PLA共聚物修饰微乳,并采用鼻腔给药的方式,增强了药物的脑靶向性,同时,微乳经修饰后,鼻黏膜刺激性明显降低,具有较高的临床应用价值。
2.2 前体药物制剂
前体药物是将有药理活性的母体药物进行修饰后得到的一种化合物,其在体外无活性或活性较小,在体内经生物转化后释放出母体药物从而发挥疗效。前体药物在抗癌药领域的应用受到广泛关注,姜黄素的生物利用度低一直是其临床应用的主要障碍,围绕这一难点展开了很多研究。Ozawa-Umeta等[29]合成了一种水溶性的可注射型姜黄素β--葡萄糖醛酸,用于治疗结肠癌,静脉注射给药后,在体内可经β-葡萄糖醛酸酶转化为游离形式的姜黄素,姜黄素前体药物的血浆水平比常规口服高出1000倍以上,生物利用度得到明显改善。免疫组织化学结果显示,给药组小鼠肿瘤组织中核因子κB活性明显降低,且在靶部位以外的器官中均未检到游离的姜黄素。结果表明姜黄素β--葡萄糖醛酸毒性较小,是一种治疗结肠癌很有前途的药物。Nasrollahi等[30]报道了麦芽糖淀粉酶(maltogenic α-amylase,Maase,EC 3.2.1.133)对环糊精具有很强的选择性,能将环糊精迅速水解,预计药物将在β-环糊精(β-cyclodextrin,β-CD)水解开环后释放。该课题组随后制备了一种基于抗体-酶前药系统的新型靶向控释给药系统[31],这一系统由基于β-CD-姜黄素包合物的前药和基于Maase-曲妥珠单抗复合物的酶-抗体复合物2部分组成。免疫细胞化学分析表明,该前药复合物对β-CD显示出较高的降解活性,并与人表皮生长因子受体-2阳性肿瘤细胞有明显的结合活性,使姜黄素在靶细胞表面快速释放从而实现姜黄素的包埋和控释。
3 物理化学靶向制剂
物理化学靶向制剂是应用某些物理化学方法使药物在特定部位发挥药效的靶向给药系统,如磁性、温度、pH值等。
3.1 磁性靶向制剂
磁性靶向制剂属于第4代靶向制剂,由磁性复合材料药物载体和高分子骨架组成,在外加磁场作用下,使药物向靶部位浓集并释药,从而实现靶向治疗。与其他靶向制剂相比,磁性靶向制剂具有靶向性好、载药量大、不易被网状内皮系统摄取等优势[32],研究热度颇高,对肝、胃等多种实体肿瘤均有治疗作用,国内外对紫杉醇等多种中药单体成分均有较多研究,见表1。另外,Lin等[40]制备了紫杉醇表皮生长因子受体多肽偶联磁性聚合物脂质体,裸鼠体内肝靶向研究结果显示,该复合物在磁场力的作用下在肝脏内蓄积,另外,在表皮生长因子受体的靶向作用下扩散到了肿瘤细胞中,说明该复合物有望成为肝癌靶向治疗的有效给药系统。为解决紫杉醇局部定位性差易导致全身不良反应的问题,Feng等[41]开发了一种新型的聚乳酸-羟基乙酸共聚[poly(lactic-co-glycolic acid),PLGA]磁性Janus颗粒(DMJPs)给药系统,包含3个不同的功能隔室:紫杉醇用于杀伤癌细胞,磁铁矿(Fe3O4)纳米颗粒用于靶向定位,罗丹明B用于荧光示踪实时显示DMJPs与癌细胞的相互作用。在外加磁场环境下,DMJPs被靶向引导聚集于靶细胞部位并进入细胞内。并且DMJPs仅对人乳腺癌MDA-MB-231细胞表现出特异性和高毒性,而对小鼠胚胎成纤维NIH-3T3细胞无明显毒性。DMJPs显示出对癌细胞的特异靶向性将极大地避免潜在的不良反应,有望为恶性肿瘤精确药物治疗系统的开发提供新的方法。大黄素是大黄中的主要成分之一,对肿瘤的生长和迁移有抑制作用。其临床应用的主要障碍在于靶向性和溶解性差,Song等[42]将大黄素装载于脂质体的脂质双层中,同时将高性能的磁性氧化铁离子包裹于亲水性双层。制得的大黄素磁性脂质体纳米粒在低浓度(16 μg/mL)时对人乳腺癌MCF7细胞的杀伤率比疏水性游离大黄素提高了24.1%。并且在外加磁场时,该磁性脂质体在小鼠体内能得到有效蓄积,有助于降低大黄素的治疗剂量,表明该大黄素磁性脂质体可作为一种新的次靶向制剂用于恶性肿瘤的治疗。
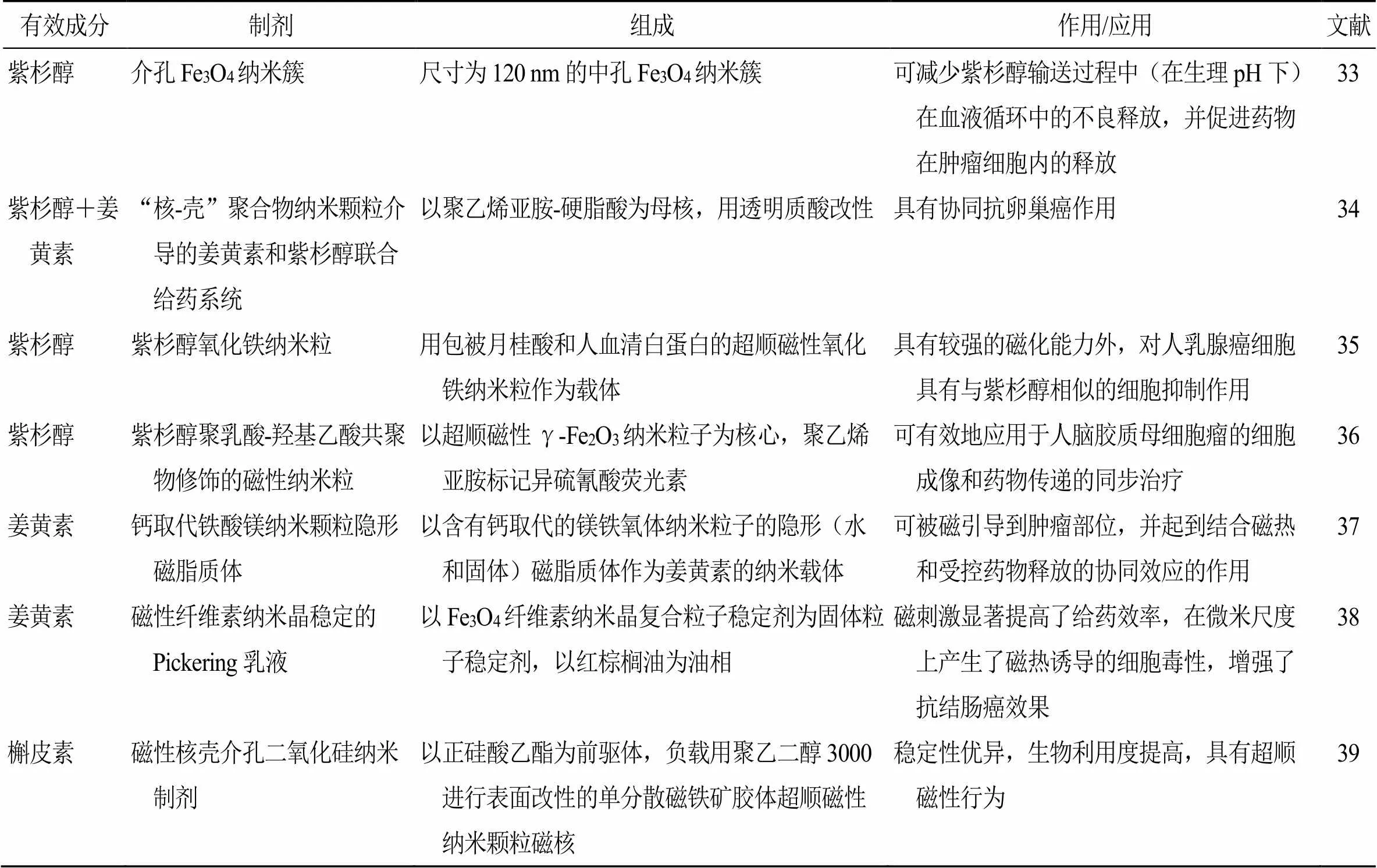
表1 磁性靶向制剂的组成与应用
3.2 热敏靶向制剂
热敏脂质体,又称温度敏感型脂质体,是近年来肿瘤靶向治疗中的热点之一。纳米级的热敏脂质体可选择性地蓄积在肿瘤部位,体温正常时,脂质体膜排列有序而致密,药物被包被于膜内;当其到达经过预热的靶部位时,由于达到了相变温度,脂质体膜通透性增大,导致其包裹药物的流动性大幅增加而扩散到靶部位,形成较高的药物浓度,从而实现靶向治疗的目的[43]。有文献报道,癌细胞比健康细胞对高温更敏感,相变温度一般会高于正常体温,所以癌细胞更容易被杀灭[44];同时,早已有研究证实热疗还可以增强某些化疗药物的细胞毒性[45],强化治疗效果。李成龙[46]采用薄膜水化法制备了温度敏感紫杉醇脂质体,包封率较高,生物学性能良好,并实现了药物的可控释放。Hao等[47]制备了多肽iRGD修饰的共轭亚油酸-紫杉醇纳米脂质体,并观察其对黑色素瘤B16-F10细胞的作用。体外和体内抗肿瘤活性显示其在42 ℃时具有温敏特性,细胞摄取率较高,可抑制肿瘤生长,延长生存期。热敏脂质体结合了脂质体和热疗的双重优势,进一步增强了药物的靶向性。
多功能治疗系统是近年来医学研究的重要发展方向,热敏脂质体和磁性靶向制剂复合而成的给药系统也为靶向制剂的应用开辟了新的思路。磁靶向热敏脂质体可以在外加磁场的作用下随血液循环蓄积于靶部位,磁热转化使靶部位温度升高,引起药物释放,从而提高药物的靶向性。Ribeiro等[48]制备了吉西他滨-紫杉醇热敏磁脂质体,并观察其对乳腺癌MGSO-3细胞的释放性能和毒性作用。结果显示,其在肿瘤组织中的蓄积特性较理想,相比于生理温度,吉西他滨和紫杉醇在相变温度下的释放率分别提高了85%、42%;相比于单纯热疗(50%)或化疗(40%),负载磁脂质体联合热疗(73%)可更有效地降低癌细胞存活率,说明吉西他滨和紫杉醇脂质体用于癌症治疗具有巨大潜力。Zheng等[49]制备了纳米级的薏苡仁油热敏磁脂质体,具有良好的磁靶向性和快速释药性能,相变温度在42 ℃左右,在外加磁场和热处理时对人肝癌HepG2细胞的抑制率明显增加,显示了热敏磁脂质体在肿瘤治疗领域的优势。Deng等[50]制备了紫杉醇近红外多功能脂质体,同时具有良好的近红外性能、磁性响应和温度敏感性,利用近红外荧光成像技术对癌细胞和药物的反应过程进行追踪,热处理和交变磁场处理可显著提高药物的抗癌性能(图2),在癌症的检测和治疗方面具有很大的潜力。

图2 使用装载紫杉醇、近红外量子点和磁性纳米颗粒的热敏脂质体进行癌细胞检测和治疗分析的示意图
3.3 pH敏感靶向制剂
pH敏感制剂的载药材料中一般会含有对pH敏感的成分,如弱酸性基团或酸敏感的化学键等,使其在生理pH(pH 7.4)环境下稳定,弱酸性环境下不稳定,膜通透性增加,引起药物的释放[51]。而肿瘤组织的pH通常在5.0~5.6[52],可使药物在相应靶部位快速释放而发挥药效。磷酸钙具有pH敏感性,可提高药物在肿瘤部位的浓度,基于此,Ru等[53]制备了pH敏感的雷公藤甲素脂质体磷酸钙纳米粒,并实验证实了该纳米粒的稳定性、pH敏感性及其对卵巢癌SKOV-3细胞的杀伤作用。与游离的雷公藤甲素相比,其对女性生殖系统的毒性显著降低,可作为卵巢癌化疗的一种新方法。叶酸受体在恶性肿瘤细胞中的表达较正常细胞高出2个数量级,叶酸及其药物结合物对其受体有很高的亲和力[54],故可作为抗癌药物的靶点。Monteiro等[55]制备了紫杉醇叶酸包衣长循环pH敏感脂质体,并通过结构脂的相变变化证实了该体系的pH敏感性。在pH值约为5.0时,该系统通过脂质体膜通透性增加或与内吞体膜融合来提高癌细胞部位的药物浓度,更有效地将紫杉醇导入肿瘤细胞,抑制肿瘤细胞分裂,增强体内抗肿瘤的效果。刘小芳等[56]用叶酸壳聚糖修饰姜黄素敏感脂质体,制得了叶酸壳聚糖姜黄素敏感脂质体,包封率高、稳定性好,药物能高效聚集于靶区,在pH 7.4、5.5的释放介质中48 h积累释放率分别表现出明显的叶酸受体靶向性。除叶酸受体介导的pH敏感靶向制剂外,近年来也不乏其他材料修饰的pH敏感脂质体的研究,如聚乙二醇包衣对pH敏感脂质体生物分布和肿瘤部位蓄积的影响[57]、透明质酸功能化pH敏感脂质体对吉西他滨耐药性的作用[58]、阳离子聚赖氨酸对pH敏感阴离子脂质体释放的影响[59]等。半夏泻心汤是《伤寒论》中的经典方,临床上对慢性胃炎、胃溃疡、功能性消化不良等疾病治疗效果较好。余巧等[60]选择丙烯酸树脂为包衣材料,制备了半夏泻心pH相关型结肠靶向片,在pH>7.0时包衣层开始溶解,以达到结肠释药的目的,并且该药在人工胃液中无释放。其在pH 7.8~8的磷酸盐缓冲液中1 h的释放度达85%以上,表明该制剂能达到结肠定位释药的目的。
4 总结与展望
随着中药药效成分的提取分离技术日渐成熟、中药有效成分的药理作用机制研究逐步深入,中药制剂新技术和新剂型的发展成为中药现代化核心内容。过去,中药成分溶解度低、稳定性差、靶向性差等特点限制了其临床应用,而中药与靶向制剂技术相结合,能从多个角度解决这些问题,这将是现代中药制剂的一个重要发展方向,具有非常广阔的前景。从当前的研究来看,将中药制成靶向制剂等新剂型极大地改变了传统中药剂型和制剂工艺,让传统中药在现代技术的加持下焕发了新的活力。但目前靶向制剂的研究还存在一些局限性:(1)许多药物由于稳定性差受到临床应用的限制,特别是供iv的靶向制剂;(2)目前中药靶向制剂的研究多在实验室研究阶段,临床应用较少;(3)当前研究中的中药靶向制剂多为中药单体药物,对中药有效部位和中药复方的研究很少;(4)部分靶向制剂载药量较小,提高载药量,减少给药次数,对降低药物毒副作用意义重大。
中药复方具有很大的临床优势和实用价值,但当前研究中的中药靶向制剂多为中药单体成分,主要是中药复方药味多、成分复杂、体内药动学研究困难。有学者认为,一种或多种已知有效成分的体内药动学研究和化药研究很相似,都是运用相关仪器进行有效成分的血药浓度测定。多靶点作用的物质基础是单味药和中药复方中的有效成分,研究中药复方靶向制剂时可加以利用[1]。中药复方靶向制剂的研究可先从药味少、有效成分明确、治疗作用显著、质量可控的复方中着手。未来,中药靶向制剂的应用必须以中医基础理论为基础,加强中药有效成分药效学、药动学研究,着眼于中药复方制剂的开发,同时寻找新型载药材料,以得到更好的发展。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘婵娟, 尹迎松, 陈四平. 中药靶向制剂研究进展 [J]. 承德医学院学报, 2011, 28(1): 70-72.
[2] 刘树民, 王秋月, 卢芳, 等. 中药引经药性理论溯本寻源与现代研究评述 [J]. 中草药, 2020, 51(19): 5099-5104.
[3] 唐颖楠, 夏新华. 中药肝靶向微球载药系统的研究进展 [J]. 中国药房, 2017, 28(1): 134-137.
[4] 李寒梅, 王瑶, 谢娜, 等. 胰岛素缓控释制剂的研究进展 [J]. 成都大学学报: 自然科学版, 2019, 38(3): 242-246.
[5] 冯立, 黄华. 肺靶向微粒的研究概况 [J]. 中国药业, 2006, 15(12): 1-2.
[6] 罗兰, 杨希, 林晓曦. 载药微球在肿瘤与非肿瘤疾病治疗中的应用 [J]. 组织工程与重建外科杂志, 2020, 16(4): 332-336.
[7] 王广生. 斑蝥素水解及去甲基对其泌尿系刺激的缓解 [J]. 中国药学杂志, 1983, 18(7): 18-19.
[8] Ma J, Teng H, Wang J,. A highly stable norcantharidin loaded lipid microspheres: Preparation, biodistribution and targeting evaluation [J]., 2014, 473(1/2): 475-484.
[9] 宋玉玲. 去甲斑蝥素壳聚糖肝动脉栓塞微球的研制 [D]. 苏州: 苏州大学, 2010.
[10] 楼一层, 王晨. 复方舒郁健脑脑靶向脂质体的制备及其在大鼠体内组织分布 [J]. 中国药师, 2011, 14(10): 1414-1416.
[11] Das S S, Hussain A, Verma P R P,. Recent advances in liposomal drug delivery system of quercetin for cancer targeting: A mechanistic approach [J]., 2020, 17(10): 845-860.
[12] Szebeni J, Baranyi L, Savay S,. Liposome-induced pulmonary hypertension: Properties and mechanism of a complement-mediated pseudoallergic reaction [J]., 2000, 279(3): H1319-H1328.
[13] Hong C, Liang J M, Xia J X,. One stone four birds: A novel liposomal delivery system multi-functionalized with ginsenoside Rh2for tumor targeting therapy [J]., 2020, 12(1): 1-18.
[14] Landesman-Milo D, Ramishetti S, Peer D. Nanomedicine as an emerging platform for metastatic lung cancer therapy [J]., 2015, 34(2): 291-301.
[15] 赵爽, 程学敏, 黎海娟, 等. 姜黄素干预中枢神经系统疾病生物学机制研究进展[J]. 中草药, 2016, 47(3): 512-518.
[16] 窦晓鑫, 杨玉莹, 卜志超, 等. 姜黄素逆转结直肠癌化疗耐药的药理作用机制研究进展[J]. 药物评价研究, 2020, 43(9): 1893-1897.
[17] Rachmawati H, Yanda Y L, Rahma A,. Curcumin-loaded PLA nanoparticles: Formulation and physical evaluation [J]., 2016, 84(1): 191-202.
[18] 洪峰, 周荣苹, 陈梦思. 疏水性姜黄素和IR780经纳米靶向载药系统改性后的肿瘤细胞联合杀伤性能研究 [J]. 中国中医药科技, 2020, 27(3): 384-389.
[19] Almutairi F M, El Rabey H A, Tayel A A,. Augmented anticancer activity of curcumin loaded fungal chitosan nanoparticles [J]., 2020, 155: 861-867.
[20] Negishi M, Irie A, Nagata N,. Specific binding of glycyrrhetinic acid to the rat liver membrane [J]., 1991, 1066(1): 77-82.
[21] 杨山麦, 周方成, 顾云娣, 等. 离体鼠肝细胞膜上甘草次酸和甘草酸受体的表达 [J]. 中华肝脏病杂志, 1999(S1): 27-29.
[22] 毛声俊, 侯世祥, 金辉, 等. 肝细胞靶向甘草次酸表面修饰脂质体的制备 [J]. 中国中药杂志, 2003, 28(4): 328-331.
[23] 吴超, 郭伟英, 张磊. 甘草次酸衍生物修饰去甲斑蝥素脂质体的制备及其小鼠肝靶向性实验研究 [J]. 中国药房, 2009, 20(28): 2184-2186.
[24] 张莉, 周建平, 姚静. 紫杉醇甘草次酸修饰透明质酸纳米粒的制备及性能研究 [J]. 中国药科大学学报, 2012, 43(3): 226-230.
[25] Li W J, Lu Y, Cheng Y,. Preparation of galactosylated curcumol liposomes [J]., 2020, 67(5): 874-879.
[26] Hasanpoor Z, Mostafaie A, Nikokar I,. Curcumin-human serum albumin nanoparticles decorated with PDL1 binding peptide for targeting PDL1-expressing breast cancer cells [J]., 2020, 159: 137-153.
[27] 张慧迪. 丹皮酚VEGF抗体修饰脂质体透皮制剂的制备及其抑瘢作用考察 [D]. 广州: 广东药科大学, 2018.
[28] 温然. 醒脑静共聚物修饰微乳有效成分药动学及脑靶向性研究 [D]. 北京: 北京中医药大学, 2014.
[29] Ozawa-Umeta H, Kishimoto A, Imaizumi A,. Curcumin β--glucuronide exhibits anti-tumor effects on oxaliplatin-resistant colon cancer with less toxicity[J]., 2020, 111(5): 1785-1793.
[30] Nasrollahi S, Golalizadeh L, Sajedi R H,. Substrate preference of amaltogenic amylase: A kinetic and thermodynamic analysis [J]., 2013, 60: 1-9.
[31] Roozbehi S, Dadashzadeh S, Mirshahi M,. Targeted anticancer prodrug therapy using dextran mediated enzyme-antibody conjugate and β-cyclodextrin-curcumin inclusion complex [J]., 2020, 160: 1029-1041.
[32] 马丽霞, 余兰. 磁性药物载体在抗肿瘤方面的研究进展 [J]. 药学研究, 2019, 38(4): 225-228.
[33] Shima, Damodaran P. Mesoporous magnetite nanoclusters as efficient nanocarriers for paclitaxel delivery [J]., 2020, 5(29): 9261-9268.
[34] Zhao M D, Li J Q, Chen F Y,. Co-delivery of curcumin and paclitaxel by “core-shell” targeting amphiphilic copolymer to reverse resistance in the treatment of ovarian cancer [J]., 2019, 14: 9453-9467.
[35] Lugert S, Unterweger H, Mühlberger M,. Cellular effects of paclitaxel-loaded iron oxide nanoparticles on breast cancer using different 2D and 3D cell culture models [J]., 2019, 14: 161-180.
[36] Wang X Q, Yang L P, Zhang H R,. Fluorescent magnetic PEI-PLGA nanoparticles loaded with paclitaxel for concurrent cell imaging, enhanced apoptosis and autophagy in human brain cancer [J]., 2018, 172: 708-717.
[37] Cardoso B D, Rodrigues A R O, Almeida B G,. Stealth magnetoliposomes based on calcium-substituted magnesium ferrite nanoparticles for curcumin transport and release [J]., 2020, 21(10): 3641.
[38] Low L E, Tan L T H, Goh B H,. Magnetic cellulose nanocrystal stabilized Pickering emulsions for enhanced bioactive release and human colon cancer therapy [J]., 2019, 127: 76-84.
[39] Halevas E, Mavroidi B, Nday C M,. Modified magnetic core-shell mesoporous silica nano-formulations with encapsulated quercetin exhibit anti-amyloid and antioxidant activity [J]., 2020, 213: 111271.
[40] Lin Z L, Ding J, Sun G P,. Application of paclitaxel-loaded EGFR peptide-conjugated magnetic polymeric liposomes for liver cancer therapy [J]., 2020, 40(1): 145-154.
[41] Feng Z Q, Yan K, Li J C,. Magneticparticles as a multifunctional drug delivery system for paclitaxel in efficient cancer treatment [J]., 2019, 104: 110001.
[42] Song Y, Sheng Z, Xu Y,. Magnetic liposomal emodin composite with enhanced killing efficiency against breast cancer [J]., 2019, 7(3): 867-875.
[43] 丁昂昂, 熊屏, 陈亚珠. 热敏脂质体(TSL)的研究进展 [J]. 复旦学报: 医学版, 2015, 42(2): 262-266.
[44] Dou Y N, Weersink R A, Foltz W D,. Custom-designed laser-based heating apparatus for triggered release of cisplatin from thermosensitive liposomes with magnetic resonance image guidance [J]., 2015(106): e53055.
[45] Riehemann K, Schmitt O, Ehlers E M. The effects of thermochemotherapy using cyclophosphamide plus hyperthermia on the malignant pleural mesothelioma[J]., 2005, 187(3): 215-223.
[46] 李成龙. 温敏聚合物(P(NIPAAm-DMAAm)-DSPE)修饰的紫杉醇脂质体的构建及药物控释研究 [D]. 青岛: 青岛科技大学, 2019.
[47] Hao Y L, Zhong T, Du R,. The cellular uptake and anti-tumor activity of conjugated linoleic acid-paclitaxelloaded iRGD-modified lysolipid-containing thermosensitive liposomes [J]., 2019, 28(2): 121-133.
[48] Ribeiro R F L, Ferreira R V, Pedersoli D C,. Cytotoxic effect of thermosensitive magnetoliposomes loaded with gemcitabine and paclitaxel on human primary breast cancer cells (MGSO-3 line) [J]., 2020, 22(7): 1-16.
[49] Zheng J X, Bai C Q, Peng H L,. Thermosensitive magnetoliposome - novel carrier for targeted delivery and triggered release of coix seed oil [J]., 2020, 497: 166012.
[50] Deng Y Q, Huang H Y, Chen M X,. Comprehensive effects of near-infrared multifunctional liposomes on cancer cells [J]., 2020, 25(5): 1098.
[51] 陈珊, 张庭瑜, 杨梅, 等. pH敏感纳米药物载体在肿瘤治疗中的应用研究 [J]. 生命的化学, 2020, 40(3): 358-368.
[52] 刁雨辉, 霍美蓉, 吕霖, 等. 两亲性壳聚糖包覆紫杉醇脂质体的制备及体外释放研究 [J]. 药学与临床研究, 2012, 20(6): 490-494.
[53] Ru D, Ding C H, Liu L,. pH sensitive triptolide-loaded liposome calcium phosphate nanoparticles exhibit enhanced anti-tumor activities against ovarian cancer without damaging the reproductive system [J]., 2017, 13(11): 1413-1424.
[54] Low P S, Antony A C. Folate receptor-targeted drugs for cancer and inflammatory diseases [J]., 2004, 56(8): 1055-1058.
[55] Monteiro L O F, Fernandes R S, Castro L,. Paclitaxel-loaded folate-coated pH-sensitive liposomes enhance cellular uptake and antitumor activity [J]., 2019, 16(8): 3477-3488.
[56] 刘小芳, 吴仪君, 石玮玮, 等. 叶酸壳聚糖姜黄素pH敏感脂质体的制备及靶向性研究 [J]. 中国新药杂志, 2018, 27(19): 2315-2321.
[57] Nunes S S, Fernandes R S, Cavalcante C H,. Influence of PEG coating on the biodistribution and tumor accumulation of pH-sensitive liposomes [J]., 2019, 9(1): 123-130.
[58] Tang M T, Svirskis D, Leung E,. Can intracellular drug delivery using hyaluronic acid functionalised pH-sensitive liposomes overcome gemcitabine resistance in pancreatic cancer? [J]., 2019, 305: 89-100.
[59] Sybachin A V, Lokova A Y, Spiridonov V V,. The effect of cationic polylysine on the release of an encapsulated substance from pH-sensitive anionic liposomes [J]., 2019, 61(3): 308-316.
[60] 余巧, 冯白茹, 申茹, 等. 半夏泻心结肠靶向片的制备及其体外释放行为 [J]. 中成药, 2019, 41(10): 2290-2295.
Research progress on targeted preparations of traditional Chinese medicine
JIANG Yuan-qi1, DONG Yu-jie1, CHEN Jin-peng2, 3, 4, LIU Yi2, 3, 4, ZHOU Fu-jun2, 3, 4, TIAN Cheng-wang2, 3, 4, CHEN Chang-qing2
1. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China 2. Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 3. Tianjin Key Laboratory of Quality Marker of Traditional Chinese Medicine, Tianjin 300462, China 4. State Key Laboratory of Drug Delivery and Pharmacokinetics, Tianjin 300462, China
Targeted preparations are also called targeted drug delivery systems, which concentrate the drug on the lesion and keep the drug at a certain concentration for a period of time at the target site, thereby reducing the dosage. To a certain extent, they can reduce the occurrence of adverse drug reactions and improve the safety of drugs and the compliance of patients with medication. Therefore, targeted preparations are widely concerned in the field of pharmacy. The related research on the application of Chinese medicine targeted preparations in recent years are reviewed in this article. The research progress on targeted preparations of traditional Chinese medicine is described from three aspects of passively targeted formulations, active targeted formulations, physical and chemical targeted formulations of traditional Chinese medicine, aiming to provide a reference for the application research of targeted preparation technology in Chinese medicine targeted preparations.
traditional Chinese medicine; preparation; active ingredient; targeted drug delivery system; targeted preparation; application
R283.3
A
0253 - 2670(2021)04 - 1156 - 09
10.7501/j.issn.0253-2670.2021.04.030
2020-09-23
国家重点研发计划项目(2018YFC170810203);重大新药创制专项(2019ZX09201-005)
蒋沅岐(1995—),女,硕士研究生。Tel: 15128169386 E-mail: yuanqi_jiang@163.com
田成旺 E-mail: tiancw@tjipr.com
陈常青 E-mail: chencq@tjipr.com
[责任编辑 崔艳丽]
