强力脑清素片HPLC指纹图谱的建立及质量标志物预测
2021-02-25倪术仁连云岚赵思俊李民生郭景文
倪术仁,连云岚,赵思俊,李民生,郭景文*
强力脑清素片HPLC指纹图谱的建立及质量标志物预测
倪术仁1,连云岚2,赵思俊2,李民生2,郭景文2*
1. 山西中医药大学,山西 晋中 030619 2. 山西省食品药品检验所,山西 太原 030031
建立强力脑清素片(Qiangli Naoqingsu Tablets,QNT)的HPLC指纹图谱,为其有效质量控制提供参考。建立QNT的HPLC指纹图谱,测定采用Agilent C18色谱柱,检测波长为220 nm;流动相为乙腈-水溶液,梯度洗脱。利用中药色谱指纹图谱相似度评价系统建立强力脑清素片的HPLC指纹图谱,确定共有峰并进行相似度评价;基于指纹图谱共有峰峰面积测定结果,采用聚类分析和主成分分析(PCA)等化学计量学方法对不同批次的强力脑清素片进行质量评价;采用网络药理学筛选和分析QNT相关的作用靶点和通路,构建“成分-靶点-网络”预测QNT中潜在的质量标志物(Q-Marker)。QNP HPLC指纹图谱确认了11个共有峰,指认6个共有峰,分别为刺五加浸膏中紫丁香苷、异嗪皮啶、刺五加苷E;五味子流浸膏中五味子醇甲、五味子甲素、五味子乙素。15批QNT片样品相似度均大于0.95,相似度良好;15批QNT聚类为5类;主成分1~5是影响QNP质量评价的主要因子。通过网络药理学筛选出5个活性成分为紫丁香苷、刺五加苷E、异嗪皮啶、五味子醇甲、五味子甲素;32个核心靶点分别为CA14、KIT、KDR、HPY5R、EGFR、MMP13等和13条关键通路为ErbB信号通路、Rap1信号通路、含血清素的神经突触等;基于Q-Marker“五原则”分析预测紫丁香苷、刺五加苷E、异嗪皮啶、五味子甲素、五味子醇甲为潜在的Q-Marker。通过指纹图谱和网络药理学分析预测QNT中的Q-Marker,所建立的方法操作便捷、结果准确、重复性好,可用于QNT的质量控制和评价,为全面控制QNT的质量提供依据,为进一步研究QNT的作用机制提供参考。
强力脑清素片;HPLC;指纹图谱;相似度;聚类分析;主成分分析;中药质量标志物;网络药理学;成分-靶点-网络;质量标志物(Q-Marker);紫丁香苷;异嗪皮啶;刺五加苷E;五味子醇甲;五味子甲素;五味子乙素
强力脑清素片(Qiangli Naoqingsu Tablets,QNT)是山西省亚宝药业集团股份有限公司自主研发生产的独家品种,该品种由中药刺五加提取物刺五加浸膏、五味子提取物五味子流浸膏、鹿茸提取物鹿茸精配伍而成的中药成方制剂,适应症有脾肾两虚、心神失养引起的心悸失眠、食欲不振、神疲乏力、尿频阳痿、神经衰弱、非器质性性功能衰退及妇女更年期综合症等。目前,QNT收录于卫生部中药成方制剂十七册(1998年),标准中仅收录对刺五加薄层色谱检验,且方法重现性低,未能全面整体控制质量。虽有临床报道但是作用机制尚不明确,这对于QNT治疗更年期综合征临床定位、药效学研究及产品二次开发提出了挑战。根据国家目前对于医药行业的高度重视以及本着对人民安全用药问题的关心,药品的质量控制势在必行。
中药指纹图谱作为中药材真伪鉴别、中药及中药制剂质量控制的有效手段,已成为国内外广泛接受的中药质量评价模式[1]。中药指纹图谱是一种综合的、可量化的鉴定手段,具有整体性和模糊性的特点,能够反映中药外表特征及其制剂内在质量的稳定性和均一性,得到的能够标示该中药材及中药制剂特性的共有峰的图谱,突出中药材及中药制剂的完整面貌[2-5]。目前,模式识别方法在指纹图谱等多维数据分析中有很大优势,也是其重要的分析手段[6-8]。其中聚类分析与主成分分析(PCA)法广泛应用于鉴定与样品分类研究中[9-10]。中药指纹图谱法一般采用相似度评价,可同时采用PCA,根据PCA得到各成分的贡献率,验证指纹图谱方法,对其质量进行评价。中药材与中药复方制剂所含成分较多,具有多成分、多靶点、多通路的特点,导致研究其作用机制比较困难。网络药理学走在研究中药的前沿,主要融合了系统性生物学及多向药理学的思想,从多种角度探索药物与疾病的关联,强调从药物、靶点与疾病间相互作用的整体性和系统性出发,有助于反映及阐释中药的活性成分与靶点之间的作用关系[11-12]。目前,对指纹图谱标志成分的科学性证明很少,采用网络药理学技术验证的几乎没有,故将中药指纹图谱和网络药理学这2种方法的结合是除实验验证以外最好的解决方案,为类似的研究提供新的思路,打破以往理化分析与药理研究相脱节的问题。
1 仪器与材料
1.1 仪器
Agilent1260型高效液相色谱,安捷伦科技有限公司;MS204S型1/10万电子分析天平、XSE105DU型千分之一分析天平,梅特勒托利多仪器有限公司;LC-350A超声仪,济宁市中区鲁超仪器厂。
1.2 试药
对照品五味子醇甲(批号110875-201412,质量分数99.4%)、五味子甲素(批号110764-201915,质量分数99.5%)、五味子乙素(批号110765- 201813,质量分数99.1%)、紫丁香苷(批号11574- 201605,质量分数95.2%)、刺五加苷E(批号111713- 201804,质量分数97.9%)、异嗪皮啶(批号110837- 201608,质量分数100%)均购于中国食品药品检定研究院。15批(批号190303、190203、181103、190404、190801、190804、190901、190906、191205、200201、200301、200302、200401、200402、200403,编号S1~S15)QNP样品,山西省亚宝药业有限公司提供。
五味子、刺五加药材,均来自亳州市亳东药业有限公司,经山西省食品药品检验所郭景文主任药师鉴定,五味子为木兰科五味子属植物五味子(Turcz.) Baill.的干燥成熟果实,刺五加为五加科五加属植物刺五加(Rupr. et Maxim.) Harms的干燥根和根茎或茎;五味子流浸膏,批号191101,山西亚宝药业有限公司;刺五加浸膏,批号20200101,黑龙江林海雪原药业有限公司。
1.3 试剂
甲醇,分析纯,国药集团化学试剂有限公司;纯化水;乙腈,色谱纯,北京迪科马科技有限公司。
2 方法与结果
2.1 色谱条件
色谱柱为Agilent-C18柱(250 mm×4.6 mm,5 μm);体积流量1.0 mL/min;检测波长220 nm;柱温30 ℃;进样量10 μL;流动相为水-乙腈,梯度洗脱:0~10 min,8%乙腈;10~50 min,8%~21%乙腈;50~55 min,21%~24%乙腈;55~60 min,24%~35%乙腈;60~65 min,35%~40%乙腈;65~70 min,40%~45%乙腈;70~75 min,45%~50%乙腈;75~90 min,50%~54%乙腈;90~95 min,54%~58%乙腈;95~105 min,58%~62%乙腈;105~120 min,62%~75%乙腈。
2.2 对照品溶液的制备
分别取五味子醇甲、五味子乙素、五味子甲素、紫丁香苷、刺五加苷E、异嗪皮啶对照品适量,精密称定,加甲醇分别制成分别含五味子醇甲20 μg/mL、五味子醇乙19 μg/mL、五味子甲素21 μg/mL、紫丁香苷22 μg/mL、刺五加苷E 16 μg/mL、异嗪皮啶40 μg/mL的混合对照品溶液。
2.3 供试品溶液的制备
取QNP适量,除去包衣,研细,取1 g,精密称定,置具塞锥形瓶中,精密加甲醇50 mL,密塞,称定质量,超声处理(功率250 W、频率50 kHz)30 min,放冷,称定质量,用甲醇补足减失的质量,摇匀,0.45微孔滤膜滤过,弃初滤液,即得QNT供试品溶液。
取五味子药材、刺五加药材、五味子流浸膏、刺五加浸膏适量,按照QNT供试品溶液制备方法制备各药材溶液。
根据处方药味称取缺五味子流浸膏的其他药材及缺刺五加浸膏的其他药材,按比例加辅料搅拌均匀,按照供试品溶液制备方法制备阴性样品供试品溶液。
2.4 方法学考察
2.4.1 参照峰选择 刺五加浸膏是QNT的君药,紫丁香苷是刺五加浸膏的主要成分之一,化学性质稳定,峰面积大,色谱峰保留时间稳定,故选择紫丁香苷作为参照峰,计算各共有峰的相对峰面积和相对保留时间。
2.4.2 精密度试验 取QNT,按“2.3”项下方法制备同一供试品溶液(S1),按“2.1”项下色谱条件连续进样6次,计算共有峰相对峰面积和相对保留时间。结果显示共有峰的相对峰面积RSD<0.8%,相对保留时间RSD<0.10%,表明仪器精密度良好。
2.4.3 稳定性试验 取QNT,按“2.3”项下方法制备同一供试品溶液(S1),分别于0、2、4、8、12、18、24、72 h进样,按“2.1”项下色谱条件进样测定,计算共有峰相对峰面积和相对保留时间。结果显示共有峰的相对峰面积RSD<1.0%,相对保留时间RSD<0.50%,表明QNT供试品溶液于室温下放置72 h稳定性良好。
2.4.4 重复性试验 取同一批次样品(S1),按“2.3”项下方法平行制备9份供试品溶液,按“2.1”项下色谱条件进样测定,计算共有峰相对峰面积和相对保留时间。结果显示共有峰的相对峰面积RSD<1.1%,相对保留时间RSD<1.1%,表明该方法重复性良好。
2.5 指纹图谱的建立与相关性分析
2.5.1 QNT指纹图谱的建立 取QNT 15批,按按照“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定。通过中药色谱指纹图谱相似度评价系统软件(2012年版),以批号190303样品图谱为参照图谱,采用中位数法,得到15批QNT的指纹图谱,见图1。
2.5.2 QNT相似度分析 将15批QNT的指纹图谱均导入中药色谱指纹图谱相似度评价系统软件(2012版),计算相似度,结果S1~S15样品的相似度分别为0.996、0.995、0.999、0.995、0.996、0.993、0.995、0.994、0.990、0.995、0.993、0.986、0.996、0.988、0.987。15批QNT的指纹图谱相似度均>0.95,表明QNT质量均一稳定。
2.5.3 共有峰的指认及相关分析 使用指纹图谱分析结果,将对照品、QNT样品的指纹图谱进行叠加,分别指认成分,使用指纹图谱分析结果,将QNT、对照品、中间体和阴性样品的指纹图谱进行叠加见图2、3。采用对照品指认出6个共有峰,结果见表1。由表1可知,QNT中存在共有峰6个。
2.5.4 QNT聚类分析 以不同批号QNT的11个共有峰峰面积为原始数据,Origin 9软件对QNT样品进行系统聚类分析,采用组间平均数连结,以夹角余弦为样品相似度的距离公式,聚类分析见图4。由图4可知,QNT样品被分为5大类,I类包括190404;II类包括200302、200402、200403;III类包括200201、200401;IV类包括191203、190901、190906、190801、190804、190303、191205;V类包括181103、200301。结果表明,QNT从共有峰相对峰面积来看,I类相对于其他4类五味子醇甲、五味子甲素、五味子乙素相对峰面积极小;II类相对峰面积基本一致;III类五味子甲素相对峰面积小;IV类五味子乙素相对峰面积小;V类五味子在甲素的相对峰面积相对于III类小。
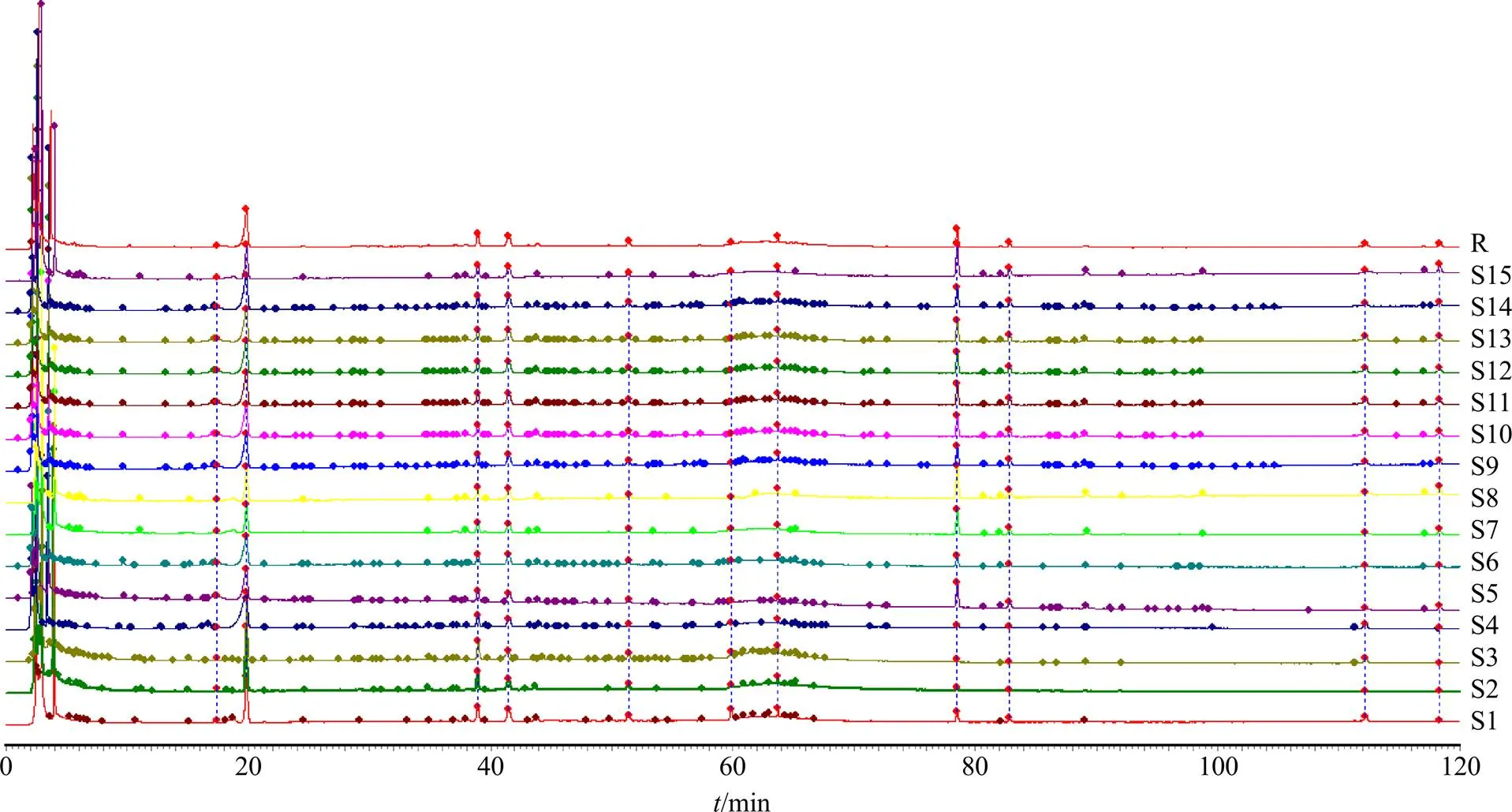
图1 15批QNT样品的指纹图谱
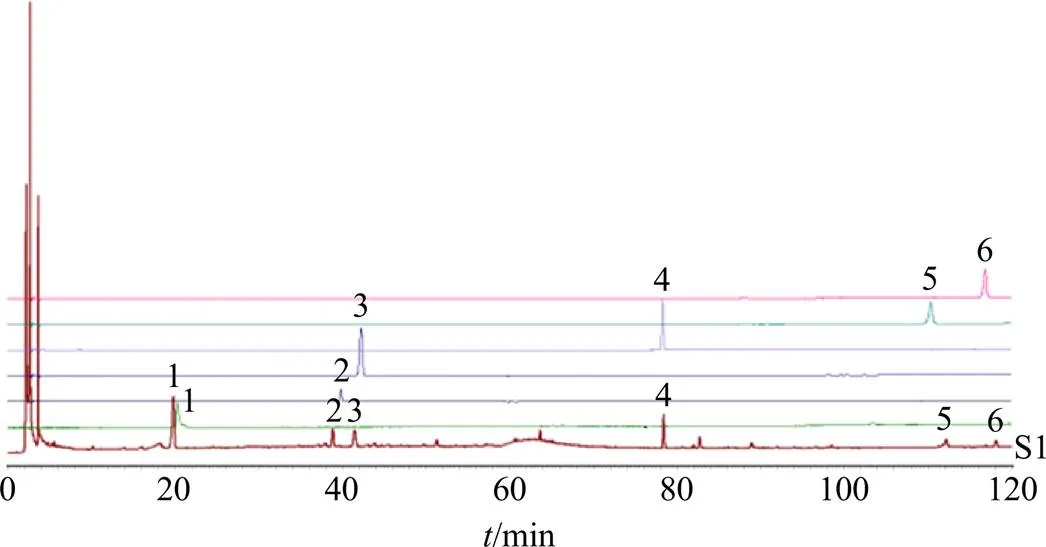
1-紫丁香苷 2-刺五加苷E 3-异嗪皮啶 4-五味子醇甲 5-五味子甲素 6-五味子乙素 S1-样品(190303)
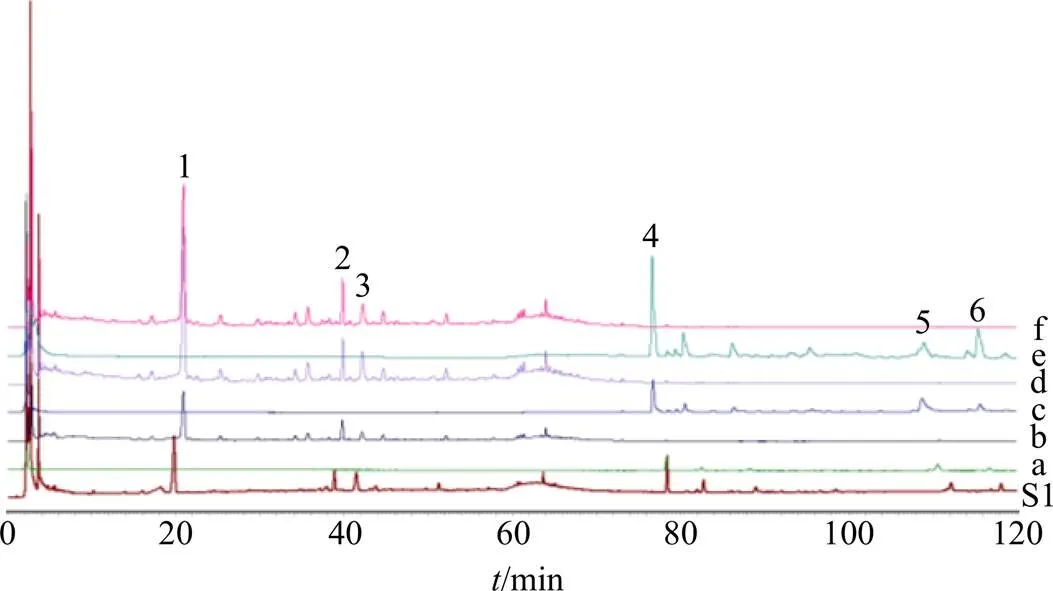
S1-样品(190303) a-五味子流浸膏 b-刺五加浸膏 c-五味子药材 d-刺五加药材 e-刺五加浸膏阴性样品 f-五味子流浸膏阴性样品
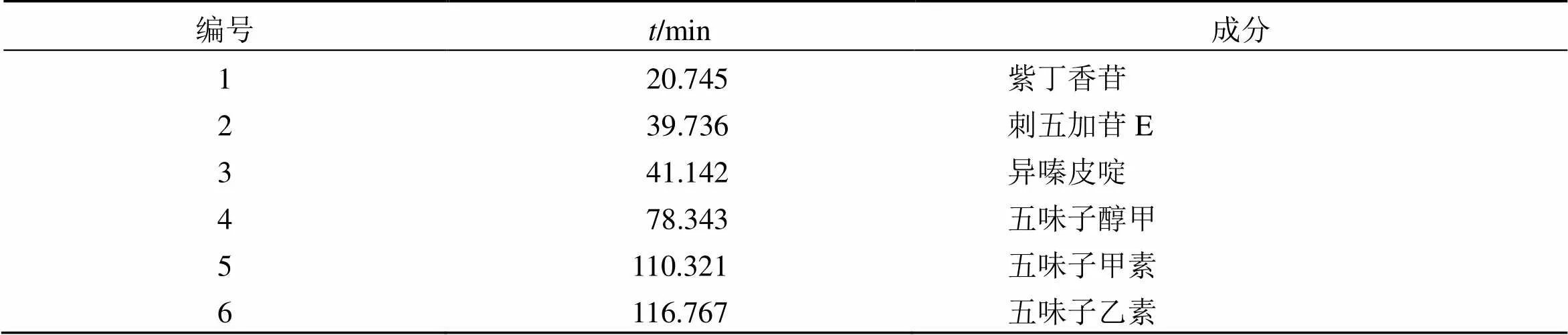
表1 QNT指纹峰指认

图4 聚类分析树状图
通过结果分析各批次的样品中紫丁香苷、异嗪皮啶、刺五加苷E相对峰面积差异性极小,五味子流浸膏中的有效成分相对峰面积5类差异性大。进一步与企业调研核实与制剂所用原药材产地来源、采收季节以及原药材批间质量差异等有关。通过聚类分析发现,QNT各批号的样品之间的相关性与相似度分析结果较为一致。
2.5.5 QNT共有峰PCA PCA法是一种应用广泛的多元统计方法,用以简化数据,快速实现模式或关系的可视化识别[13]。SPSS 19.0软件对原始数据进行标准化处理,以主成分的特征值及贡献率为依据,对15批不同批次的QNT的11个共有峰(变量)进行PCA,结果见表2。由表2可知,主成分个数的提取原则为其对应的特征值大于1,故提取前5个(A1~A5)作为主成分,其累计贡献值达到88.05%,其中第1主成分(紫丁香苷)贡献率24.183%;第2成分(刺五加苷E)贡献率21.557%;第3主成分(异嗪皮啶)的贡献率19.537%;第4主成分(五味子醇甲)的贡献率12.996%;第5主成分(五味子甲素)的贡献率9.799%,所以选这5个主成分进行评价QNT的质量,它代表了待研究中药成方制剂中有效成分含量的88.05%的信息量。
2.6 网络药理学预测结果
2.6.1 化合物-靶点预测 通过检索中药系统药理学数据库及分析平台TCMSP、BAT MAN-TCM、Pub Chem、Swiss Target Predict中紫丁香苷、刺五的32个靶点,利用候选化合物与靶点的关系构建的化合物-靶点网络(图5)。

表2 PCA特征值
2.6.2 蛋白-蛋白相互作用(PPI)网络构建 将筛选出的112个靶点,导入STRING(https:// string-db. org/)进行PPI网络分析,选择物种“Homo sapiens”,蛋白交互评分参数评分值>0.7,隐藏无关联的节点,得到的蛋白-蛋白相互作用网络图(图6),结果共获得31个节点,39个边。
2.6.3 GO功能富集分析和KEGG通路富集分析为了进一步阐释候选靶点的可能作用,用DAVID软件(https://david.ncifcrf.gon/)将网络合并后获取的核心蛋白靶点进行GO分析,进一步对核心蛋白加苷E、异嗪皮啶、五味子醇甲、五味子甲素5个候选化合物的作用靶点,共得到与5个化合物相关靶点基因进行KEGG基因与信号通路富集分析,相关信息见图7、8。

图5 化合物-靶点网络图

图6 核心靶点PPI网络
2.6.4 成分-靶点-通路网络构建 根据筛选得到的5个成分、23个靶点和13条通路,运用Cytoscape 3.6.1软件构建“成分-靶点-通路”网络图,结果见图9将相互作用关系整合并导入Cytoscape 3.6.1中,并可视化得到“成分-靶点-通路”网络图,如图8所示。根据Cytoscape 3.6.1软件对网络图进行分析,以化合物、靶点蛋白、信号通路的连接度为参考,发现紫丁香苷、刺五加苷E、异嗪皮啶、五味子醇甲、五味子甲素的连接度相对比较高,均可能是QNT发挥药效的活性物质;PRKCA、EGFR、GSK3B、BRAF、PIK3CA、ERBB2、SRC、MET靶点的连接度比较高,可能是QNT发挥作用的关键靶点;13条信号通路连接差异性不大,可能是QNT的关键信号通路。

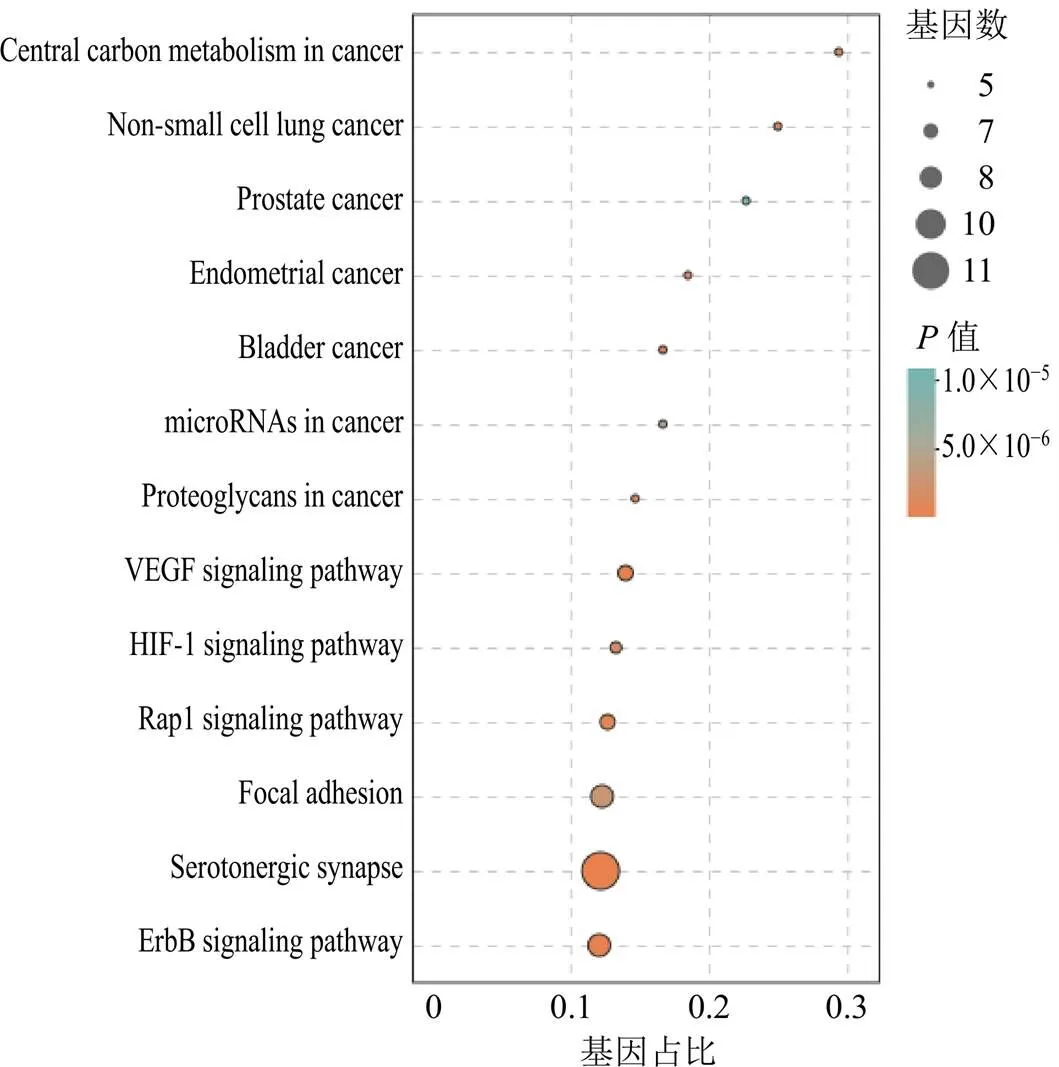
图8 KEGG富集通路分析结果
结合筛选结果单独的活性成分可能只针对某一节点,而2种或以上的组合能产生协同作用,可能针对的是整个网络。在中药质量标准研究制定技术要求中含量测定的测定指标一般为根据中药的功能主治或活性实验结果选择出的活性成分,而QNT的功能主治为心神失养、脾肾两虚,临床上治疗更年期综合征,同时本研究所测定的5活性成分为度值较高同时在网络药理学研究中常见且易获取的成分,故选其为含量测定指标,在一定程度上更具有代表性。
4 讨论
中药质量是中药产业发展的生命线,但目前中药质量研究方面存在的诸多问题,在一定程度上制约了中药产业的健康与可持续发展。为提升我国中药产品质量和质量控制水平,刘昌孝院士提出中药质量标志物(Q-marker)概念[14]。中药质量标志物是存在于中药材和中药产品(如中药饮片、中药煎剂、中药提取物、中成药制剂)中固有的或加工制备过程中形成的、与中药的功能属性密切相关的化学物质,具有传递性和溯源性。传递性与追溯性贯穿于药材到产品的整个过程,必须受到密切关注,建立质量标准能够推动传递性和追溯性的研究[15]。

图9 “成分-靶点-通路”网络
刺五加主治脾肾阳虚、腰膝酸软、体虚乏力、失眠多梦、食欲不振,刺五加可增强机体的适应性,提高机体免疫力,具有抗癌作用,且本身几乎无毒性,长期用药不会出现不良反应[16-17]。紫丁香苷、刺五加苷E、异嗪皮啶是从刺五加中分离得到的苯丙素类、木脂素类及香豆素类化合物,具有不同的化学结构,具有抗肿瘤、抗氧化、抗疲劳等广泛的药理活性,是刺五加发挥药效作用的物质[18-19]。五味子为木兰科五味子属植物五味子(Turcz.) Baill.的干燥成熟果实。习称“北五味子”[20]。五味子中五味子醇甲、五味子甲素、五味子乙素具有改善记忆,保护受损细胞,镇静催眠作用[21-22]。
本实验在优化供试品溶液制备方式时,以QNT样品色谱图中色谱峰数量、分离效果以及定量测定目标成分紫丁香苷、刺五加苷E、异嗪皮啶、五味子醇甲、五味子甲素、五味子乙素,综合提取率为指标,显示以甲醇为提取溶剂超声提取时出峰较多,色谱峰分离效果较佳。
在优化色谱条件时,首先对比考察了0.2%磷酸水-30%乙腈与乙腈-水流动相系统,结果乙腈-水流动相系统优于0.2%磷酸水- 30%乙腈,最终确定以乙腈-水为流动相进行梯度洗脱时,色谱图基线平稳,峰形较好,分离度较高。成方制剂中鹿茸精由于无法通过高效液相色谱法测定,后期将采用薄层色谱法对其进行实验,填补目前国内外对鹿茸精的研究空白。
综上所述,初步预测紫丁香苷、异嗪皮啶、刺五加苷E、五味子醇甲、五味子甲素为QNT潜在的Q-Marker。指纹图谱采用相似度评价、聚类分析和PCA 3种方法评价,结果显示PCA与指纹图谱技术相结合可以综合评价中药饮片的质量优劣及中药成方制剂质量控制,避免了以单一成分含量来评价饮片质量好坏的弊端。
本实验所建立的指纹图谱是科学有效的,通过对QNT潜在Q-Marker的预测,为提升相关药物质量控制水平提供系统的科学数据,为中药质量标志物的量化评价与分级辨识提供了创新思路与方法,为有力提升中药质量控制水平提供重要的理论与方法支撑,为后期深入研究QNT的作用机制提供参考,也为QNT的质量控制提供了更全面的参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 罗国安, 王义明, 曹进, 等. 建立我国现代中药质量标准体系的研究 [J]. 世界科学技术—中药现代化, 2002, 4(4): 5-11.
[2] 祁航, 谢涛, 吕东峰, 等. 玉泉丸HPLC指纹图谱的建立及6个成分定量分析 [J]. 中草药, 2019, 50(23): 5753-5759.
[3] Gao S M, Liu J S, Wang M,. Quantitative and HPLC fingerprint analysis combined with chemometrics for quality evaluation ofprocessed with different methods [J]., 2019, 11(2): 160-168.
[4] 吴建雄, 秦建平, 刘峰, 等. 坤宁颗粒的HPLC指纹图谱研究 [J]. 现代药物与临床, 2020, 35(3): 447-449.
[5] 李文兵, 许玲, 卢君蓉, 等. 基于HPLC指纹图谱的枇杷叶蜜炙前后标准汤剂质量控制研究 [J]. 中草药, 2020, 51(13): 3444-3450.
[6] 王璠, 欧阳臻, 郭兰萍, 等. 苍术综合化学模式识别 [J]. 中国中药杂志, 2014, 39(13): 2536-2541.
[7] 沈莉, 赵燕燕, 谢洪平, 等. 升麻的1H-NMR指纹图谱-模式识别研究 [J]. 中国中药杂志, 2013, 38(2): 217-222.
[8] 张越, 陈健, 李洋, 等. 经典名方温经汤标准汤剂HPLC指纹图谱建立及9种成分含量测定 [J]. 中草药, 2020, 51(18): 4664-4672.
[9] 吴伟建, 王燕, 王斌, 等. 基于聚类、主成分和判别分析的海龙红外指纹图谱研究 [J]. 中国药学杂志, 2013, 48(18): 1540-1545.
[10] 高森, 王苹, 唐铖, 等. 基于HPLC指纹图谱、多指标成分含量测定及化学计量学的湿热痹片质量评价 [J]. 中草药, 2020, 51(21): 5454-5461.
[11] 谢培山. 中药色谱指纹图谱鉴别的概念、属性、技术与应用 [J]. 中国中药杂志, 2001, 26(10): 653-655.
[12] 张慧, 陈燕, 汪佳楠, 等. 指纹图谱技术在中药配方颗粒质量评价及过程控制中的应用 [J]. 中国中药杂志, 2018, 43(19): 3822-3827.
[13] 周文霞, 程肖蕊, 张永祥. 网络药理学: 认识药物及发现药物的新理念 [J]. 中国药理学与毒理学杂志, 2012, 26(1): 4-9.
[14] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[15] 张铁军, 许浚, 韩彦琪, 等. 中药质量标志物(Q- marker)研究: 延胡索质量评价及质量标准研究 [J]. 中草药, 2016, 47(9): 1458-1467.
[16] 李庆勇, 付玉杰, 吕欣, 等. 超声波法提取刺五加() 中丁香甙的研究[J]. 植物研究, 2003, 23(2): 182-184.
[17] 曹先兰, 李珠莲. 刺五加国外实验研究[J]. 中草药, 1980, 11(6): 277-281.
[18] 叶红军, 吴远, 房家智, 等. 刺五加皂甙对胃癌细胞膜电位和亚细胞结构的影响 [J]. 中华消化杂志, 2002, 22(1): 48-49.
[19] 张玥秀, 吴兆华, 高慧援,等. 刺五加茎叶化学成分的分离与鉴定 [J]. 沈阳药科大学学报, 2010, 27(2): 110-112.
[20] 史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展[J]. 药物评价研究, 2011, 34(3): 208-212.
[21] Zhu H, Zhang L, Wang G,. Sedative and hypnotic effects of supercritical carbon dioxide fluid extraction fromin mice [J]., 2016, 24(4): 831-838.
[22] Sowndhararajan K, Deepa P, Kim M,. An overview of neuroprotective and cognitive enhancement properties of lignans from[J]., 2017, 97: 958-968.
Establishment of fingerprint and Q-marker prediction of Qiangli Naoqingsu Tablets
NI Shu-ren1, LIAN Yun-lan2, ZHAO Si-jun2, LI Min-sheng2, GUO Jing-wen2
1. Shanxi University of Traditional Chinese Medicine, Jinzhong 030619, China 2. Shanxi Institute of Food and Drug Control, Taiyuan 030031, China
To study the fingerprint of Qiangli Naoqingsu Tablets (QNT, 强力脑清素片) and provide reference for its effective quality control.The fingerprint of QNT was determined by HPLC using Agilent C18column at the detection wavelength of 220 nm. The mobile phase was acetonitrile-water solution with gradient elution. The HPLC fingerprint of QNT was established by using the Similarity Evaluation System for Chromatographic Fingerprint of TCM. Based on the results of common peak area determination of fingerprint, the quality of different batches of QNT was evaluated by the stoichiometric method such as cluster analysis and principal component analysis (PCA). Network pharmacology was used to screen and analyze QNT-related targets and pathways, and “component-target-network” was constructed to predict the potential Q-marker in QNT.Eleven common peaks and six common peaks were identified by HPLC fingerprint, namely syringin, isofraxidin, and eleutheroside E inextract, schisandrol, schizandrin A, and schisandrin B influid extract. The similarity of 15 batches of QNT was greater than 0.95, and the similarity was good. Fifteen batches of QNT were clustered into five types. Principal components 1—5 were the main factors affecting the quality evaluation of QNT.Five active components were screened including syringin, isofraxidin, eleutheroside E, schisandrol, and schizandrin A; The 32 core targets were CA14, KIT, KDR, HPY5R, EGFR, MMP13 and so on; And the 13 key pathways were ErbB signaling pathway, RAP1 signaling pathway, serotonin-containing synapse, etc. Based on the “Five Principles” of Q-marker, the analysis and prediction of syringin, acanthopyrin E, isofraxidin, schisandrol, and schizandrin A were potential Q-markers.Q-marker in QNT is predicted by fingerprint and network pharmacology analysis, which provides basis for the overall control of QNT quality and provides reference for further research on the mechanism of action of QNT.
Qiangli Naoqingsu Tablets; HPLC; fingerprints; similarity; cluster analysis; principal component analysis; quality markers of traditional Chinese medicine; network pharmacology; component-target network; Q-marker; syringin; isofraxidin; acanthopyrin E; schisandrol; schizandrin A; schisandrin B
R286.02
A
0253 - 2670(2021)04 - 1011 - 09
10.7501/j.issn.0253-2670.2021.04.013
2020-09-12
国家药典委员药品标准制修订研究课题(2019Z061)
倪术仁(1993—),女,研究生,研究方向为中药分析与质量控制。Tel: 18435170856 E-mail: 18435170856@163.com
郭景文,本科,主任药师,研究方向为中药标准研究与持续提高。Tel: (0351)2026057 E-mail: guojw2009@126.com
[责任编辑 郑礼胜]
