TCF21缺失表达对卵巢癌恶性生物学行为的影响
2021-02-24闻洪丽
贾 莉,闻洪丽
重庆市中医院妇科,重庆 400021
卵巢癌是指包括病因学、分子生物学和许多其他特征均不同的一系列异质性恶性肿瘤,是最常见的妇科恶性肿瘤之一,仅次于宫颈癌和子宫内膜癌,其恶性程度最高,病死率也最高[1]。90%的卵巢癌来源于卵巢上皮,最常见的是浆液性癌。大多数浆液性卵巢癌在诊断时已为Ⅲ期(51%)或Ⅳ期(29%),其5年病因特异性存活率分别为42%和26%[2]。转录因子21(TCF21)是SMITH等依据染色体杂合性缺失的定位研究在人染色体6q23~6q24上发现的新的肿瘤抑癌基因,它是碱性螺旋-环-螺旋家族的一个转录因子,其高表达在器官的间质细胞中,比如肺、肾、肠、心脏及肾脏的肾小球上皮细胞。TCF21在多种肿瘤中因存在启动子区异常甲基化而导致其在不同肿瘤组织中表达缺失,比如透明细胞肾癌、乳腺癌、肺癌、头颈部肿瘤、胃癌、膀胱癌等[3-4]。有研究表明,TCF21能够对细胞的增殖、凋亡、迁移及侵袭产生抑制作用[5],但在卵巢癌中的研究极少。因此,本研究分析了TCF21在卵巢癌中的表达及临床意义,同时通过在人卵巢癌HEY细胞中过表达TCF21和体内外试验验证其对卵巢癌细胞恶性生物学行为的影响,进一步探讨其作为候选生物标志物在卵巢癌的治疗中的意义。
1 材料与方法
1.1材料
1.1.1主要试剂 反转录及PCR试剂盒、PCR引物购于Takara公司;TCF21过表达慢病毒载体由上海吉凯基因公司合成并构建;免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司;蛋白提取试剂盒购自碧云天生物技术公司;兔抗人TCF21抗体及小鼠抗人GAPDH抗体均购自Abcam公司。
1.1.2组织标本 所有组织标本来源于2017年1月至2018年12月本院妇科手术患者,均签署知情同意书且病理诊断证实为高级别低分化浆液性卵巢癌,术前均未接受过放疗和化疗;卵巢癌HEY细胞株为重庆市肿瘤医院实验研究中心赠送。
1.2方法
1.2.1细胞及细胞培养 HEY卵巢癌细胞株用完全培养基(含10%胎牛血清的RPMI-1640)在37 ℃、5% CO2条件下培养。
1.2.2慢病毒转染并筛选稳定株 将细胞分为两组:第1组为转染Lenti-TCF21组(过表达组),第2组为转染空载体病毒组(空载体组)。转染流程按照上海吉凯基因公司说明书执行。根据实时荧光定量聚合酶链反应(qRT-PCR)结果选取较低表达呈对数生长期的HEY细胞(5×104/mL)加入6孔板,于37 ℃孵育箱培养12 h贴壁后,感染复数为30,转染72 h后荧光最强,收集此时的细胞用2.5 mg/mL嘌呤霉素处理,1周后筛选稳定表达株。将细胞稳定表达株分为HEY阴性对照组(HEY NC)和HEY TCF21过表达组(HEY TCF21)。
1.2.3细胞株氮杂胞苷(Aza)处理 所有野生型细胞株均经过10 mmol/L的5-Aza处理72 h后提取mRNA,保存于-80 ℃待后续试验。
1.2.4荧光定量PCR 本研究采用Takara公司的Trizol试剂、cDNA二步法反转录试剂盒和Takara SYBR Green Ⅰ试剂盒提取组织和细胞株总RNA,然后按照反转录试剂盒说明书合成cDNA。使用Takara公司的SYBR®Premix Ex TaqTMⅡ进行荧光定量PCR检测TCF21 mRNA的表达,以GAPDH作为内参。TCF21上游引物为5′-TCCTGGCTAACGACAAATACGA-3′,下游引物为5′-TTTCCCGGCCACCATAAAGG-3′;GAPDH上游引物为5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物为5′-GCCATCACGCCACAGTTTC-3′。PCR扩增反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环。采用2-ΔΔCT公式计算目的基因mRNA的相对表达量。试验独立重复3次。
1.2.5免疫组织化学 所有标本经固定、包埋和切片后按照免疫组织化学SP试剂盒说明书进行操作,TCF21多克隆抗体以1∶100稀释,严格控制各步骤的时间及温度,各组均以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。TCF21以细胞质和细胞膜染色呈棕褐色作为阳性细胞标准。所有切片均采用H-Score法分析,根据每张切片的染色强度及范围计算并分析。使用正置显微镜(Axio Imager A2,Carl Zeiss Microscopy GmbH)采集图像。
1.2.6Western blot试验 RIPA细胞裂解液于冰上裂解细胞,裂解产物经过离心及蛋白变性后加入Loading buffer上样至SDS-PAGE凝胶中进行电泳分离,后转至PVDF膜上,5%脱脂奶粉室温封闭2 h,分别加入兔抗人TCF21抗体(1∶1 000)和小鼠抗人GAPDH抗体(1∶300),4 ℃孵育过夜,TBST洗膜后加入二抗,室温孵育1 h,最后用化学发光法显影。使用Fusion软件分析灰度值:目的蛋白灰度值/内参蛋白灰度值=相对表达量。试验独立重复3次以上。
1.2.7克隆形成试验 取对数生长期HEY TCF21细胞及HEY NC细胞,按500个/孔的数目种入6孔板内,加入新鲜完全培养基2 mL于37 ℃孵育箱培养12 d后取出,PBS清洗3次,4%多聚甲醛固定10 min,PBS清洗3次,结晶紫染色后将6孔板正置于扫描仪下,扫描计数克隆团并分析,以细胞>50个为1个克隆团,克隆形成率=平均克隆数/500×100%。所有试验均独立重复3次以上。
1.2.8Transwell试验检测HEY细胞迁移、侵袭能力 (1)Transwell细胞迁移。①制备:制备细胞悬液;②接种:取小室(上室)置于24孔板中,加入1×105个细胞,加入400 μL培养基,在24孔板内(下室)加入培养基600 μL;③培养:细胞孵育箱内培养10 h(HEY细胞培养6 h),取出孔板倒置显微镜下观察下室有细胞出现说明上室内细胞已迁移出来;④固定染色:取出小室,棉签擦去上室细胞,PBS浸泡洗涤1次,4%多聚甲醛固定20 min,PBS洗涤,倒置显微镜下观察上室,保证细胞擦净,小室膜面浸没于结晶紫染料中20 min,PBS洗涤;⑤封片计数:染色成功后,用棉签擦去上室液体,待膜干燥,用刀片削下膜,中性树脂固定膜于载玻片上,细胞面朝下,盖玻片封片,显微镜下照相并计数。(2)Transwell细胞侵袭。①制胶:Matrigel基质胶稀释后包被于Transwell小室上室面,37 ℃孵育2 h使其成为凝胶状;②制备:制备细胞悬液;③接种:向已被覆Matrigel的Transwell小室上室中加入含2×105个细胞的0.2 mL无血清培养基,小室外孔内加入0.7 mL含10%胎牛血清的培养基;④培养:孵育箱孵育48 h后,取出小室,小心吸尽上室中液体;⑤固定染色:5%多聚甲醛固定20 min,0.1%结晶紫染色液染色20 min,PBS清洗2次后风干;⑥封片计数:显微镜下随机选取5个视野(×400)拍照计数。
1.2.9皮下移植瘤模型建立 选取购于重庆市肿瘤医院实验动物研究中心大约4周龄、体质量约20 g的雌性裸鼠。取对数生长期HEY TCF21细胞及HEY NC细胞,PBS调整细胞为5×107/mL。实验中每组5只裸鼠,分别于臀部常规聚维酮碘消毒后皮下注射100 μL HEY TCF21细胞(TCF21过表达组)和HEY NC细胞(对照组)悬液。此后每间隔5 d使用游标卡尺测量肿瘤大小(长径及短径),观察并记录皮下瘤瘤体生长情况,皮下瘤体积根据公式:π/6×长径×短径2。5周后剖出新鲜皮下瘤拍照、测量、称重后固定于甲醛中,常规石蜡包埋、切片后用于后续试验。

2 结 果
2.1TCF21在卵巢癌组织和细胞株中的表达 qRT-PCR检测结果显示,TCF21 mRNA在卵巢癌细胞株及10例高级别浆液性卵巢癌组织中的表达水平均较正常卵巢组织低,差异均有统计学意义(P<0.05),见图1A、图1B;免疫组织化学检测结果显示, TCF21在高级别浆液性卵巢癌组织中的蛋白表达水平明显低于正常卵巢和正常输卵管组织,差异均有统计学意义(P<0.05),见图1C、图1D。

注:A为TCF21 mRNA在正常卵巢组织及卵巢癌细胞株中的相对表达水平,NOR表示正常卵巢组织,3AO、HEY、8910、OVCAR3、A2780分别表示卵巢癌细胞株3AO、HEY、8910、OVCAR3、A2780;B为TCF21 mRNA在正常卵巢组织及10例高级别浆液性卵巢癌组织中的相对表达水平,1~3表示3例正常卵巢组织,1~10表示10例高级别浆液性卵巢癌组织;C为TCF21在正常卵巢组织、正常输卵管组织和高级别浆液性卵巢癌组织中的蛋白表达水平;D为免疫组织化学评分,1表示正常卵巢组织(n=5),2表示正常输卵管组织(n=3),3表示高级别浆液性卵巢癌组织(n=30);与其他类别比较,*P<0.05。图1 TCF21在正常卵巢和正常输卵管组织及卵巢癌组织中mRNA和蛋白表达水平
2.2DNA甲基化影响卵巢癌细胞中TCF21的表达 多种肿瘤中TCF21低表达是由于基因启动子DNA甲基化所导致。本研究通过对目的细胞株进行Aza药物去甲基化处理后,qRT-PCR检测结果显示,与未处理组比较,使用Aza处理后TCF21的mRNA表达均增强,差异有统计学意义(P<0.05)。
2.3HEY细胞株转染Lenti-TCF21慢病毒后的表达验证 根据图1筛选相对表达水平较低的HEY细胞株作为后续试验细胞株,将细胞分为过表达组和空载体组。qRT-PCR和Western blot试验证实,过表达组TCF21 mRNA及蛋白表达水平均明显高于空载体组,差异均有统计学意义(P<0.05)。
2.4过表达TCF21抑制HEY细胞克隆形成能力 采用平板克隆法进行细胞增殖试验检测结果显示,过表达TCF21后卵巢癌细胞克隆灶形成率明显下降,差异有统计学意义(P<0.05),见图2A、图2B。

注:A为过表达TCF21抑制HEY细胞克隆形成;B为过表达TCF21抑制HEY细胞克隆形成率;与HEY TCF21比较,*P<0.05。图2 平板克隆法检测过表达TCF21对卵巢癌细胞克隆形成能力的影响
2.5TCF21抑制卵巢癌细胞在体内的增殖能力 成功建立裸鼠皮下移植瘤模型,5周后获取皮下瘤体拍照绘制皮下瘤体积的生长曲线,发现与对照组比较,TCF21过表达组皮下瘤的瘤体大小、质量明显缩小/减轻。对皮下瘤体进行免疫组织化学检测TCF21,验证过表达模型的成功建立和Ki-67的表达,以评估细胞的增殖能力,结果显示,过表达TCF21组皮下瘤体Ki-67的表达水平明显降低。总体结果显示TCF21能抑制卵巢癌细胞的体内成瘤能力。
2.6过表达TCF21抑制HEY细胞迁移和侵袭能力 Transwell试验检测HEY细胞迁移和侵袭结果显示,与HEY TCF21比较,过表达TCF21可明显减弱HEY细胞的迁移[(58.33±3.68)个vs. (317.70±5.04)个]和侵袭能力[(77.30±2.79)个vs. (187.80±4.70)个],差异均有统计学意义(P<0.05)。见图3。
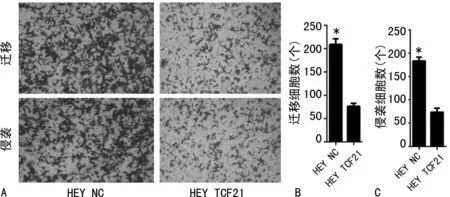
注:A为Transwell试验检测HEY TCF21和HEY NC细胞的迁移和侵袭;B为迁移细胞数;C为侵袭细胞数;与HEY TCF21比较,*P<0.05。图3 Transwell试验检测TCF21对HEY细胞迁移和侵袭的影响(倒置荧光显微镜×400)
3 讨 论
在全球范围内,卵巢癌是女性第七大最常见的癌症,也是第八大最常见的癌症死亡原因,其5年生存率低于45%[5]。2018年,美国新诊断出卵巢癌病例约22 240例,死亡14 070例。尽管进行了广泛的临床和基础研究,由于早期难以发现,60%的卵巢癌患者在诊断时已处于晚期,5年生存率仅为27%。因此,早期发现和预防是研究的重点,因为局部疾病的5年相对生存率为93%[6]。
表观遗传学修饰中启动子甲基化被认为是基因在肿瘤发展早期阶段的重要机制之一。有研究表明,TCF21在不同类型肿瘤中的缺失表达均与其启动子区域甲基化相关,比如小细胞肺癌[7]。DAI等[8]对TCF21的作用调控机制进行了研究,发现缺氧肿瘤微环境能直接激活多种microRNA的表达,直接与SLC12A1和TCF21 2个靶点结合并导致这2个基因表达下调。本研究发现,TCF21在卵巢癌细胞及其组织中呈明显缺失表达状态,药物去甲基化处理后,TCF21基因表达水平明显恢复,且体内外细胞学试验证明其表达的恢复明显抑制其恶性生物学行为(恶性增殖、迁移、侵袭),所有结果与目前已知在其余肿瘤类型中的研究结果一致。TCF21的重要功能是促进间质细胞向上皮细胞转化,而上皮细胞向间质细胞转化则与恶性肿瘤的迁移和侵袭相关。最新研究表明,TCF21通过调控AKT信号通路抑制胃癌细胞的增殖和对顺铂耐药[9],靶向调控PI3K/AKT and ERK信号通路可抑制肿瘤相关血管生成,以及胆管癌、直肠癌细胞生长[10],并且可能抑制自噬活性,促进肺癌进展[11]。TCF21缺失表达与不同类型肿瘤的不良预后明显相关,如黑色素瘤、肾癌、肝癌、头颈部鳞癌[12]。TCF21在卵巢癌中的研究较少,有研究表明,miR-205通过靶向TCF21对卵巢癌有重要作用,TCF21可抑制基质金属蛋白酶(MMP)-2和MMP-10,并减少卵巢癌细胞的侵袭,共同转染表达TCF21质粒与miR-205可降低TCF21对卵巢癌细胞MMP-2和MMP-10的抑制作用[13]。TCF21在卵巢癌中的功能及机制研究极少。
综上所述,TCF21缺失表达与多种肿瘤密切相关,使TCF21作为肿瘤早期检测的肿瘤标志物成为可能。卵巢癌的发生可能与6号染色体区域6q22和6q23~6q24的杂合型缺失相关,而TCF21位于相同基因位置。本研究在TCF21的表达及基础生物学行为方面做了简单探讨,而TCF21的表达下调是否可作为筛查卵巢癌早期的生物标志物,是否对卵巢癌的耐药、自噬和预后等有影响,需要进一步加大临床组织标本进行临床特征的分析和试验佐证。
