BuAENA合成工艺物料的热危险性研究 *
2021-02-16祝艳龙杨彩宁
禄 旭,丁 黎,祝艳龙,常 海,许 诚,杨彩宁
(西安近代化学研究所,西安 710065)
0 引言
随着推进剂和发射药朝着高能化和低特征信号的方向发展,选择性能优异的高能钝感含能增塑剂至关重要,叠氮类含能增塑剂由于叠氮基的存在,不仅能够提高能量,降低特征信号,还具有良好的热稳定性,是当前含能增塑剂的研究热点和重要方向[1-12]。叠氮类含能增塑剂需要通过叠氮化反应将叠氮基引入化合物中,叠氮化反应属于放热反应,反应过程中会因加料过快、冷却失效等因素造成反应体系发生失控,反应物料分解,甚至引起燃烧爆炸事故发生。此外,含能材料作为一种特殊化工材料,合成过程中所涉及的原料、中间产物及产物等都存在含能基团,在制备过程中存在较大的危险性。因此,研究叠氮化反应过程中物料的热危险性,对提高叠氮含能增塑剂合成过程的本质安全,提升合成工艺连续化、自动化的水平,推动含能增塑剂在推进剂和发射药中的广泛应用具有重要意义[13-20]。
BuAENA是以丁基硝氧乙基硝胺为原料,加入NaN3经过叠氮化反应制备而成的一种新型叠氮含能增塑剂。目前,关于BuAENA合成过程的安全性研究正逐步展开,朱勇等采用热流法测定了BuAENA反应过程的热力学数据,并对其叠氮化反应安全性进行了初步分析,陈小微等根据BuAENA反应过程中原料浓度随时间的变化情况研究了合成反应的动力学。当前,研究主要以BuAENA的叠氮化反应过程为对象[21-24],而对于反应过程中所涉及物料的热危险性研究还未展开,反应物料的热安全参数缺失,从而限制了BuAENA合成反应的本质安全设计、安全防范措施及安全预警措施的制定。
本文以BuAENA合成反应过程中所涉及的原料、中间物料及产物为对象,采用DSC研究了上述物料的热稳定性筛选出最不稳定的物料,并采用ARC对最不稳定的物料热危险性展开研究,结合TSS(Thermal Safety Series)热安全软件进行拟合,获得相关热安全参数,为BuAENA的本质安全设计及安全措施的制定提供数据支撑。
1 实验
1.1 试剂与仪器
BuNENA, 高效液相色谱仪HPLC结果表明纯度大于99.5%,西安近代化学研究所;叠氮化钠,工业品,西安庆华公司;DMSO,分析纯,成都科龙化工试剂厂。
高效液相色谱,1120型,美国安捷伦公司;差示扫描量热仪,Q200型,美国TA公司;绝热加速度量热仪,ES-ARC型,英国THT公司;Thermal Safety Series 热安全软件,俄罗斯科学院应用化学部,用来进行化工工艺过程的热安全研究[25-28]。
1.2 实验过程
1.2.1 合成过程
BuAENA的合成路线如下:
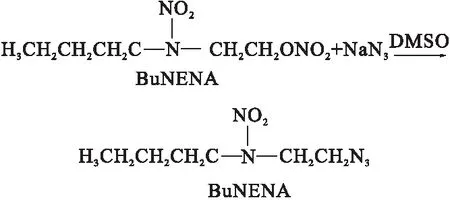
向装有温度计、磁力搅拌器的三口烧瓶中,加入15 ml DMSO和5.3 g BuNENA,充分搅拌,升温至70 ℃恒定后,一次性加入1.7 g NaN3,保温7 h,随后经过萃取、水洗,在35 ℃下经过减压蒸馏等工序,得到淡红色透明液体。HPLC结果显示其纯度为99.3%
1.2.2 中间物料的取样过程
根据BuAENA叠氮化反应过程的特点,提取反应过程中6个时刻的中间物料展开热稳定性研究,分别为刚加入NaN3(1#样品)、反应10 min(2#样品)、反应15 min(3#样品)、反应1 h(4#样品)、反应2.5 h(5#样品)和反应7 h(6#样品)时刻的中间物料。
1.3 性能测试
色谱实验:不锈钢C18色谱柱(5 μm,250 mm×4.6 mm),流动相V(乙腈)︰V(水)=70 ︰ 30,紫外检测波长210 nm,进样量1 μl。
差示扫描量热实验:试样量约为10 mg,程序升温,升温速率10 ℃/min,N2流量50 ml/min,高压密封坩埚。
绝热加速量热实验:试样量0.942 g,H-W-S(加热-搜索-等待)模式,起始温度50 ℃,升温台阶5 ℃,等待时间15 min,初始放热检测灵敏度0.02 ℃/min,钛合金样品池,质量15.145 g,比热容0.53 J/(g·K)
2 结果与分析
2.1 中间物料的组成分析
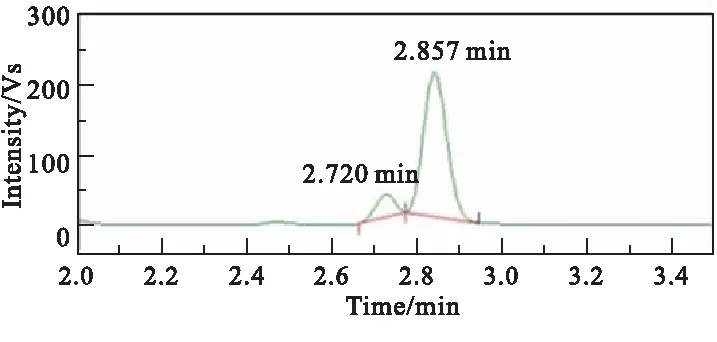
图1(a)~图1(c)分别为原料BuNENA、产物BuAENA和5#中间物料的HPLC分析图。
(a)BuNENA

(b)BuAENA
(c)5# material
由图1可知,原料BuNENA在2.720 min处出峰,产物BuAENA在2.853 min处出峰。通过HPLC实验对反应过程中1#~6#中间物料进行分析,从而跟踪反应过程中原料BuNENA和产物BuAENA的浓度变化,采用面积归一法获得6个反应液物料中BuNENA和BuAENA的含量变化,如表1所示。此外,从图1(c)可看出,除BuNENA和BuAENA外,中间物料的HPLC图未检测到其他有机物的出峰,表明在该叠氮化反应过程中,无其他副反应的发生。
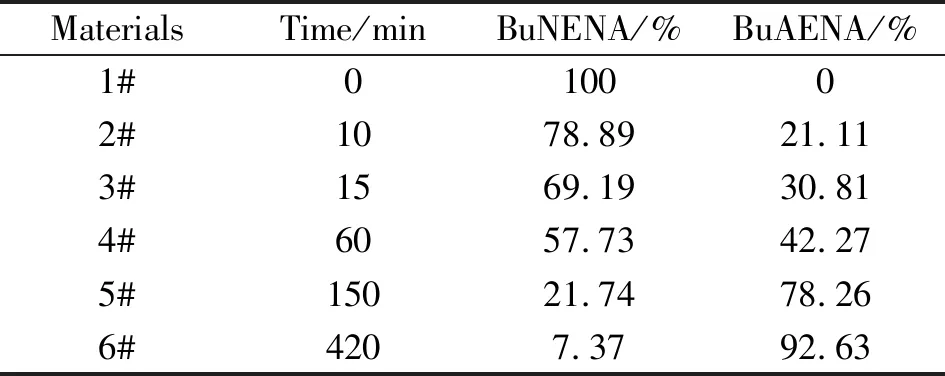
表1 不同反应时刻BuNENA和BuAENA的含量百分比
由表1可知,经过1 h的反应后,有42.27%的BuAENA生成,在1 ~2.5 h,有35.99%的BuAENA生成,反应过程趋于缓慢,当反应结束时,共生成92.63%BuAENA。根据表1所示,不同时刻反应液物料中BuNENA和BuAENA的含量,按照质量守恒定律计算得到6个中间物料中各组分的质量变化,见表2。
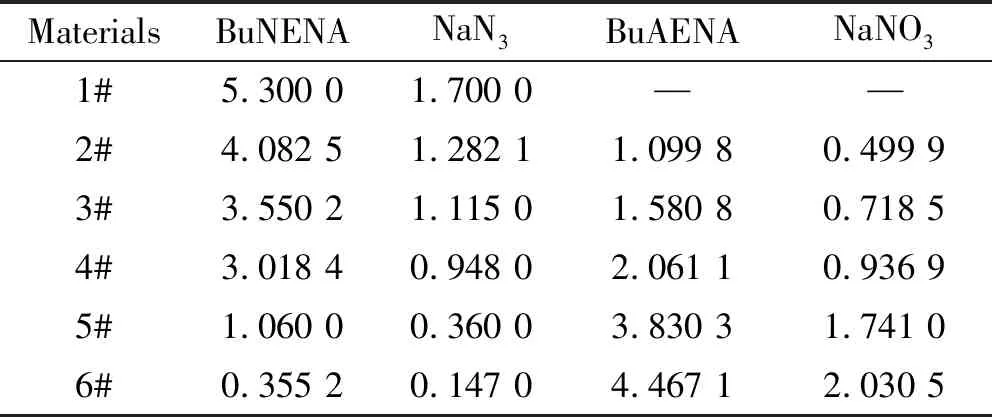
表2 不同时刻反应液物料的组分组成及含量
2.2 物料的热稳定性分析
图2为BuAENA叠氮化反应过程中所涉及的原料(BuNENA和NaN3)、产物(BuAENA)及6个中间物料的DSC曲线,其热分解特征参数如表3所示。结合图2和表3可知,原料BuNENA作为一种硝氧乙基硝胺类含能化合物,起始分解温度185.6 ℃,存在两个分解放热峰,分解峰温分别为216.5、281.6 ℃,分解放热量约为3514.1 J/g。产物BuAENA的起始分解温度195.8 ℃,热稳定性优于BuNENA,在213.7 ℃有一个肩峰,主分解峰温248.2 ℃,分解放热量为2937.1 J/g。
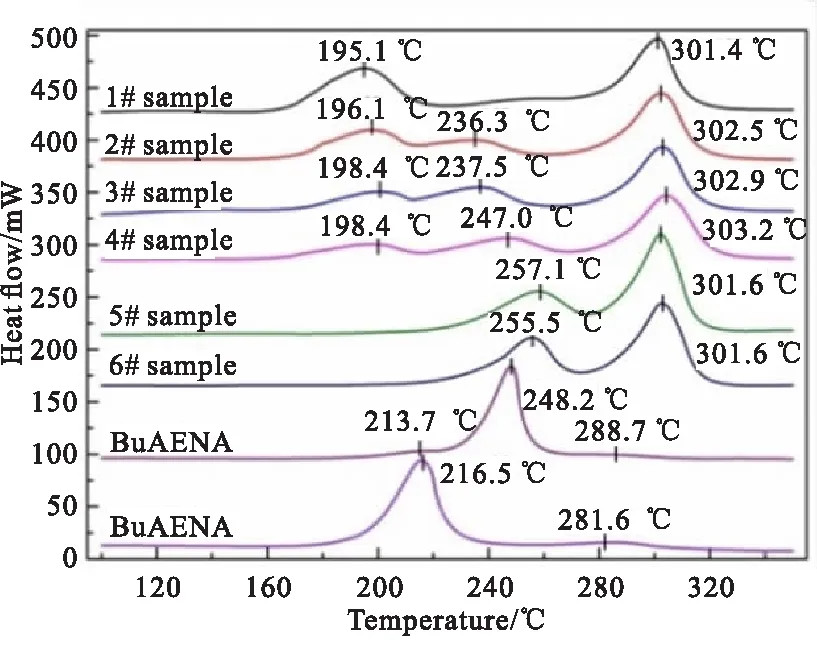
图 2 BuAENA合成反应物料的热分解曲线
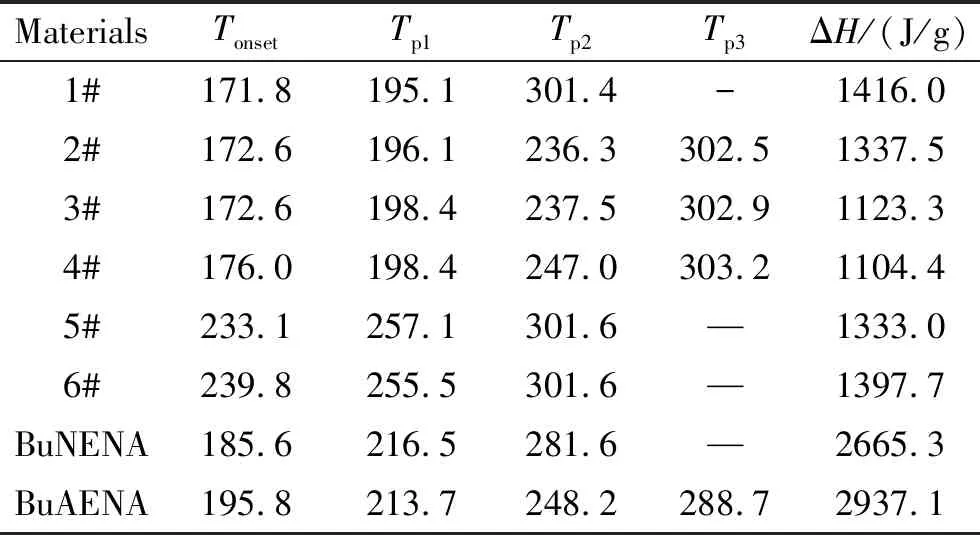
表3 BuAENA合成工艺中物料的热分解特征参数
通过1#~6#中间物料的热分解曲线可以看出,当反应刚开始时,1#样品的起始分解温度为171.8 ℃,随着反应的进行,起始分解温度由171.8 ℃提高至239.8 ℃,分解放热量呈现先减小后增大的趋势。结合1#~6#中间物料的组分含量可知,随着原料BuNENA的消耗以及产物BuAENA的生成,反应体系的热稳定性越来越好。
综合对比BuAENA合成过程中的原料、中间物料和产物的热分解特征参数可知,1#样品(加入NaN3时的反应液物料)的热稳定性最差,起始分解温度最低,在反应过程中最易发生热分解,这是由于溶剂DMSO中亚砜基团造成原料BuNENA中硝酸酯基的活化,使得BuNENA在DMSO体系中出现热不稳定,起始分解温度提前,而随着反应的进行,原料BuNENA的消耗,体系的热稳定性越来越好。因此,选择筛选出最不稳定的1#样品进行绝热加速量热实验,研究其在绝热条件下的热分解特性。
2.3 绝热加速量热实验
1#样品在绝热条件下的发生热分解时的温度和压力变化曲线分别如图3所示。
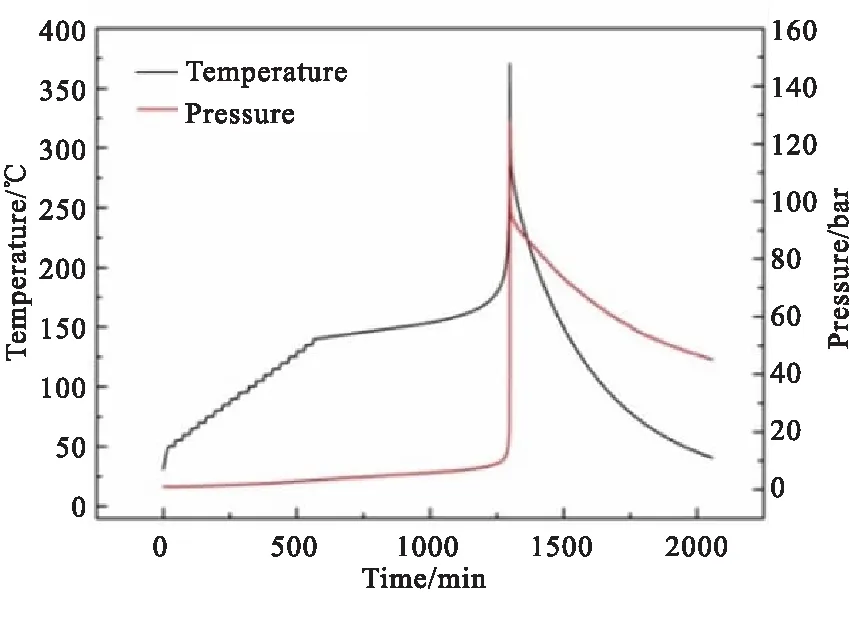
图3 1#物料绝热实验曲线
由图3可知,1#物料发生分解的绝热压升约130 bar,发生压力大幅升高的现象是由于1#物料中NaN3的存在,NaN3是一个热稳定性较好的材料,在N2气氛下采用DSC实验测得起始分解温度454.7 ℃,但NaN3一但发生分解,就会释放大量气体,造成体系压力骤升[29-30]。此外,实验所测得的1#物料的绝热分解起始温度145.7 ℃,绝热温升374.5 ℃,但物料实际的起始分解温度会低于实际所测得的145.7 ℃,这是由于实验过程中无法避免的实验误差造成。根据绝热分解原理,在绝热体系下,物料发生热分解所产生的热量因无法散失而全部作用于自身热分解,造成热量累积,使得反应体系温度升高,热分解反应加速进行,所以绝热条件是物料受热分解最严苛条件。但在实际的测试过程中,由于样品池存在热容,导致物料所释放的一部分能量不可避免地被样品池吸收,物料实际所释放的热量不能完全被仪器传感器所感知;同时,为保证实验的安全性,含能材料在进行绝热实验时所取的样品量很少,实验误差较大。因此,需要对实验测得的物料绝热分解数据进行热惯量修正,即φ值校正,φ值计算式如式(1)所示。
(1)
式中cb、cs分别为样品池的比热容和样品的比热容,J/(g·K);mb、ms分别为样品池和样品的质量,mg。
对于绝热压力曲线,实验测得的压力p实际上是大气压pi、加热搜索等待阶段产生的蒸汽压pv及物料发生分解时所产生的压力pg的加和(式2)。因此,需要将物料发生分解所产生的压力pg从总的压力中分离出来。其中,pi用理想气体状态方程求得(式3),pv用Antoine方程求得(式4)。
p=pi+pv+pg
(2)
(3)
(4)
式中p、pi、pv以及pg分别为实验测得的压力、大气压、加热搜索等待阶段产生的蒸汽压以及样品发生绝热分解产生的压力,bar;n为物质的量,mol;R为摩尔气体常数,J/(mol·K);V为样品池体积,m3。
图4为1#样品的绝热分解曲线,经过修正后的温度和压力曲线分别如图4(a)、4(b)中曲线2所示。图4(a)曲线表明,由于绝热实验测试过程中样品池不可避免地吸收部分热量,所以样品实际发生放热分解的起始温度为139.25 ℃,低于量热仪所探测到的样品的起始分解温度,随着绝热分解反应的深入,热惯量的影响会越发突出,相比于绝热试验测得的绝热温度曲线,样品实际发生绝热分解反应的绝热温升升高,到达最大反应速率的时间明显提前。对于压力变化曲线,图4(b)曲线3为1#样品发生热分解产生的压力pg曲线,可看出,在扣除了大气压及加热搜索等待时刻产生的压力后,1#样品实际分解产生的压力曲线略低于实验所测得的压力曲线。经过phi值修正后的pg曲线如图4(b)曲线2所示。表4为1#样品在绝热条件下的热分解特征参数。
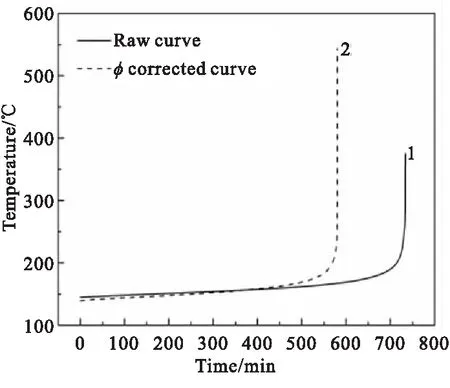
(a)Temperature-time curves
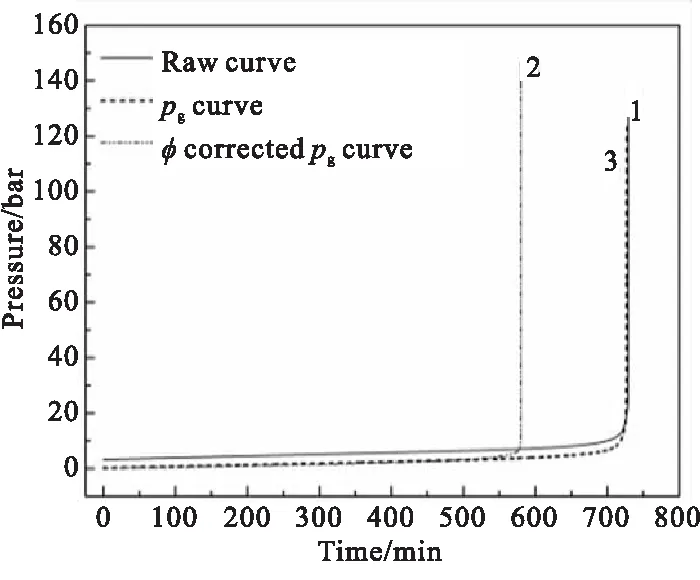
(b)Pressure-time curves
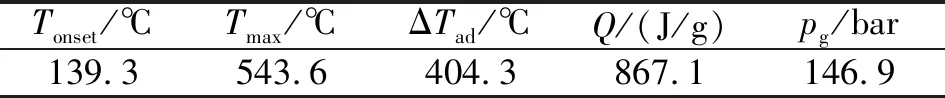
表4 1#样品绝热分解特征参数
2.4 物料的绝热分解动力学
根据绝热曲线假定1#样品的分解反应为单步N级反应,动力学方程如式(5)所示:
(5)
在绝热条件下:
(6)
(7)
(8)
式中α为转化率,%;Ton为起始分解温度,K;ΔTad为绝热温升,K;Q为放热量,J/g;cs为样品的比热容,J/(g·K);φ为热惯量修正系数。
通过实验数据计算获得转化率α后,应用线性最小二乘法获得动力学参数。基于上述动力学评估原理[31],利用TSS 软件对1#样品在绝热条件下的热分解进行动力学拟合。结果表明,该物料在绝热条件下发生热分解的活化能Ea=150.6 kJ/mol,lnk0=29.4 s-1,n=0.16。拟合结果与实验曲线相吻合,如图5所示,说明所建立的绝热动力学模型能准确反映1#样品的热分解历程。
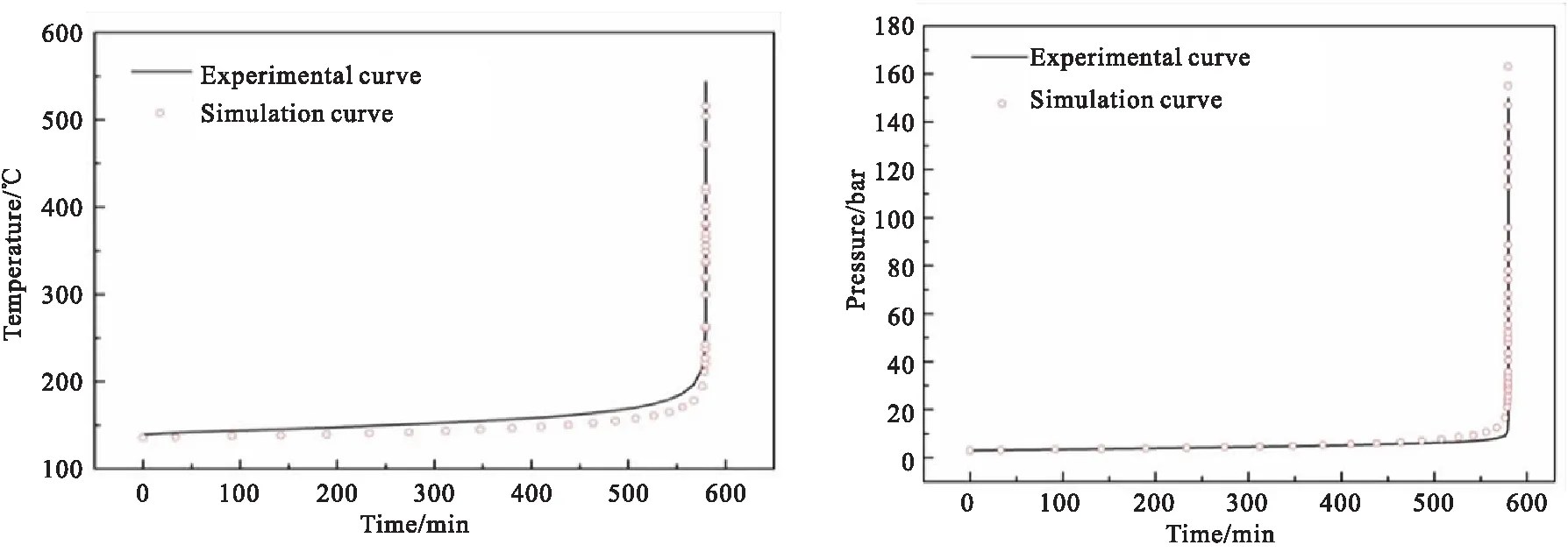
(a)Temperature-time fitting curves (b)Pressure-time fitting curves
2.5 基于绝热动力学模型的热危险性模拟
2.5.1TMRad的获取
TMRad是化学反应危险性评价的重要依据之一,能够通过已知物料的比热容、反应活化能、反应放热量等参数得到不同温度绝热条件下物料发生分解反应到达最大速率所需要的时间,即
(9)
式中cp为比热容,J/(g·K);Ea为分解反应活化能,J/mol;Q为分解反应放热量,J/g;k0为指前因子。
基于上述动力学拟合结果,对该物料分解反应在绝热条件下达到最大速率的时间TMRad进行模拟计算,得到物料在给定温度下发生绝热分解时的最大速率到达时间,从而获得TMRad随温度的变化曲线,如图6所示。TD24作为评估物料危险性的重要温度参数,其定义为绝热条件下最大升温速率到达时间为24 h所对应的温度,经过计算得到1#样品的TD24=132.1 ℃。
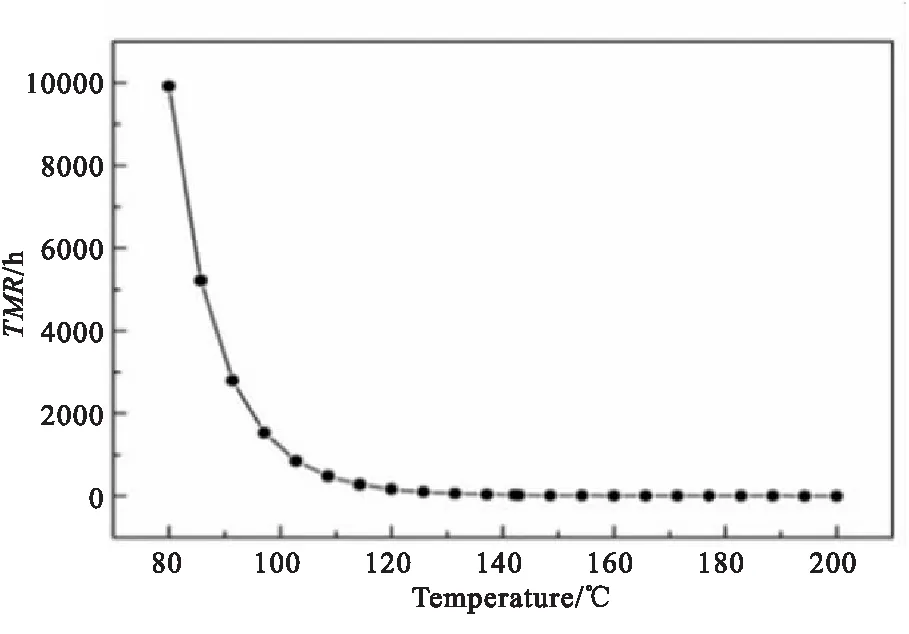
图 6 TMR曲线
2.5.2 不同条件下的绝热压力模拟
根据1#物料的绝热分解动力学模型,研究利用TSS热安全软件进行模拟计算,预估出1#物料分别在10、50、100 bar压力条件下的分解压力曲线,如图7所示。由图7可知,随着体系压力的升高,1#物料的分解压力明显增大,分解加剧,造成的后果越严重。因此,在合成过程中应关注反应器内的压力数值,避免因压力增大造成分解的发生和加剧。
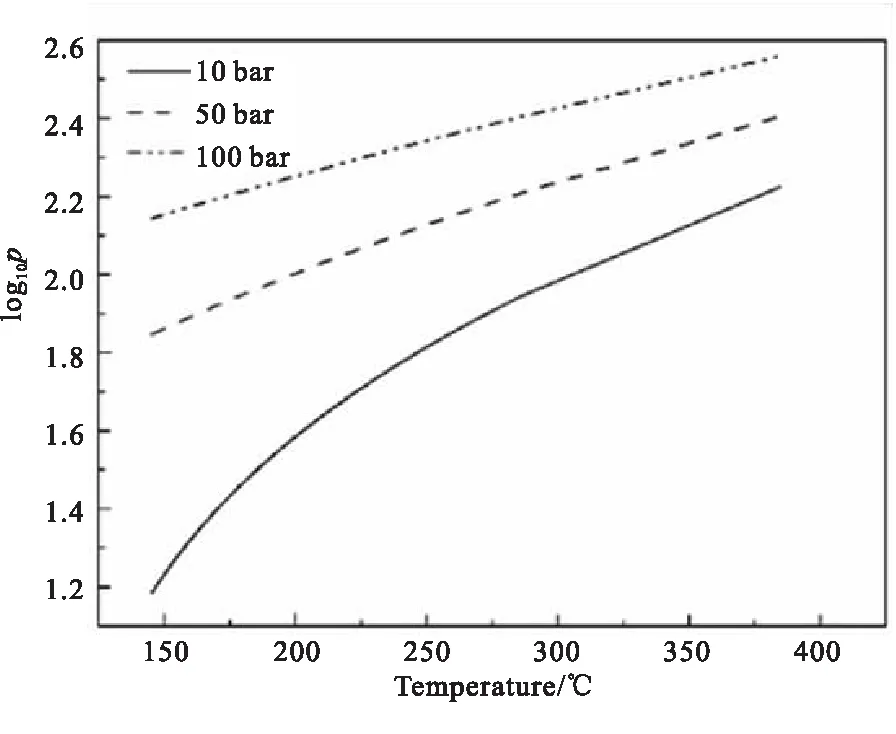
图7 1#物料在不同压力条件下的分解压力曲线
3 结论
(1)在BuAENA叠氮化反应过程中,1#物料,即刚加入NaN3时刻的反应体系最不稳定,热分解起始温度最低,为171.8 ℃,随着反应的进行,热分解起始温度向高温处移动,反应体系的热稳定性越来越好。
(2)1#物料在绝热条件下的起始分解温度为139.25 ℃,绝热温升为404.34 ℃,表明反应一旦发生失控造成1#物料的分解,会造成严重的后果。
(3)1#物料在绝热条件下的Ea=150.6 kJ/mol,lnk0=29.4 s-1,n=0.16。计算得TD24=132.1 ℃。
