西双版纳原始森林土壤中分离的两株纤维素分解细菌的鉴定
2021-02-12罗红梅李树红张绍松
余 萍,姚 斌,罗红梅,李树红,张绍松*
(1.云南省农业科学院生物技术与种质资源研究所/农业部西南作物基因资源与种质创制重点实验室/云南省农业生物技术重点实验室,云南 昆明 650205;2.中国农业科学院饲料研究所,北京 100081)
【研究意义】农业生产中的生物质主要由纤维素、半纤维素、木质素等组成[1]。将农林废弃物中木质纤维素作为原材料的生物质资源化利用越来越受到关注[2]。中国农作物秸秆种类多、总量大,是世界第一大秸秆产出国[3]。农作物秸秆中主要构成成分是纤维素、半纤维素等。目前,国内外对农作物秸秆生物质的资源化利用途径主要包括:作为能源的热裂解技术[1]和水热液化技术[4];肥料化技术和饲料化技术。其中,肥料化技术是农作物秸秆生物质资源化利用的核心[5]。纤维素、半纤维素是农作物秸秆废弃物生物质的主要成分,将其发酵腐解、肥料化利用,需构建高效分解生物质纤维素的微生物株系及其发酵工艺,因而,发掘高效降解的微生物株系是肥料化利用核心的关键。纤维素是构成植物体重要成分之一,农林牧生产过程中的林木、草和农作物的秸秆中含有大量的纤维素、半纤维素、木质素等。中国可开发的生物质资源总量约为7亿t左右标准煤,其中农作物秸秆约占50%以上[6]。木质纤维素是地球上可再生有机质和廉价的重要能源[7]。农业生产中每年产生大量的作物秸秆,2006年中国生产的粮食作物秸秆约4.89亿t,且总体上呈现逐年增加的趋势[8]。这些秸秆中含有丰富的纤维素资源,约占生物质资源总量的38.9%[9],然而大部分却没有充分的利用,直接以焚烧、废弃的方式进行处理,这不仅给环境造成了严重的污染,也是一种资源浪费。传统的降解木质纤维素方法易产生有害化学物,故常用酶法或与酶结合的方法进行降解[10]。利用微生物产生的纤维素酶来催化降解秸秆是最经济环保的生物降解方法。微生物降解过程中无二次污染,加快秸秆的腐熟进程,腐熟秸秆可作为肥料施用,不仅排除了因施用化学肥料引发的环境污染,也可间接增加农民收入。【前人研究进展】降解纤维素的微生物,目前报道较多的是真菌,常具有较高的胞外纤维素酶活性,如木霉属(Trichoderma)[11]、曲霉属(Aspergillus)[12]和青霉属(Penicillium)[13-15]等。据统计,国际纤维素酶市场上有20%的纤维素酶来自木霉属和曲霉属[16]。近年来,有关细菌产生纤维素酶方面的报道也较多,如高效降解纤维素的枯草芽孢杆菌(Bacillussubtilis)[17-19]、解淀粉芽孢杆菌(B.amyloliquefaciens)与贝莱斯芽孢杆菌(B.velezensis)[20]、短小芽孢杆菌(B.pumilus)[21]以及纤维单胞菌(Cellulomonassp.)[22]等细菌。可见,有关微生物降解木质纤维素方面的研究是该领域的研究热点之一。农作物秸秆中除了含有纤维素主要成分外,同时含有其它的化学成分。通过多种微生物菌系组合,产生多种酶系,可提高微生物对秸秆的降解效果[23-24]。然而,发掘具有高效降解能力的单一菌株是基础,通过高效降解菌株之间的组合,才能研发更高效的降解组合。【本研究切入点】孟仑石灰山国家级自然保护区位于云南省西双版纳傣族自治州,森林资源丰富,长期积累覆盖大量枯枝落叶,在自然环境中受微生物作用被分解,这种环境有利于纤维素分解菌的自然富集,更易获得具有纤维素酶高活力的微生物。【拟解决的关键问题】本研究从海拔584 m的孟仑石灰山(21°54′8.1″N,101°16′59.3″E)附近的原始森林腐殖土壤中分离微生物,并筛选高效分解纤维素的菌株,旨在挖掘产生纤维素酶的微生物资源,为农作物秸秆等废弃生物质纤维素的降解提供潜在生产菌,对废弃物的资源化利用具有重要意义。
1 材料与方法
1.1 试验材料
1.1.1 样品的采集 选择西双版纳孟仑石灰山国家级自然保护区内腐木及枯枝落叶腐烂程度高的地区为采集地点,采集5 cm以下的表层土壤样品,采集的样品处置方法同文献[25],放入自封袋中。然后放入低温冰盒运回实验室,置于4 °C冰箱保存备用。
1.1.2 培养基 筛选培养基:CMC-Na 5.0 g,NH4NO31.0 g,酵母粉 1.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,琼脂15.0 g,加H2O溶解,定容至1 L。
LB培养基:制备LB培养基的各组分比例与方法同文献[25],固体培养基中加入2%的琼脂粉。
1.1.3 主要仪器和试剂 PCR 扩增仪、恒温培养箱DHP-600、恒温振荡器TL-C、超净工作台SW-CJ-1F、紫外凝胶成像系统Genegenius、显微镜SZH10、分光光度计DU730等仪器的生产产家参见文献[25];合成引物的公司同文献[25](细菌16S rDNA的通用引物27f:5’-AGAGTTTGATCCTGGCTCAG-3’和1492r:5’-GGTTACCTTGTTACGA CTT-3’);提取细菌基因组DNA的试剂盒、TaqDNA聚合酶、dNTP、琼脂糖等试剂;以及酵母膏、蛋白胨、NaCl等试剂的来源与文献[25]中同种试剂的来源相同。
1.2 试验方法
1.2.1 菌株的分离纯化 本试验采用稀释平板法分离和纯化:在超净工作台上称取10 g土样,加入盛有100 mL无菌水、并装有玻璃珠的三角瓶中,置于30 ℃摇床150 r/min震荡30 min,吸取1 mL菌悬液,用无菌水进行浓度梯度稀释,从稀释倍数为10-3、10-4、10-5、10-6的菌悬液中分别吸取200 μL,依次涂布在平皿中LB固体培养基上,方法同文献[25],然后将培养皿置于恒温培养箱中,30 ℃培养3 d。挑选出在培养基上生长良好的单菌落,进一步在LB固体培养基上划线培养与纯化。
1.2.2 分解纤维素菌株的筛选 采用刚果红染色法筛选具有分解纤维素活性的菌株。将上述分离纯化的菌株接种至CMC-Na固体培养基平板上,30 ℃恒温培养3 d后,用0.1%的刚果红水溶液浸染30 min,弃染液,再用1 mol/L的NaCl水溶液脱色1 h,弃脱色液,用游标卡尺测量菌落直径(用d表示,单位cm)和水解圈直径(用D表示,单位:cm),以Dp表示水解能力:Dp=D/d。
1.2.3 菌株的细胞形态及生理生化特性鉴定 挑取每个具有水解圈菌株的单菌落,在载玻片上涂片,置于光学显微镜下观察菌株的细胞形态,并按照《伯杰细菌鉴定手册》[26]和《常见细菌系统鉴定手册》[27],进行生理生化反应方面的鉴定。
1.2.4 具有分解纤维素活性菌株的16S rDNA分子鉴定 采用细菌基因组DNA提取试剂盒,分别对具有分解纤维素活性的菌株进行基因组DNA的提取,并对提取的DNA样品进行琼脂糖凝胶(1%)电泳检测和凝胶成像系统检测,拍照。采用细菌16S rDNA 的2个通用引物,以提取的各菌株基因组DNA样品分别作为模板,进行PCR扩增反应与检测。PCR反应体系、反应条件、电泳检测和胶回收等方法参见文献[25]。反应体系为 50 μL,其中2 μL模板DNA,1 μLTaqDNA聚合酶,4 μL dNTP,1 μL引物27f,1 μL引物1492r,5 μL的10×Buffer,36 μL ddH2O。扩增反应条件为: 95 ℃预变性 5 min;95 ℃变性50 s,59 ℃退火50 s,72 ℃延伸1 min;38个循环,72 ℃最终延伸10 min,4 ℃保存。经检测和拍照后,胶回收的DNA片段送至上海立菲生物技术公司进行测序。
经测序获得的16S rDNA序列,进一步与NCBI数据库中已有的16S rDNA核酸序列进行BLAST同源性分析,方法与文献[25]相同。在比对结果中,寻找16S rDNA基因序列高度同源的近缘种,采用MEGA 5.0软件,进行多重序列比对分析,通过Neighbour-Joining法构建系统发育树,采用 Bootstrap对进化树进行 1000 次可信度分析。
2 结果与分析
2.1 纤维素分解菌的分离与筛选
对西双版纳原始森林5个不同地方采集的样品经LB培养基分离纯化后共获得34株细菌,依次编号为BN-1~BN-34。将这些菌株转接到纤维素筛选培养基上培养3 d,经刚果红染色与脱色后,共有5株细菌产生较为清晰的透明圈(图1),分别为:BN-6、BN-9、 BN-17、 BN-22和BN-33菌株。从图1和表1可以看出,BN-22菌株的纤维素分解能力最强,其次为BN-9菌株,BN-33菌株的降解纤维素能力最弱。采用游标卡尺进一步测量各菌株的透明圈直径(D)与菌落直径(d),并计算两者比值,结果见表 1。可见,BN-22菌株的D/d值最大。
2.2 具有分解纤维素活性菌株的形态特征及生理生化特性
光学显微镜下观察5个菌株在LB培养基上的菌落形态如图2所示。BN-6菌株的菌落中央部位凹陷,表面粗糙,边缘不规则。BN-9菌株的菌落中央凸起,边缘光滑整齐。BN-17菌株的菌落边缘不规则。BN-22菌株的菌落表明光滑,有不规则凸起形状,边缘光滑整齐。BN-33菌株的菌落中央部位凹陷,表面粗糙,边缘不规则。将具有分解纤维素活性的5个株菌进行革兰氏染色观察,5个菌株均呈阳性,并且均产芽孢(图3),表明具有分解纤维素活性的5株细菌分离物均为芽孢杆菌属(Bacillus)的种。5个菌株的甲基红、V-P实验和苯丙氨酸脱氨酶均为阴性,接触酶、明胶液化实验和精氨酸双水解均为阳性。BN-33菌株的脲酶为阳性外,其余4个菌株均为阴性。BN-9和BN-17菌株的葡萄糖发酵为阴性,BN-6、BN-22和BN-33菌株为阳性。5个株菌的各项生理生化特征见表2。
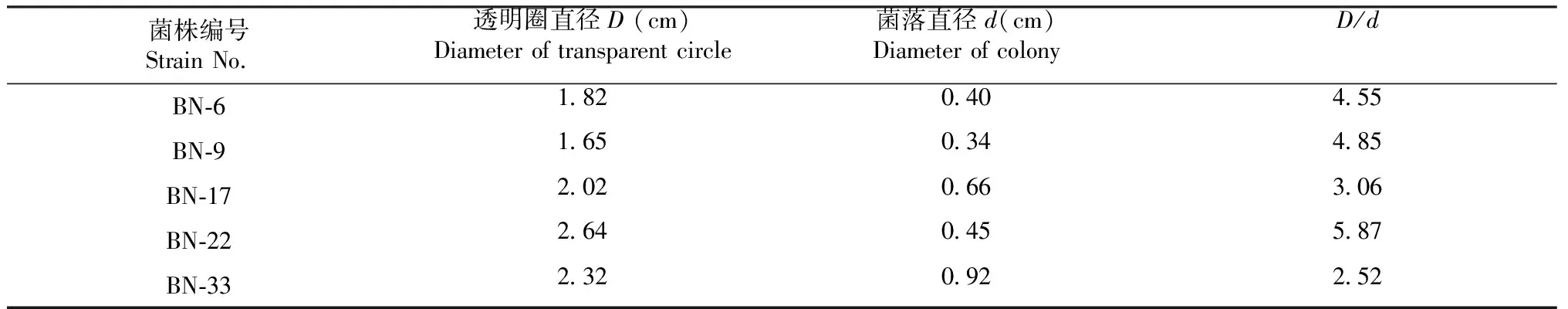
表1 纤维素降解菌株的水解圈与菌落直径比值
2.3 具有分解纤维素活性菌株的16S rDNA鉴定
分别以5个菌株的基因组DNA为模板,采用16S rDNA的通用引物进行PCR 扩增反应,获得长度约为1500 bp的片段(图4),进一步回收5个菌株的PCR扩增片段DNA,测定每个菌株约1500 bp扩增片段的DNA序列,并将获得的5个菌株的16S rDNA基因序列分别在NCBI 数据库中BLAST 比对,发现菌株BN-6菌株、BN-9菌株、BN-17菌株和BN-33菌株与数据库中的多种芽孢杆菌属(Bacillus)的序列相似性均为99%,BN-22菌株与沙福芽孢杆菌(B.safensis)和短小芽胞杆菌(B.pumilus)序列相似性均为100%。每个菌株与对应亲缘关系较近的3株细菌的16S rDNA基因序列,与文献[25]
中方法相同,采用MEGA 5.0软件进行多重序列比对分析,用Neighbour-Joining法构建系统发育树(图5)。结果显示,5个菌株可分在2个不同的进化分支上,BN-6、BN-9、BN-17和BN-33菌株为一个分支,BN-22菌株另为一个分支。结合生理生化VP实验阴性结果,说明BN-22菌株为沙福芽孢杆菌。BN-6、BN-9、BN-17和BN-33菌株不属于枯草芽孢杆菌(B.subtilis)或蜡状芽孢杆菌(B.cereus)。BN-9菌株的菌落为黄色,结合其它试验结果和16S rDNA的系统发育树分析,该菌株为吉氏芽孢杆菌(B.gibsonii)。根据培养特征、生理生化特征及16S rDNA序列的分析结果,推测BN-6、BN-17和BN-33菌株为嗜热脂肪芽孢杆菌(B.stearothermophilus)、解淀粉芽孢杆菌(B.amyloliquefaciens),特基拉芽孢杆菌(B.tequilensis),甲基营养型芽孢杆菌(B.methylotrophicus)等几种菌中的属种,有关这几株细菌在分类上的属种尚需进一步研究和鉴定。
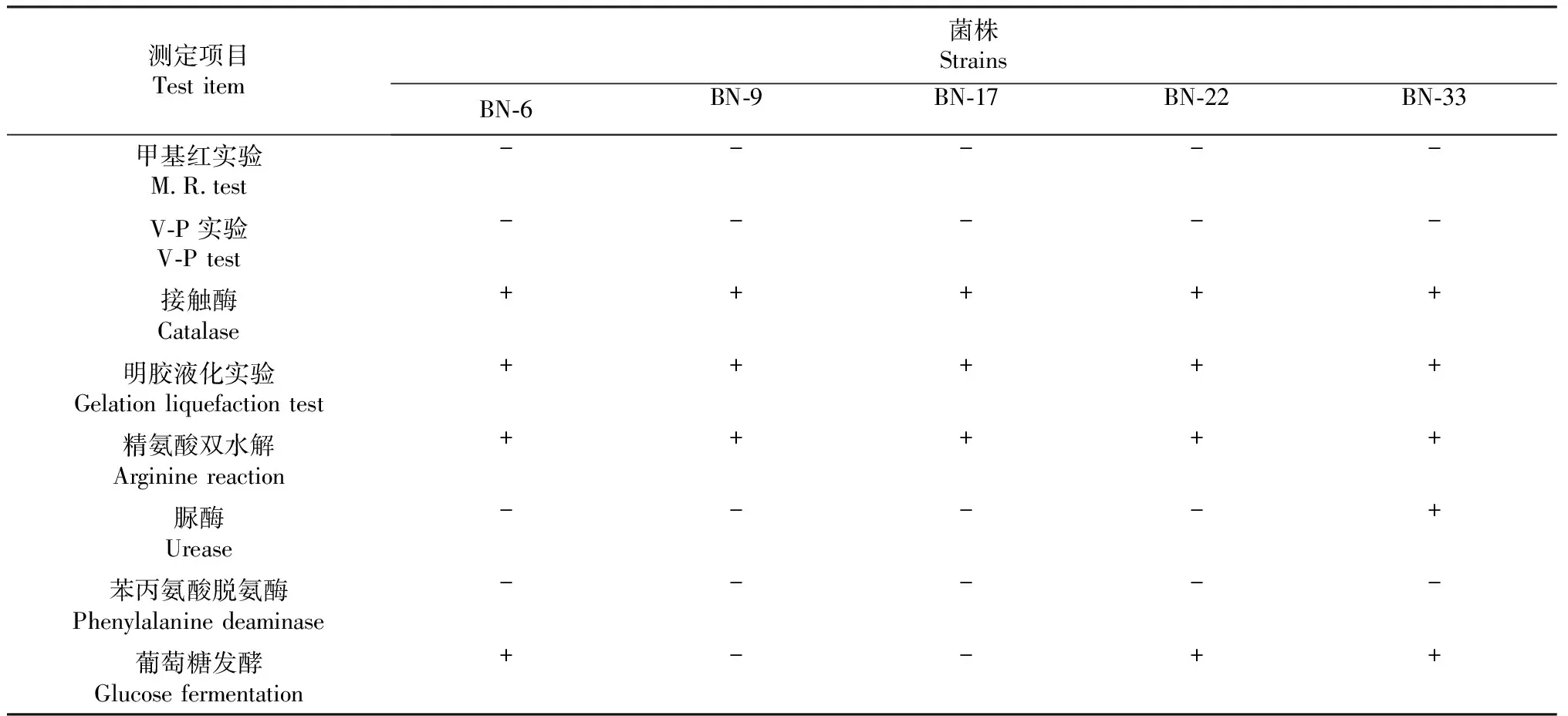
表2 具有分解纤维素活性菌株的生理生化特征
3 讨 论
不同类型的生态环境中分布有相应的微生物类群,如:邱秀文等[14]从秸秆还田环境中分离筛选到纤维素分解菌;张喜庆等[19]从自然发酵的牛粪分离获得高效分解纤维素的分解菌;Varghes等[28]从白蚁肠道和蚁穴分离到分解纤维素的格兰氏阳性菌株等。本研究在云南省西双版纳州的孟纳石灰山原始森林区域,分离获得的具有分解纤维素活性的菌株,与已报道的同属种菌株的功能存在差异。如:张知晓等[29]报道的沙福芽孢杆菌(B.safensis),所关注的是抑菌特性,尚未报道菌株的分解纤维素活性;本研究中分离获得具有分解纤维素高活性的吉氏芽孢杆菌(B.gibsonii),陈铮等[30]报道了该菌的发酵液中含有来氟米特,未报道其所分离菌株对纤维素的分解特性。本研究分离获得的5株细菌,其中2株已鉴定其属种,3株细菌初步鉴定其为芽孢杆菌类群,但明确的属种分类尚待进一步研究,便于发掘利用其功能。
同时,通过筛选、分离获得的微生物菌株,需进一步明确微生物产生的分解酶类别。本研究中采用的CMC-Na纤维素作为底物,筛选和检测所分离菌株的纤维素酶活性,是纤维素酶活检测的常用方法。通过分离与筛选获得的5株芽孢杆菌,需进一步对其产生的纤维素酶类别和滤纸酶活性进行定性与定量的检测,以便发掘和利用菌株的生物学功能,更好地应用于生产。
生态环境不同,其分布的微生物类群亦存在差异。在腐解生物质的角度,不同林木、草、或秸秆的生物质类别,虽都含有纤维素,但因不同材质与来源的成分、种类及含量的差别,以及腐解菌株组成与反应环境条件的差异,对纤维素分解的效果也会千差万别。因而,需对菌株的最适反应条件、分解效果最好的秸秆类型、分解菌株的最佳组合等条件进行探索,可望获得最佳的腐解秸秆木质纤维素的工艺条件。同时,原始生林土壤中也会富集了多样性的微生物区系,有待于进一步地挖掘。
4 结 论
原始森林长期累积枯枝落叶于林地土壤,富集有丰富的微生物类群。由于枝落叶中含有大量的木质纤维素,林地土壤可有效富集纤维素分解细菌.通过分离纯化,经鉴定获得两株细菌对纤维素具有良好的分解效果,有待进一步发掘利用。
