鱼类双重荧光标记研究
——以中华倒刺鲃幼鱼为例
2021-02-04吕红健苏胜齐姚维志
唐 容 吕红健 付 梅 苏胜齐 姚维志
(西南大学水产学院,西南大学渔业资源环境研究中心,水产科学重庆市重点实验室,重庆 400716)
中华倒刺鲃(Spinibarbus sinensisBleeker),隶属鲤科(Cyprinidae),鲃亚科(Barbinae),倒刺鲃属(Spinibarbus),俗称青波。中华倒刺鲃主要分布于长江上游及其主要支流中,是长江上游珍稀特有经济鱼类之一[1]。近年来由于过度捕捞、环境污染、拦河建坝及产卵群体资源量极端匮乏等原因,中华倒刺鲃天然资源量呈逐年下降趋势[2—4]。因此,为了恢复野生中华倒刺鲃的自然资源量,保护其分布水域的生物多样性,并进一步促进渔业资源的可持续利用,已开展了多种资源养护措施,例如:设立水生生物自然保护区[5],开展人工培育苗种增殖放流活动[6—11]。据不完全统计,长江中上游每年放流的中华倒刺鲃人工培育幼鱼超过40万尾。为了科学有效的评估中华倒刺鲃的增殖放流效果,掌握中华倒刺鲃的移动分布规律,开展标志放流是重要途径,而合理的标记方法又是标志放流的前提。
鱼类荧光标记技术是采用荧光染料在鱼体的钙质或骨质结构上形成荧光标记的标记技术,作为一种兼具体内和体外标志的标记方法,目前已被广泛应用于标记软骨鱼类[12]和硬骨鱼类[13],该标记技术具有标记费用低,对标记鱼的存活、生长和行为影响较小,标记保存率较高,标记易于发现等优点[14,15]。目前国际上经常使用的荧光染料主要有茜素红S(Alizarin red S,ARS)[16]、茜素络合物(Alizarin complexone,ALC)[17]、盐酸四环素(Tetracycline hydrochloride,TCH)[18]和钙黄绿素(Calcein,CAL)[19]等。此外,荧光标记方法包括直接浸泡[20]、加强渗透[21]、投喂[22]和注射[23]四种。虽然有以上多种可用的荧光染料和标记方法,但荧光标记在鱼类上的应用也仅限于使用一种荧光染料对目标鱼种进行单一标记,很少有人进行过双重标记或三重标记研究。此外,当发现多种荧光染料适用于一个鱼种,并且在同一研究中有多个该鱼种的种群必须标记和区分时,双重标记或三重标记将特别有用,这样不仅能增加标记模式(包括单一标记、双重标记和三重标记等),还能用于区分不同标志放流群体。
本研究采用TCH和ARS对中华倒刺鲃幼鱼进行双重荧光标记,考察不同浓度TCH和ARS双重标记对中华倒刺鲃幼鱼生长和存活的影响,并探讨2种荧光染料对中华倒刺鲃幼鱼耳石、鳞片、倒刺、鳍条和鳍棘的标记效果,旨在为中华倒刺鲃的标志放流提供潜在的标记技术,并进一步增加鱼类荧光标记的标记模式。
1 材料与方法
1.1 中华倒刺鲃实验幼鱼
2016年3月,从重庆静观养殖场采集全长为70—80 mm的中华倒刺鲃幼鱼约300尾,将幼鱼移至200 cm×100 cm(D×H)的圆柱形养殖池中暂养10d,暂养用水为曝气24h以上的自来水,日换水1次,换水量为10%。暂养期间每天的光照周期为12L﹕12D,且定时投喂两次浮性颗粒饵料,每次投饲率为鱼体重的1%。投喂1h后,测定水质指标,并将水质控制在水温16.0—17.7℃,pH 6.97—7.23,溶解氧6.91—7.42 mg/L。
1.2 双重荧光标记染色实验
先使用TCH对中华倒刺鲃幼鱼进行浸染标记,实验共设6个浓度梯度,即0、100、200、300、400和500 mg/L(表1)。各浓度梯度配制40 L荧光染液,并在配制完成后强曝气24h,用以提高荧光染液的pH。然后,每个实验组随机取40尾中华倒刺鲃幼鱼,浸染24h。在浸泡完后,将标记鱼放入曝气自来水中2h,以洗去体表残留荧光染料。随后将6个实验组标记幼鱼转入6个装有等体积曝气自来水缸中继续饲养72h,并统计急性死亡率。最后,将每个实验组的标记幼鱼移入6个200 cm×100 cm(D×H)的圆柱形养殖水槽(养殖水体体积为1400 L,实验鱼养殖密度为0.028尾/L)中饲养30d。此阶段为养殖生长实验的第一阶段(图1),标记幼鱼的饲养条件与暂养期间相同。

表1 使用盐酸四环素和茜素红S双重浸泡标记的顺序和浓度Tab.1 The order of double immersion marking and concentration sets for TCH and ARS of experimental group

图1 双重标记后6个实验组中华倒刺鲃平均全长(a)和体重(b)Fig.1 Mean total length(a)and body weight(b)of S. sinensis from six experimental groups after double fluorescent marking
在用TCH标记30d后,使用ARS进行相同浸染流程的标记实验。将先前使用TCH处理的6组中华倒刺鲃幼鱼,分别对应使用浓度为0、100、150、200、250和300 mg/L的ARS染液浸染处理24h(表1)。在浸染完成后,统计浸染后72h内ARS二次浸泡标记导致的急性死亡率。
1.3 生长实验
为了评估两次浸泡标记后TCH和ARS对中华倒刺鲃幼鱼生长和存活的复合效应,从每个处理组中随机抽取36尾鱼,用于随后持续60d的生长实验(即生长实验的第二阶段,图1)。每个实验组设3个平行组(n=12),分养于200 cm×100 cm(D×H)的圆柱形养殖水槽中(养殖水体体积为1400 L,实验鱼养殖密度为0.028尾/L),整个生长实验过程中连续充气,日换水1次,换水率为10%。每天定时投喂两次浮性颗粒饵料,每次投饲率为鱼体重的1%。投喂1h后,测定水质指标,并将水质控制在水温19.4—25.9℃,pH 7.83—8.51,溶解氧6.76—7.37 mg/L,且光照周期为12L﹕12D。
在生长试验的第一阶段开始时,测量所有实验鱼的全长和体重,数据分别精确到0.1 mm和0.1 g。本研究的养殖实验共持续90d(第一阶段持续30d,第二阶段持续60d,在养殖的第30、第60和第90天测定各处理组实验鱼的全长和体重(图1)。此外,在整个生长试验过程中记录每组实验鱼的死亡率。
1.4 标记检测实验
在生长实验结束后,每个平行组取10尾鱼(即每个实验组共30尾),使用200 mg/L的MS-222(tricaine-methanesulfonate)麻醉致死后,取其矢耳石、星耳石、鳞片、倒刺和鳍条(包括背鳍、胸鳍、腹鳍、臀鳍和尾鳍)及鳍棘(包括背鳍、胸鳍、腹鳍和臀鳍)。本研究所取样本在清洗干净后在室温下避光保存,并在取样20d内完成标记检测。
使用装有Leica DFC 495高分辨率数码相机的Leica DM IL LED荧光显微镜和Leica EL6000Comp体式显微镜对所取样品进行荧光标记检测(表2)。标记效果参照Liu等[24]的方法。将荧光标记清晰度划分为0至5的6个等级。将标记质量用n表示,当n≥2时,记作可接受标记,即标记质量较好。为保证标记等级划分的准确,所取样品需由2名经验丰富的观察者独立观察分析,如果结果不一致时需由第3位观察者确定。在鉴定标志效果期间,所有的样品均未进行打磨和抛光。

表2 用于检测盐酸四环素和茜素红S标记的双色镜和滤光片组合Tab.2 Dichromatic mirror and filter combination wavelength for visualizing TCH and ARS marks
1.5 数据处理
应用SPSS 19.0和Excel 2016软件进行数据统计分析,每尾中华倒刺鲃幼鱼的标记质量、全长及体重数据用平均值±标准误差(Mean±SE)表示。最终采用单因素方差分析法(One-way ANOVA)进行处理组与对照组实验鱼死亡率、全长及体重的差异显著性分析,设定差异显著性水平P为0.05,当P≤0.05时为差异显著。
2 结果
2.1 荧光标记对中华倒刺鲃幼鱼存活和生长的影响
在整个实验中各处理组标记鱼与对照组在两次24h的浸染过程中,及浸染后72h的观察期间均未出现死亡个体。在90d的养殖实验期间,6个实验组也未出现死亡个体,各实验组之间的死亡率均无显著性差异(P>0.05)。经单因素方差分析表明,处理组与对照组在0、30d、60d、90d养殖实验过程中全长、体重也无显著性差异(P>0.05,图1)。

图2 TCH和ARS荧光染料对中华倒刺鲃幼鱼矢耳石(a)和星耳石(b)的标记质量Fig.2 The mark quality of TCH and ARS fluorochrome dyes on the sagittae(a)and asteriscus(b)of S. sinensis
2.2 内部骨质结构标记效果
在本研究中,经各浓度TCH和ARS标记过的矢耳石(图2和图3)和星耳石(图2和图4)上均检测到荧光标记。将TCH和ARS标记过的各内部骨质结构样品置于荧光显微镜下观察,在蓝光照射下有两种荧光标记,分别是由TCH标记产生的黄色荧光环和由ARS标记产生的红色荧光环,且黄色荧光环比红色荧光环更接近于耳石(包括星耳石和矢耳石)的内部(图3)。而在绿光照射下仅发现ARS标记产生的红色荧光环,且该红色荧光环比蓝光照射下的更明亮(图3)。此外,在浸染24h后,较高浓度处理组的矢耳石(≥300 mg/L TCH和≥150 mg/L ARS)和星耳石(≥300 mg/L TCH 和 ≥200 mg/L ARS)中均能检测到明显的标记环(n≥2)。结果表明,实验组Ⅳ、Ⅴ、Ⅵ的矢耳石和星耳石都具有可接受的TCH和ARS标记。
2.3 外部骨质结构标记效果
本研究结果显示,各对照组鱼体的各类外部骨质结构(鳞片、倒刺、鳍条和鳍棘)中均检测到荧光标记。同上述内部骨质结构结果类似,将TCH和ARS标记过的各外部骨质结构样品置于荧光显微镜下观察,在蓝光照射下有两种荧光标记,分别是由TCH标记产生的黄色荧光环和由ARS标记产生的红色荧光环,且黄色荧光环比红色荧光环更接近于外部骨质结构(包括倒刺、鳍条和鳍棘)的内部。而在绿光照射下仅发现ARS标记产生的红色荧光环,且该红色荧光环比蓝光照射下的更明亮(图5、图6和图7)。

图3 不同光源下中华倒刺鲃幼鱼矢耳石的双重荧光标记效果Fig.3 The effect of double fluorescent marking in sagittae of S. sinensis larval observed with different light sources

图4 不同光源下中华倒刺鲃幼鱼星耳石的双重荧光标记效果Fig.4 The effect of double fluorescent marking in asteriscus of S. sinensis larval observed with different light sources
除100—300 mg/L TCH和100 mg/L ARS处理的侧线鳞外,及100—300 mg/L TCH和100、150 mg/L ARS处理的非侧线鳞外,在其余几个处理组的侧线鳞和非侧线鳞上均能观察到环形标记,但是这些鳞片的荧光标记效果并不明显(0≤n≤1,图8)。
经400—500 mg/L TCH和150—300 mg/L ARS处理的倒刺中可以同时检测到TCH和ARS的荧光标记(n≥2,图9)。结果表明,实验组Ⅴ、Ⅵ的倒刺都具有可接受的TCH和ARS标记(图9)。
经200—500 mg/L TCH和150—300 mg/L ARS处理的鳍条(包括背鳍、胸鳍、腹鳍、臀鳍和尾鳍),及经300—500 mg/L TCH和200—300 mg/L ARS处理的鳍棘(除ARS浓度为100 mg/L处理后的腹鳍外)中均可以同时检测到TCH和ARS的标记环(n≥2,图10和图11)。结果表明,实验组Ⅲ、Ⅳ、Ⅴ和Ⅵ的鳍条和实验组Ⅳ、Ⅴ和Ⅵ的鳍棘都具有可接受的TCH和ARS标记。

图5 不同光源下中华倒刺鲃幼鱼倒刺的双重荧光标记效果Fig.5 The effect of double fluorescent marking in barb of S. sinensis larval observed with different light sources

图6 不同光源下中华倒刺鲃幼鱼背鳍的双重荧光标记效果Fig.6 The effect of double fluorescent marking in dorsal fin ray of S. sinensis larval observed with different light sources
最后,本研究中所有TCH和ARS双重浸染处理的耳石、鳞片、倒刺、鳍条和鳍棘中均未观察到肉眼可见的荧光标记(即n<4)。
3 讨论
3.1 双重荧光标记对实验幼鱼存活与生长的影响
一般而言,荧光染料对标记动物生长和存活率的影响是衡量标记适用性的一项重要指标[25]。在2次24h浸染标记过程中,72h标记后的观察期间,及90d的饲养期间各实验组存活率均为100%,养殖实验期间处理组与对照组的体重和全长无显著性差异(P>0.05),这与采用TCH和ARS浸染标记其他鱼类(包括单一标记[26]和双重标记[27])的研究结果保持一致。但是,Beckman和Schulz[12]研究发现,使用较高的浓度染料或增加对鱼类的浸染时间,会导致标记鱼的死亡率在浸染期间及浸染后升高,从而降低标记成功率。Liu等[24]认为这些差异不仅是由高浓度染料和长时间浸染造成的,还可能与标记个体处于不同的生命阶段有关。本研究结果表明,适宜浓度下TCH(浓度为100—500 mg/L)和ARS(浓度为100—300 mg/L)标记对后续中华倒刺鲃幼鱼(全长为70—80 mm)生长和存活均没有显著影响。
3.2 双重荧光标记对不同骨质结构的标记效果与保持率
在荧光显微镜下观察各类骨质结构的标记效果,结果显示所有处理组侧线鳞和非侧线鳞的标记效果较差(0≤n≤1),这与刘奇[28]使用ARS对褐牙鲆(Paralichthys olivaceus)进行标记时,产生的标记效果基本一致。对比相同浓度下矢耳石和星耳石的双重标记效果,结果显示矢耳石和星耳石的双重标记效果差别较小,这与付自东等[29]使用ALC标记胭脂鱼(Myxocyprinus asiaticus)耳石和何春林等[30]使用ALC和TCH标记重口裂腹鱼(Schizothorax davidi)耳石的研究结论有些出入,这可能与荧光染料种类、标记鱼体的生理阶段、代谢速度及耳石形态等有关。此外,在较高浓度下浸泡的矢耳石、星耳石、倒刺、鳍条和鳍棘中均能检测到明显的标记环(n≥2)。但是在透射光下,所有处理组被观察的骨质结构中均无肉眼可见的荧光标记(即n<4),这与Lü等[31]、刘岩等[32]的研究结果不同,Lü等[31]认为要形成肉眼可见的标记需要同时具备高剂量的染料、较长的浸染时间、海水环境及相对稳定的pH等多个条件。在不同物种间产生最佳标记效果所需的染料浓度和浸染时间是不同的。因此,本研究透射光下缺乏可见标记可能是由于鱼类物种差异或淡水和海水环境之间的差异造成的。

图7 不同光源下中华倒刺鲃幼鱼背棘的双重荧光标记效果Fig.7 The effect of double fluorescent marking in dorsal fin spine of S. sinensis larval observed with different light sources

图8 TCH和ARS荧光染料对中华倒刺鲃幼鱼侧线鳞(a)和非测线鳞(b)的标记质量Fig.8 The mark quality of TCH and ARS fluorochrome dyes on the lateral line(a)and non-lateral line scales(b)of S. sinensis
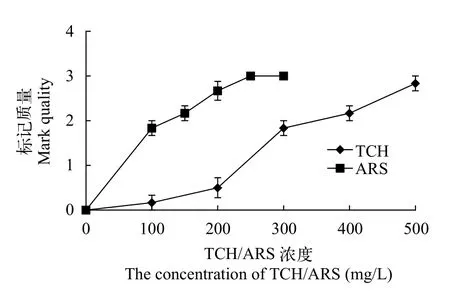
图9 TCH和ARS荧光染料对中华倒刺鲃幼鱼倒刺的标记质量Fig.9 The mark quality of TCH and ARS fluorochrome dyes on the barbs of S. sinensis
能否通过标记方法成功地评估鱼类的增殖放流效果,关键在于是否能保证标记的高保持率,以及在标记过程中和放流后的低死亡率[24]。因此,标记的保留时间是评价标记适用性的另一项重要指标[33]。Bashey[34]认为不同保留时间可能与不同骨质结构、个体代谢差异、标记检测技术(如打磨、抛光)以及环境因子(如高温、阳光)等有关。刘岩等[32]使用ARS对黑鲷幼鱼进行标记并对其暂养2个月后,发现黑鲷幼鱼的硬骨组织仍能保持清晰、肉眼可见的紫色标记。Reinert等[35]研究发现条纹鲈(Morone saxatilis)耳石上的氧四环素(oxytetracycline,OTC)标记可以持续保留3年。本研究结果显示,在使用TCH标记后的90d(即使用ARS标记后的60d),除部分鳞片外,在其他被分析的骨质结构上形成的荧光标记仍然清晰可见。因此,可以推测,TCH和ARS对中华倒刺鲃幼鱼的双重标记保持时间较长,该标记方法可用于中华倒刺鲃幼鱼的标志放流和增殖效果评估,为区分不同标记放流群体提供了一定的技术手段。

图10 TCH和ARS荧光染料对中华倒刺鲃幼鱼背鳍(a)、胸鳍(b)、腹鳍(c)、臀鳍(d)和尾鳍(e)的标记质量Fig.10 The mark quality of TCH and ARS fluorochrome dyes on the dorsal(a),pectoral(b),ventral(c),anal(d)and caudal(e)fin rays of S. sinensis
3.3 双重荧光标记的可行性和潜在应用
近年来,由于放流的苗种数量多、规模大,往往需要进行大规模的标志放流,荧光染料浸泡标记鱼类是其中最常用的方法。该方法不仅能在短时间内实现鱼苗的大规模标记,还能最大限度地降低人为操作对鱼苗造成的伤害[29]。然而使用这种传统的荧光染料浸泡标记法来标记鱼类,可能难以区分被回捕标记的多个同种鱼类的放流群体。因此,对这一标记方法的改进以及对标记模式的创新显得尤其迫切。本研究结果表明,使用TCH和ARS两种染料双重浸泡标记中华倒刺鲃幼鱼效果良好。除处理组Ⅱ的侧线鳞和处理组Ⅱ、Ⅲ的非侧线鳞外(0≤n≤1),所有被分析的骨质结构中均能检测到荧光标记(n≥2)。TCH标记90d(即使用ARS标记后的60d)后,除部分鳞片外,在其他的骨质结构均具有高的保持率,可见使用TCH和ARS对中华倒刺鲃幼鱼进行快速、简便的双重荧光标记是可行的。基于以上结果,可以推测TCH和ARS除了适用于双重标记中华倒刺鲃外,还可以用于单一标记或三重标记,并且有12种潜在的标记类型,包括单一标记(2种),双重标记(4种)和三重标记(6种)。Tsukamoto[27]也曾提出当只有一种或两种荧光染料可用时,双重标记或三重标记能够成为鱼类标记的新模式,同时还能确定上一次鱼体被标记时的大小。
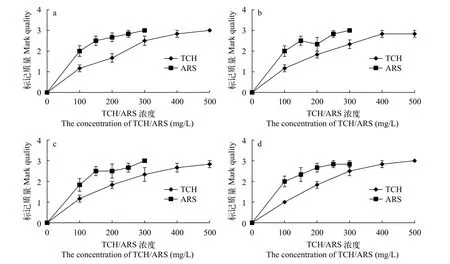
图11 TCH和ARS荧光染料对中华倒刺鲃幼鱼背棘(a)、胸棘(b)、腹棘(c)和臀棘(d)的标记质量Fig.11 The mark quality of TCH and ARS fluorochrome dyes on the dorsal(a),pectoral(b),ventral(c)and anal(d)fin spines fin rays of S. sinensis
3.4 荧光标记的局限性
近年来,荧光染料浸染标记技术已经被广泛的应用于鱼类增殖放流效果评估中。在大多数用于鱼类和水生无脊椎动物的增殖放流的荧光标记方案中,仅对放流群体的生长和存活率进行了评估。Tsukamoto[26]指出荧光染料对标记生物体没有持久不利的影响。即使采用双重浸染荧光标记,当前研究的结论也支持这一观点。但是,Bumguardner和King[36]研究发现,使用较高浓度OTC和CAL浸染标记条纹鲈,结果会对其产生较大的毒性。此外,少数研究也已经报道了荧光染料标记具有潜在的不利影响,Meyer等[37]使用ALC对早期生命阶段的波罗的海鳕(Gadus morhua)进行批次标记,发现标记物不仅会对鳕存活率产生显著的急性影响,而且还会对其他重要参数(如生长)具有亚致死作用。基于这些研究,Lü等[31]推断荧光染料的毒性跟染料种类、染料浓度、鱼的生命阶段及环境因子(如温度)等有关。本研究采用TCH和ARS对中华倒刺鲃进行双重浸染标记,两种荧光标记的保留时间分别为90d和60d。对于荧光标记,标记保留时间的延长也意味着相应结构中荧光染料残留的时间延长。因此,鱼类组织中荧光染料的化学残留物(如鳞片、肌肉、血液、肝脏和肾脏)可能会影响到食品安全。特别是对于一些经济鱼类而言。到目前为止,尽管已经有研究者对鱼体内荧光染料的代谢进行检测,但是关于检测不同鱼类组织中CAL、ALC、ARS、TCH和OTC等荧光染料残留的文献报道甚少。综上所述,在未来的研究中,使用荧光标记前必须先研究荧光染料对目标标记鱼的毒性,并进一步量化荧光染料在鱼体组织中的代谢速度和残留量。
综上所述,TCH和ARS的双重浸染适用于中华倒刺鲃幼鱼的大批量标记,我们推荐把TCH和ARS的单一或双重浸染作为中华倒刺鲃幼鱼的一种标记手段。此外,除部分鳞片以外,荧光染料对倒刺、鳍条和鳍棘的标记效果良好,可以在不杀死标记鱼的情况下获得标记信息,这些标记将会在生物标记实验或增殖放流标记实验中发挥重要作用。但是出于对食品安全的考虑,在未来的研究中,使用TCH和ARS标记评估中华倒刺鲃增殖放流的项目成功之前,应先对荧光染料的毒性进行研究,并且需要进一步量化组织中荧光染料的残留量和研究荧光染料在标记鱼体内的代谢情况。
