丛枝菌根真菌对盐胁迫下桢楠光合生理的影响
2021-02-02崔令军刘瑜霞石开明
崔令军,刘瑜霞,林 健,石开明
(生物资源保护与利用湖北省重点实验室,湖北民族大学,湖北 恩施 445000)
盐胁迫是自然界主要的非生物胁迫之一,土壤盐渍化在农林业领域造成粮食减产、植被减少和森林覆盖率降低[1]。土壤盐渍化主要是由于高浓度的盐离子附着于土壤黏土颗粒表面,不仅造成土壤的pH偏高(pH > 8.5),还对林木的生长也产生非常不利的影响,如高浓度的盐离子使渗透物质受到损伤,光合色素减少、光合能力降低,进而造成林木生长速度下降[2-3]。光合作用是林木生长发育的基础,也是初级代谢过程中一个非常关键的过程。研究发现,在盐渍化土壤中生长的林木,光合色素含量下降,光合生理过程受到抑制,生物量降低[4],进而导致林木产量和质量下降[5-6]。
目前应用接种丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)来提高植物对盐碱耐受性的方法日益受到农林学家的广泛关注。AMF可以与地球上80%以上的植物根系建立共生关系[7]并形成丛枝菌根[8-9],在这种共生关系中AMF可以缓解生物和非生物胁迫对宿主植物造成的伤害,使得植物的碳素循环过程和光合作用过程得到加强[10-11],AMF可以增加叶面积和光合色素含量[12-13],提高对光能的吸收利用效率[14-15];同时AMF侵染根系能够促进植株对土壤中水分和养分的充分吸收[16],以及其他生理生化等方面的改善[17-18],进而能够减轻植物受到盐胁迫时的不利影响,提高植物的抗盐能力[19]。
桢楠(Phoebezhennan),为樟科(Rosaceae)楠属(Phoebe)常绿大乔木,是亚热带常绿落叶阔叶林的重要组成树种,其木材坚硬、耐腐烂、寿命长,是上等用材树种和景观绿化树种[20],也是国家二级保护濒危物种。近年来,以桢楠为材料进行相关科学研究,研究成果主要集中在种子萌发、生长和生理特性研究等方面。前期研究发现AMF在高盐浓度下(300 mmol/L)对桢楠根系具有较高的侵染率(41.25%),且AMF接种能够显著地促进桢楠根系生长[21]。但是,目前还没有关于盐胁迫下接种AMF对桢楠光合生理影响的报道。本研究以桢楠为试验材料,研究在不同浓度盐胁迫下接种丛枝菌根真菌Funneliformismosseae对叶绿素含量、气体交换参数和叶绿素荧光参数等的影响,探讨丛枝菌根真菌在改善桢楠耐盐性方面的作用,以期为桢楠在盐碱地上造林提供参考。
1 材料与方法
1.1 试验材料
以桢楠为试验材料,2017年11月上旬于湖北省恩施土家族苗族自治州林业科学研究院(109°29′58″E,30°17′51″ N)采集桢楠种子,于室温下阴干后调制,置于4 ℃冰箱保存。所用AMF菌种为Funneliformismosseae,购于中国丛枝菌根真菌种质资源库,并以三叶草(Trifoliumrepens)为寄主植株进行扩繁;接种菌剂包含AM真菌侵染的三叶草根段及真菌孢子,每个真菌接种处理接种120 g菌剂(约1 500个孢子)。
1.2 试验设计
2018年3月,将种子取出,用10%(质量分数)的碳酸氢钠溶液浸泡48 h,然后搓洗去除种子表面包被的油脂,经70%酒精消毒后用蒸馏水清洗干净,置于灭菌(0.11 MPa,121 ℃,1 h)的河沙中催芽。将催芽的种子置于人工气候箱内,昼夜温度设置为25 ℃/18 ℃,相对湿度80%,光照时间16 h,黑暗8 h。选取高度一致、具有4片真叶的无菌桢楠幼苗移栽到塑料盆中,加入1.5 kg消毒(0.11 MPa,121 ℃,1 h)基质(土壤与沙体积比1∶1)。试验于8—9月在塑料大棚内进行,设AMF接种(+AMF)处理和未接种(-AMF)2组处理,每个处理种植10盆,每盆3株幼苗。接种菌剂包含AMF真菌侵染的三叶草根段及AMF真菌孢子,未接种处理在塑料盆中填充相同质量的灭菌物质以保持微生物区系一致。NaCl处理设计3个水平,分别为100、200和300 mmol/L,以蒸馏水为对照(CK),每隔2~3 d浇1次盐水,每次各浇100 mL,钵下放盘,为保持盆内盐浓度,如有渗漏,将渗出液倒回盆中。
1.3 参数测定方法
1.3.1 光合色素含量测定
光合色素含量采用丙酮浸提法[22]进行测定。采集形状完好、长势相近的桢楠叶片,洗净后剪碎混匀,称取0.5 g样品,加入少量的碳酸钙、石英砂、丙酮进行充分研磨,滤液定容至25 mL。然后取1 mL溶液稀释至10 mL,用分光光度计测定波长在470、646和663 nm处的吸光度值A470、A646和A663,计算叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)含量。每处理测定5次。
1.3.2 气体交换参数测定
采用Li-6400便携式光合测定仪(LI-COR Inc,USA),在天气晴朗的上午测定气体交换参数,测定时光照强度设定为1 000 μmol/(m2·s),温度为(25±1) ℃,选取长势一致的完全展开叶进行测定,每处理测定5次。测定指标有:净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。
1.3.3 叶绿素荧光参数测定
采用Li-6400便携式光合测定仪进行叶绿素荧光参数测定。叶片经过30 min充分暗适应,照射测量光后得到初始荧光(Fo),随后给一个饱和脉冲光后得到暗适应下的最大荧光(Fm),当荧光产量从Fm降回Fo时,打开叶绿素荧光,恒定后测得稳态荧光(Fs′),打开饱和脉冲光得到光化学作用下的最大荧光(Fm′);随后关闭作用光使叶片暗适应5 s后打开远红光,测光适应叶片的最小荧光(Fo′),然后计算最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ)。每处理测定5次。
1.4 数据分析
试验数据通过Excel 2016和SPSS 22.0软件进行不同处理间差异的比较和双因素方差分析。
2 结果与分析
2.1 盐胁迫下AMF对桢楠光合色素含量的影响
光合色素主要有Chl a、Chl b和Car,它们以色素蛋白复合体的形式存在于叶绿体中。由盐胁迫和AMF处理对桢楠光合色素含量的影响(表1)可知,在同一浓度NaCl胁迫下,AMF接种处理显著提高了桢楠光合色素含量,AMF接种与未接种处理呈显著差异(P<0.05)。双因素方差分析显示,AMF接种对Chl a、Chl b和Car有显著影响,盐胁迫对叶绿素a与叶绿素b含量比值(Chl a/Chl b)有显著影响,接种与盐胁迫的交互作用仅对Car影响显著(表2)。
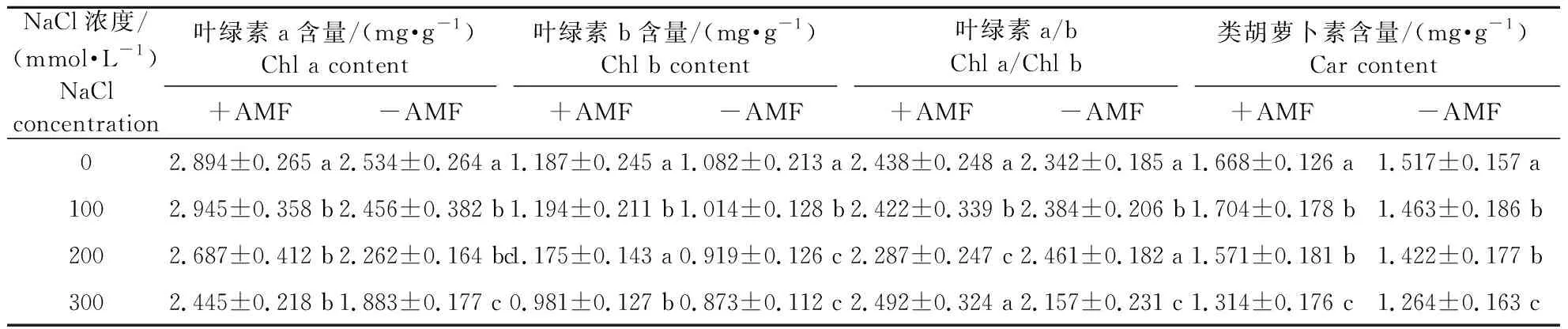
表1 盐胁迫和AMF处理对桢楠光合色素含量的影响
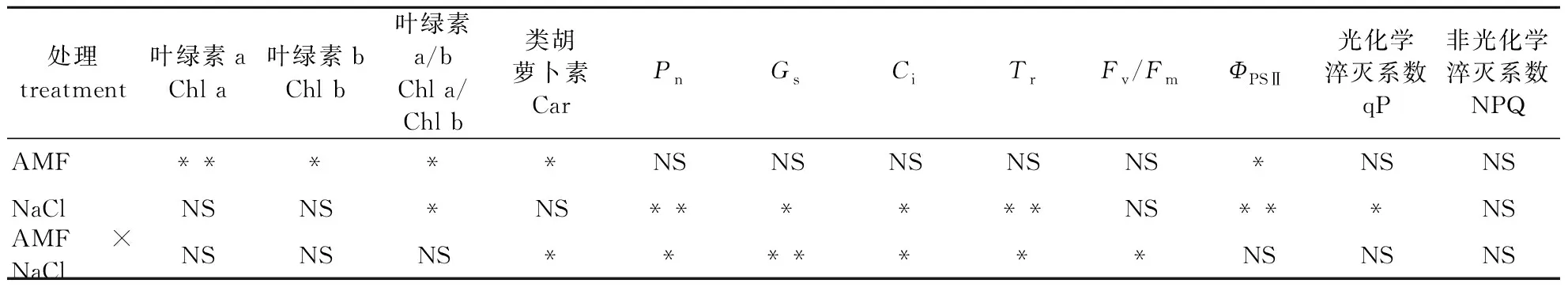
表2 接种、盐胁迫和二者交互作用对桢楠光合特性参数的影响
2.2 盐胁迫下AMF对桢楠光合作用的影响
2.2.1 桢楠净光合速率的变化
净光合速率(Pn)体现了植物光合作用积累的有机物,净光合速率越高,表明植物在单位时间内积累的有机物的数量也就越多。由盐胁迫下AMF对桢楠气体交换参数的影响(图1A)可知,在不同NaCl浓度下(P<0.05),接种AMF后Pn显著高于未接种处理;在NaCl浓度为100、200和300 mmol/L时,接种处理Pn比对照减少2.67%、17.62%和32.56%,而未接种处理Pn则比对照降低8.73%、48.66%和49.91%。双因素方差分析显示接种对Pn无显著影响,盐胁迫及两者的交互作用对Pn影响均显著(表2)。
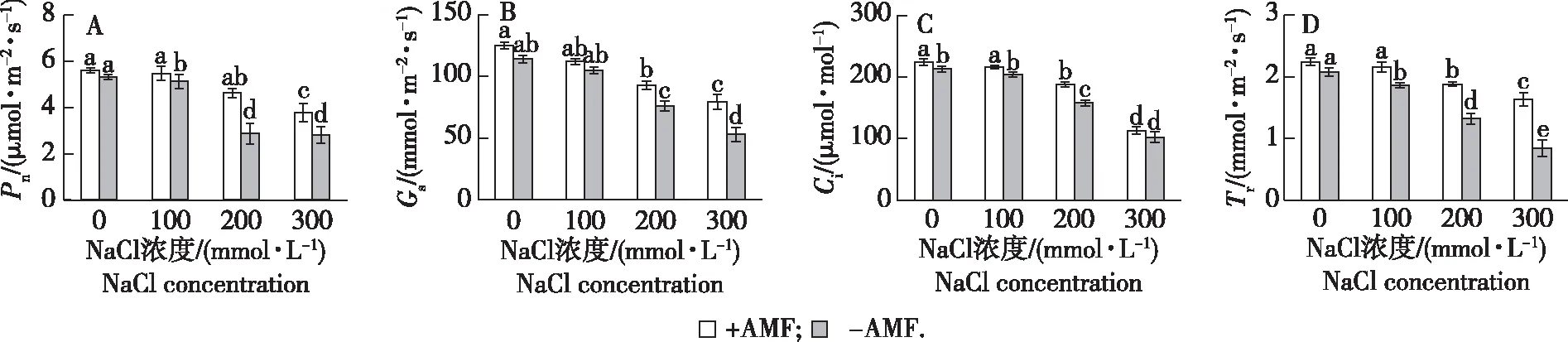
注:不同小写字母表示在0.05水平差异显著。下同。Lowercase letters in the data label indicate significant differences at the 0.05 level. The same below.图1 盐胁迫和AMF处理对桢楠主要光合参数的影响Fig.1 Combinative effects of AMF and salt stress on photosynthesis parameters in P. zhennan
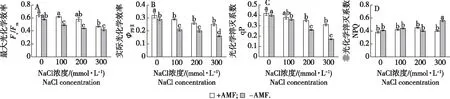
图2 盐胁迫和AMF处理对桢楠叶绿素荧光参数的影响Fig.2 Combinative effects of the AMF and salt stress on chlorophyll fluorescence parameters in P. zhennan
2.2.2 桢楠气孔导度的变化
植物气孔是控制叶片水蒸气和CO2扩散的通道,植物的光合作用过程直接受到气孔的影响。由图1B可以看出,AMF接种处理后气孔导度(Gs)显著高于未接种处理,除了NaCl浓度为100 mmol/L外,其余接种与未接种处理Gs均呈现显著差异(P<0.05)。在NaCl浓度为100、200和300 mmol/L时,接种处理Gs比对照减少10.42%、25.66%、36.81%,而未接种处理Gs则比对照降低了16.67%、39.68%、57.94%。双因素方差分析表明,接种对Gs无显著影响,盐胁迫及两者交互作用对Gs影响均显著(表2)。
2.2.3 桢楠胞间CO2浓度的变化
胞间CO2浓度(Ci)是植物细胞间的CO2浓度,当气孔关闭后,植物进行光合作用所需要的CO2就从细胞间来获取。由图1C可知,AMF接种处理后Ci显著高于未接种处理,除了NaCl浓度为300 mmol/L外,其余AMF接种与未接种处理Ci均呈现显著差异(P< 0.05)。NaCl浓度为100、200和300 mmol/L时,AMF接种处理Ci比对照减少3.57%、16.08%、49.55%,而未接种处理Ci则比对照降低了8.52%、29.15%和54.26%。双因素方差分析表明,接种对Ci无显著影响,盐胁迫及两者交互作用对Ci影响均显著(表2)。
2.2.4 桢楠蒸腾速率的变化
蒸腾作用是植物体内的水分以气体形式从植物体内散失到外界大气间的过程,是促进水分在植物体内输送的主要动力。由图1D可以看出,AMF接种处理后蒸腾速率(Tr)显著高于未接种处理,接种与未接种处理Tr均呈现显著差异(P<0.05)。在NaCl浓度为100、200和300 mmol/L时,AMF接种处理Tr比对照减少3.48%、16.04%和27.23%,而未接种处理Tr则比对照降低了16.59%、40.81%和62.33%。双因素方差分析表明,接种对Tr无显著影响,盐胁迫及两者交互作用对Tr影响均显著(表2)。
2.3 盐胁迫下AMF对桢楠叶绿素荧光参数的影响
叶绿素荧光技术可以检测逆境下植物的光合生理状况,能够反映植物对干旱、盐碱等逆境胁迫的忍受能力。盐胁迫下,AMF接种后桢楠Fv/Fm、ΦPSⅡ、qP没有显著变化,而未接种处理的Fv/Fm、ΦPSⅡ、qP均显著降低(图2A、2B、2C)。在对照和NaCl浓度为0、100和200 mmol/L时,AMF接种处理Fv/Fm、ΦPSⅡ均显著高于未接种,而接种处理qP在对照和NaCl浓度为100 mmol/L时和未接种无显著差异,但在200、300 mmol/L时差异显著;随着盐浓度升高,在NaCl浓度为300 mmol/L时,未接种处理NPQ显著升高,而接种处理NPQ没有显著变化(图2D)。NPQ在NaCl浓度为0、100和200 mmol/L时,AMF接种与未接种差异不显著,在300 mmol/L时未接种NPQ显著高于AMF接种。双因素方差分析显示AMF接种对ΦPSⅡ有显著影响,盐胁迫对ΦPSⅡ和qP影响显著,两者交互作用仅对Fv/Fm有显著影响(表2)。
3 讨 论
盐胁迫对植物的影响在最初阶段主要表现为对植物光合作用的影响,盐离子浓度的升高抑制了叶绿素合成过程中必需元素的吸收,降低叶片中叶绿素含量[23],而叶绿素含量的多少又影响植物对光能的吸收、转移和转换。研究发现盐胁迫条件下,接种AMF显著增加了(ZeamaysL.)[24]和(RobiniapseudoacaciaL.)[25]叶片的叶绿素含量。本试验结果表明,盐胁迫下AMF接种处理的光合色素含量均显著高于未接种处理。随着NaCl浓度增加,接种处理的Chl a、Chl b和Car含量均呈现先上升后下降的趋势,这是由于在轻度盐胁迫下接种AMF促进了桢楠对矿质营养元素的吸收,从而增加了合成光合色素酶的活性,提高了植株中的叶绿素含量和光合能力;同时试验发现未接种AMF处理的Chl a、Chl b和Car含量均呈下降趋势,表明在盐胁迫下植物光合色素合成酶的活性受到抑制,进而降低了未接种叶片的叶绿素含量。
植物的光合作用是植物初级代谢过程中一个十分关键的过程,AMF能够提高盐胁迫下植物的光合能力是由于在接种植株中气体交换能力和光合酶活性增强。研究发现在盐胁迫下接种幼套近明囊酶(C.etunicatum)后增加了(OryzasativaL.)的光化学效率和气孔导度,提高了二磷酸核酮糖羧化酶/加氧酶的活性[26]。本试验结果发现盐胁迫下AMF接种处理的Pn、Gs、Ci、Tr均显著高于未接种处理,尤其是未接种处理的Pn和Tr在高盐浓度下显著低于AMF接种处理。可能在这个过程中植物叶片部分气孔关闭,使得气孔对CO2的通过性降低,限制了外界CO2进入叶片内部,导致植物体内可以利用的CO2减少,而接种AMF提高了叶片气孔对CO2的通过性,使得可以利用的CO2增加,从而增加了植株的光合作用。
光系统Ⅱ(PSⅡ)可以反映植物的光合能力和能量利用效率,且对盐胁迫非常敏感。盐胁迫能够使植物的叶绿体结构受到损伤,进而降低植物的光合效率[27]。本研究中,盐胁迫下接种AMF能够提高桢楠的Fv/Fm、ΦPSⅡ、qP,表明接种后PSⅡ光化学量子效率和电子传递的能力升高。而NPQ增加是植物自身对盐胁迫产生的一种光保护机制,这种机制同时也会导致光化学量子效率降低。本研究发现AMF接种处理NPQ在盐胁迫下无显著变化,而未接种处理在高盐胁迫下NPQ则显著升高,这意味着接种AMF后桢楠将吸收的光能更多地用于光合作用,从而增加了对光能的利用效率。
综上所述,本试验结果证实桢楠在盐胁迫下接种AMF具有较强的增抗作用,AMF能够增强桢楠的光合色素含量、净光合速率、气孔导度、叶绿素荧光参数等光合特性,提高对光能的吸收利用效率,从而减轻了盐分对桢楠造成的伤害,表明AMF能够增强桢楠的耐盐性,进而能够促进桢楠在盐碱性土壤中生长。
