‘红叶’杜仲叶色转变过程中叶片生理指标变化
2021-02-02路买林陈梦娇张嘉嘉赵建霞朱景乐杜红岩
路买林,陈梦娇,张嘉嘉,赵建霞,朱景乐,杜红岩*
(1. 国家林业和草原局泡桐研究开发中心,河南 郑州 450003;2. 河南林业职业学院,河南 洛阳 471002;3. 河南农业大学林学院,河南 郑州 450002;4.郑州植物园,河南 郑州 450042;5. 经济林种质创新与利用国家林业和草原局重点实验室,河南 郑州 450003)
植物叶片颜色由叶绿素、类胡萝卜素和花色苷三大类色素共同决定,而颜色变化的直接原因就是叶片中的色素种类和含量发生变化,其中对叶片产生红色作用最大的是花色苷[1-3]。花色苷合成途径属于类黄酮代谢途径,是植物重要的次生代谢途径,其中苯丙氨酸裂解氨酶(PAL)和查尔酮异构酶(CHI)在花色苷合成中起到重要作用。
‘红叶’杜仲(Eucommiaulmoides‘Hongye’)是中国林业科学研究院经济林研究开发中心选育的药用观赏兼备的优良品种,在园林绿化及保健品开发等领域均具有广阔的应用前景[4]。‘红叶’杜仲叶片暗红色,颜色指数和花色苷含量与已知品种差异显著,而叶片pH、可溶性糖的种类及含量均无显著差异[5],叶片呈色组织是栅栏组织[6]。自展叶后‘红叶’杜仲叶片在强光下逐步变成紫红色并保持至落叶,但是目前关于‘红叶’杜仲叶色变化过程中叶片的色差值、色素含量及酶活性变化规律,以及上述指标间的关联性的研究报道。笔者以‘红叶’杜仲和与其色素含量差异最大的‘小叶’杜仲(E.ulmoides‘Xiaoye’)为材料,通过对叶片颜色转变过程中色素含量、酶活性及叶片色差值的测定,探寻形态指标和生理生态指标间的变化规律及相关关系,以期为揭示‘红叶’杜仲叶片典型呈色机理提供科学参考。
1 材料与方法
1.1 研究材料
供试杜仲材料取自原阳杜仲良种繁育圃(113°46.24′~113°47.59′E,34°55.30′~34°56.45′N)。砧木2011年播种,行距40 cm,株距5 cm左右;当年7月中旬分别嫁接‘红叶’杜仲和‘小叶’杜仲;2012年春季剪砧,后期管理中保留1个优势芽。
1.2 研究方法
1.2.1 取样方法
在试验林内选择‘红叶’杜仲和‘小叶’杜仲各5株并记录新叶完全展开的日期。2013年7月3日10:00—11:00,从顶端第3片叶子开始,依次向下取样,每隔3片叶取样1次,每个单株为1个生物学重复。待测定的叶片从上而下完全展叶后时间分别是6 d(6月26日展叶)、14 d(6月19日展叶)、22 d(6月12日展叶)、30 d(6月5日展叶)及38 d(5月29日展叶)。
1.2.2 叶片色素含量测定
采用Fadeel[7]的方法测定叶绿素和类胡萝卜素含量。称量剪去叶脉后成熟叶片0.10 g(精确到0.01 g),加入90%丙酮10 mL黑暗研磨后(4 000 r/min)离心10 min,然后取上清液分别测定445、644和662 nm处的吸光值;每次以相同波长下2个吸光值的平均值进行光合色素含量计算[8]。
1.2.3 叶片花色苷含量测定
花色苷含量测定根据 Rabino等[9]的方法并加以改进。将新鲜叶片用清水洗净,准确称量剪去叶脉的叶片 0.10 g(精确到 0.01 g),研磨加入体积分数1% HCl-甲醇溶液 10 mL,于32 ℃恒温培养箱中 5 h,不时摇荡,取出过滤。1%HCl-甲醇溶液稀释5倍后作为待测液。以1% HCl-甲醇溶液为对照,分别测定 530、657 nm 处吸光值(记为A530与A657);每个品种重复 5 次,每次以相同波长下的 2 个吸光值的平均值进行花色苷含量(CA)计算,CA=(A530-0.25×A657)V/(W×1 000)。具体操作见文献[10]。式中:A为在一定波长下的吸光值;C为色素含量,mg/g;V为提取液体积,mL;W为样品鲜质量,g 。
1.2.4 类黄酮含量测定
提取样品,采用三氯化铝显色法测定类黄酮,以芦丁作标准品代替样品作标准曲线,配制50 μg/mL芦丁标准溶液,得到回归方程Y=209.32x+1.58(R2=0.999),绘制黄酮标准曲线,具体实验参照苏东海等[11]的方法。
1.2.5 叶片色差值测定
使用CR2500型色差计(日本MINOLTA公司)测定L(明度值),a*(变红度值)及b*(变黄度值),每个叶片在避开叶脉处随机选择10个点,以其平均值作为该叶片的平均值。利用a*和b*可以计算出色泽饱和度(chroma,C*)和色调角(hur angle,h),其中C*=(a*2+b*2)/2,h=arctan(b*/a*)。计算叶片颜色指数(color index),颜色指数=(180-h)/(L+C*)。采用红色葡萄果实颜色指数的方法来评价果实的外观色泽:颜色指数<2为黄绿、2≤颜色指数<4为粉红、4≤颜色指数<6为深红、颜色指数≥6为蓝黑[12]。
1.2.6 酶提取方法及测定
苯丙氨酸裂解氨酶(PAL)和查尔酮异构酶(CHI)提取方法:在避开叶脉处取0.50 g叶片冻样,加入0.05 mol/L Na2HPO4(pH 7.0)的提取液5 mL,0.05 mol/L抗坏血酸,0.02 mol/L琉基乙醇,冰浴匀浆,4 ℃ 15 000 g离心20 min,上清液为PAL酶和CHI酶的粗提液。每个品种重复5次。PAL酶活性测定参照王惠聪等[13]的方法,CHI酶活性测定参照Lister等[14]的方法进行。
1.3 统计分析
利用SPSS16.0对数据进行方差分析及相关性分析。
2 结果与分析
2.1 杜仲2个品种叶片色差值随时间的变化规律
2个杜仲的叶片色差值在不同时期测定结果如表1所示。
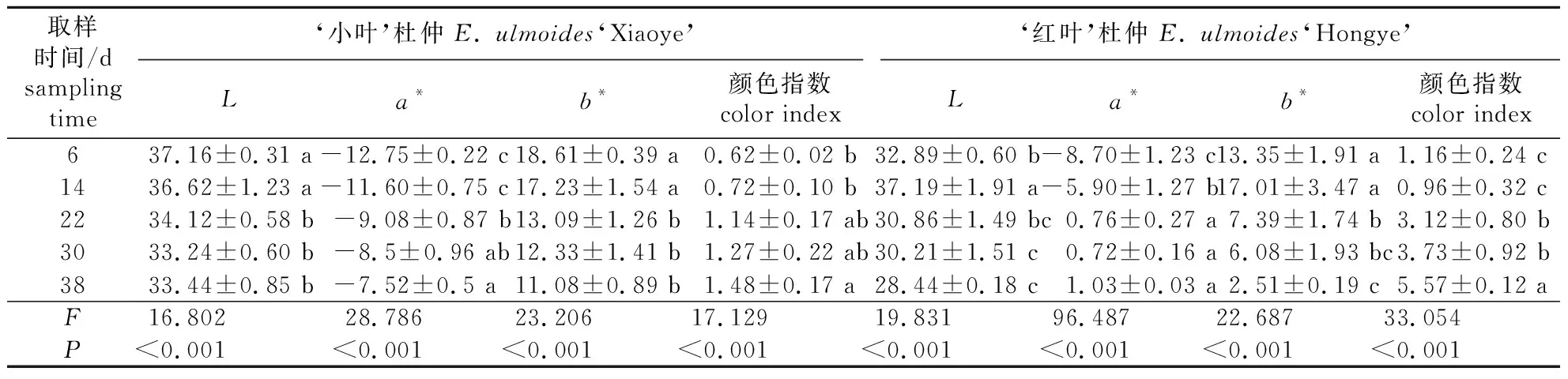
表1 杜仲2个品种叶片变化过程中的色差值
由表1可知,‘红叶’杜仲的L由32.89降至28.44,a*由-8.70升至1.03,b*由13.35降至2.51,L、a*及b*在不同阶段间均存在极显著差异;‘小叶’杜仲的L、a*及b*在不同阶段间亦存在极显著差异;虽与‘红叶’杜仲变化规律相似,但2品种各指标的初始值及变化幅度均存在显著差别。‘小叶’杜仲颜色指数始终属于黄绿级,而‘红叶’杜仲第1、2阶段属于黄绿级,第3、4阶段属于粉红级,第5阶段达到深红级。从叶色随生长时间的变化情况(图1)可知,小叶杜仲始终为绿色,叶片中没有红色物质积累。显微镜下观察红叶杜仲发现,从第14天叶片中开始有红色物质积累;直接观察叶片表面发现叶片最终转为暗红色。
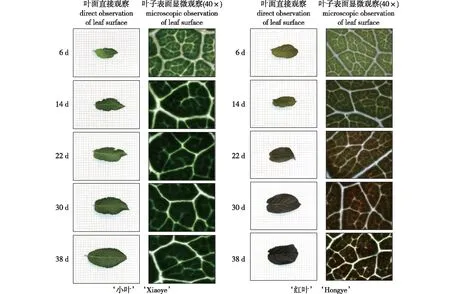
图1 杜仲两品种叶色随生长时间的变化情况Fig.1 Changes of leaf color with growth times of two Eucommia ulmoides cultivars
2.2 杜仲两品种叶片色素含量、酶活性随时间的变化规律
两杜仲品种的叶片色素含量在不同时期测定结果如图2所示,两品种各种色素含量均为逐步上升,其中比较‘红叶’杜仲第38天相对于第6天的增幅,Ca(叶绿素a含量)、Cb(叶绿素b含量)、CT(总叶绿素含量)、CCar(类胡萝卜素含量)、Cf(类黄酮含量)和CA(花色苷含量)分别为64.57%、102.42%、73.72%、21.93%、57.00%和748.96%;‘小叶’杜仲第38天相对于第6天的Ca、Cb、CT、CCar、Cf和CA增幅分别为24.93%、20.18%、23.50%、9.44%、24.40%和135.20%。虽然各种色素含量具有相同的变化趋势,但在上述几种物质中,与叶片颜色变红中最关键的是花色苷含量,而‘红叶’杜仲的CA增幅则是‘小叶’杜仲的553.96%。
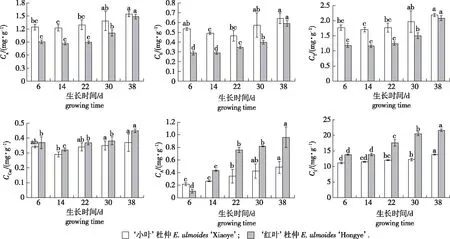
注:小写字母代表同一品种在不同时期差异显著(P<0.05)。The lowercase letters represent the significant differences among different times in the same cultivar.图2 杜仲两个品种叶片色素含量随生长时间的变化规律Fig.2 Changes in leaf pigment content of two Eucommia ulmoides cultivars with growth times
由两品种酶活性随生长时间的变化情况(图3)可知,无论‘小叶’杜仲还是‘红叶’杜仲,不同取样时间的PAL酶活性无显著差异,且各取样时间两品种的酶活性大小相近。而‘红叶’杜仲CHI酶活性随着叶色的转变直线上升,第38天相对于第6天可达306.14%,差异达到极显著水平;‘小叶’杜仲CHI酶活性随着叶色转变也有逐步升高的趋势,但是增幅较小,不同取样时间的酶活性无显著差异。‘小叶’杜仲CHI酶活性仅为‘红叶’杜仲同期的30.66%~59.41%,且随着‘红叶’杜仲叶色转变,二者之间差距逐步增大,因此认为CHI酶在‘红叶’杜仲典型叶色转变过程中起到重要作用。
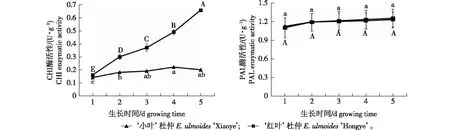
注:小写字母代表‘小叶’杜仲在不同时期差异显著(P<0.05),大写字母代表‘红叶’杜仲在不同时期差异显著(P<0.05)。The lowercase letters represent the significant differences in the E. ulmoides ‘Xiaoye’ among different times and the capital letters represent the significant differences in the E. ulmoides ‘Hongye’ among different times.图3 杜仲两品种PAL酶活性和CHI酶活性在不同时期的变化Fig.3 Changes of PAL enzyme activity and CHI enzyme activity of two Eucommia ulmoides cultivars in different periods
2.3 不同时期形态指标和生理指标间的相关性
由形态指标和生理指标间的相关性分析结果(表2)可知,L、a*及b*与类胡萝卜素含量、花色苷的含量及类黄酮含量呈极显著相关,而与叶绿素a、叶绿素b、总叶绿素含量及叶绿素a与叶绿素b含量比(Ca/Cb)无显著相关关系。CHI酶活性和杜仲叶片L、a*、b*、类胡萝卜素含量、花色苷含量及类黄酮含量间均存在显著或者极显著的相关关系,而PAL与叶片色差值间则无显著相关性。进一步说明CHI酶活性差异在‘红叶’杜仲叶片颜色变化中的影响程度。
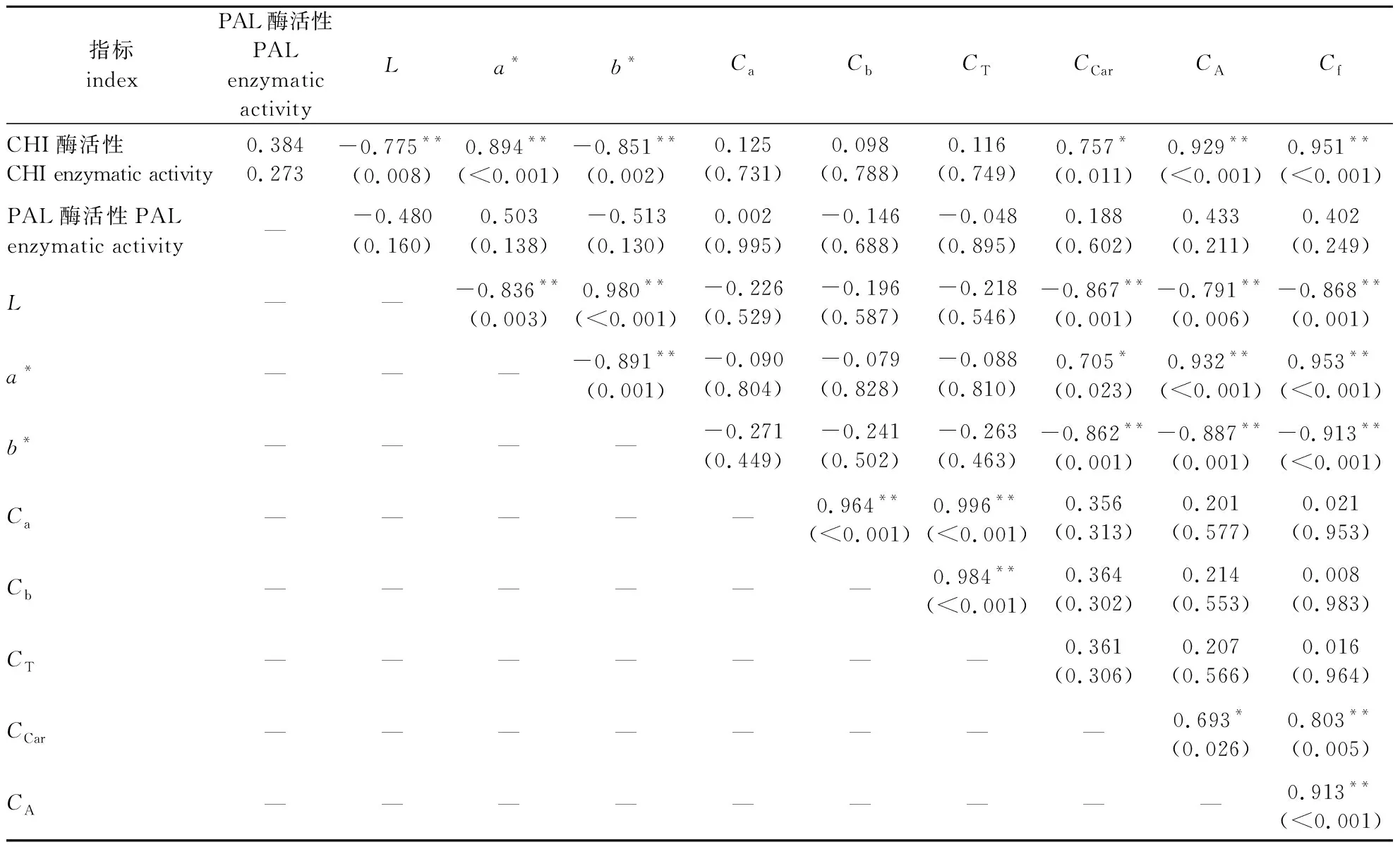
表2 叶色转变过程中叶色指标、色素含量及酶活性的相关关系(n=10)
3 讨 论
叶色是个综合指标,常用的是通过对比标准比色卡进行定性分类,或通过表色系统法测定叶片的L、a*及b*。两种方法均有不足,前者无法进行量化比较,后者则参数太多,单一指标间的比较也不全面。在葡萄果皮颜色研究中常用到颜色指数这一指标,即将表色系统法中的3个指标通过计算一个综合指标[15]。本研究参考上述方法,计算杜仲两品种叶片的颜色指数,得到‘小叶’杜仲颜色始终为“黄绿”级,而‘红叶’杜仲的叶片则由“黄绿”级—“粉红”级—“深红”级变红,说明了‘红叶’杜仲叶片颜色性状从量变到质变的过程。前人将春季叶色呈红色称春色叶类型,秋季叶色呈红色称秋色叶型,两个以上季节叶色呈红色称常色叶型[16];彭少兵等[16]报道‘红叶’杜仲叶片8—10月颜色均为红色,本研究得到6月12日及之前展叶的叶片,在7月3日已经变成红色,因此应将‘红叶’杜仲分为常色叶类型。颜色指数这一指标在叶片颜色研究中应用较少,本研究也为加速该指标在叶色研究领域中的推广有一定积极意义。
叶片的颜色取决于叶绿素含量、花色苷含量及二者的比值[17],当花色苷所占比例较高时呈现紫红色。春色叶类型的变化规律为叶绿素增加,花色苷减少,如红叶石楠等[18];秋色叶类型的变化规律为叶绿素减少,花色苷增加,如黄栌、红枫等[19-20]。本研究发现,随着杜仲叶片生长时间的延长,两个品种的花色苷和叶绿素含量均逐步增加,但‘红叶’杜仲叶片叶绿素含量的增幅小于花色苷含量的增幅,‘小叶’杜仲虽然也是同样逐步增加的趋势,但是花色苷增加幅度小于‘红叶’杜仲的增加幅度,所以最终呈现出‘红叶’杜仲叶片由绿变红,而‘小叶’杜仲叶片始终为绿色。本研究结果丰富了常色叶类型的红叶植物叶片色素的变化规律。
花色苷合成属于类黄酮代谢途径的分支,是植物重要的次生代谢途径之一,在代谢途径中各种酶起到重要的作用。本研究得到CHI酶活性在两个品种叶色转变过程中,CHI酶活性的变化与花色苷含量存在极显著的正相关关系,不同时期的酶活性均存在显著差异,且‘红叶’杜仲的CHI酶活性增加幅度显著高于‘小叶’杜仲;而PAL酶在两个品种叶色转变过程中变化趋势一致,同一品种不同时期及不同品种相同时期的差异均不显著,且PAL酶活性与花色苷含量无显著相关性。所以认为不同品种间CHI酶活性的差异是‘红叶’杜仲特殊叶色转变的主要原因。本研究结果并不是说PAL酶对花色苷合成不重要,而是说PAL酶活性在两个品种间无显著差异,PAL酶是位于CHI酶之前的酶,是下游生产底物的保障,两个杜仲品种在各阶段PAL酶活性没有显著差异,说明为下游提供同样的底物,但最终差异的产生是在于下游酶活性的差异。关于PAL酶活性和CHI酶活性对花色苷合成的作用存在争议[13],部分学者认为PAL对花色苷无显著作用[21],也有部分学者认为其与花色苷紧密相关[10];普遍认为CHI酶对花色苷合成起关键作用。笔者认为PAL酶和CHI酶均是花色苷合成前期的关键酶,缺失一个均能导致代谢途径的中断,其对合成花色苷的意义均非常重要,不能分开而论。但如果从比较不同品种间合成花色苷能力的角度出发,则能分析其中哪个酶活性是影响花色苷合成能力高低的关键因子,从而反向推导上游基因功能差异,对揭示不同品种叶色差异起到参考作用。
‘红叶’杜仲色差值在不同阶段间差异明显,且其叶色各指标的变化幅度远高于‘小叶’杜仲,最终从视觉上呈现红色。造成色差值指标变化的直接原因是花色苷含量在‘红叶’杜仲中的增加幅度远大于‘小叶’杜仲中,其中不同品种CHI酶活性的差异是主要原因之一。
