油用牡丹‘凤丹’种子层积过程中营养物质的代谢变化研究
2021-02-02孙海燕朱铭玮李永荣李淑娴
孙海燕,李 强, 朱铭玮,李永荣, 李淑娴*
(1.南京林业大学,南方现代林业协同创新中心,江苏 南京 210037;2. 南京绿宙薄壳山核桃科技有限公司,江苏 南京 210014)
油用牡丹是集油用、观赏、药用等多种用途于一体的重要经济植物,具有极高的开发利用价值[1]。‘凤丹’(Paeoniaostii‘Feng Dan’)是油用牡丹两大品种群之一[2],由杨山牡丹演化而来,原产于安徽铜陵、亳州,籽油中不饱和脂肪酸含量高达90%以上,其中α-亚麻酸占42%,显著高于大豆、花生、橄榄油等食用油[3-4]。‘凤丹’不仅结实性强,还具有耐寒、耐旱、耐瘠薄等特点[5]。
生产中‘凤丹’通常以播种繁殖为主,但是种子存在休眠习性,自然条件下种子发芽历时较长且出苗率较低,严重制约了油用牡丹的栽培与推广[6]。多位学者对牡丹种子休眠的研究发现,上胚轴、下胚轴是造成种子休眠的主要原因,并且上胚轴休眠程度更深[7-8];也有研究表明,‘凤丹’种子内存在的内源抑制物是造成种子休眠的一个重要原因[9];一些学者采用激素处理对打破上胚轴休眠的方法进行了研究[10],但未开展种皮对种子休眠的影响、休眠解除过程中胚形态变化的研究,对休眠解除过程中种子营养物质的变化及其与休眠关系的研究鲜见报道。笔者以‘凤丹’种子为材料,通过对层积过程中种皮结构、种子大小、种胚形态以及相应生理生化指标的测定,进一步探究‘凤丹’种子的休眠特性,为解除种子休眠、促进种子萌发提供理论指导。
1 材料与方法
1.1 试验材料
‘凤丹’种子于2018年8月采自南京六合绿宙油用牡丹研究所基地内,人工剥出种子后,将其与湿沙按体积比1∶3的比例混合,在10 ℃冷库中层积2个月,胚根突破种皮后,再在5 ℃冷库中层积至上胚轴露出床面。随机数取40粒以上层积0 d(Ⅰ阶段)、层积30 d(Ⅱ阶段)、胚根刚突破种皮(Ⅲ阶段,层积45 d)、胚根伸长1~3 cm(Ⅳ阶段,层积60 d)、5%的种子上胚轴露出床面(Ⅴ阶段,层积130 d)等5个阶段的种子,清水洗净后做好标记,放入-80 ℃冰箱保存待用。
1.2 种子吸水特性研究
随机数取30粒自然晾干的种子(含水率在10%左右),重复3次,称质量(M0)后将其置于烧杯中浸种,每8 h 取出种子,用吸水纸吸干表面水分,再次称质量(M1),直至种子质量不再增加为止。参照文献[10]计算种子的吸水率,并绘制吸水曲线。
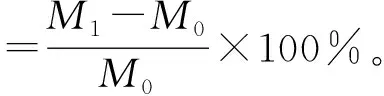
1.3 层积过程中种子大小及种胚形态观察
随机数取上述5个层积阶段的种子各30粒,重复3次,用游标卡尺分别测量种子的横径和纵径。纵切种子,露出胚,在体视显微镜下观察种胚形态的变化,并对各阶段种胚进行拍照。
1.4 种皮结构的扫描电镜观察
随机数取干种子和层积30 d的种子各10粒,参照朱莉伟等[12]的方法,借助S-3000扫描电镜(SEM)对种脐、合点端、种子中间部位种皮的纵切面进行观察,挑选合适的视野进行拍照。
1.5 层积过程中种子生理生化指标的测定
采用索氏提取法[13]测定粗脂肪含量,具体为:分别从上述5个不同层积阶段的种子中随机取30粒,重复3次,将其切碎后置于-70 ℃超低温条件下预冻1 h,然后置于真空冷冻干燥机中冷冻干燥至恒质量(干燥条件:真空度7.2~8.0 Pa,冷凝温度-45 ℃以下),将种子研磨成粉末,称取3g样品置于脱脂滤纸上(已于105 ℃下烘至恒质量,质量为M0),将其包裹严密后再次称质量(M1),在研钵中将其碾碎;以石油醚为浸提液,在65 ℃的水浴锅中反复抽提24 h;取出浸提后滤纸包并放入通风橱,待石油醚挥发后,在65 ℃的烘箱内烘至恒质量(M2)。按下式计算粗脂肪含量:
随机数取供试材料中5个不同层积阶段的种子各30粒,重复3次,去除种皮后用剪刀将种子剪成小块,混合后研磨成粉末,称取0.5 g,采用考马斯亮蓝-G250法[13]测定种子中可溶性蛋白的含量,采用蒽酮比色法[13]测定可溶性糖、淀粉的含量。
分别称取上述5个层积阶段种子的粉末各0.3 g,重复3次,采用愈创木酚法[13]测定过氧化物酶(POD)活性。采用试剂盒法(购于苏州科铭生物技术有限公司)测定酸性磷酸酶(APA)活性[14]。
1.6 数据处理
图表绘制采用Excel 2010和Origin 2017,数据处理运用SPSS 22进行。
2 结果与分析
2.1 ‘凤丹’种子的吸水特性
‘凤丹’种子的吸水曲线见图1。从图1可知,‘凤丹’种子的吸水速度较快,浸种72 h 后吸水率已达50. 6%,随后达到吸水平衡。由此可以推论,‘凤丹’种子的种皮具有较好的透水性,透水性不是限制种子萌发的重要原因。
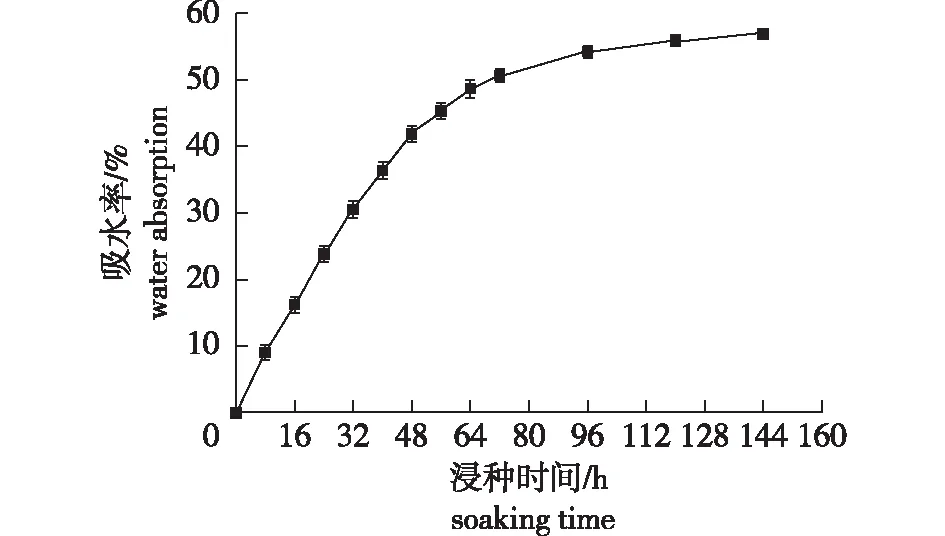
图1 ‘凤丹’种子的吸水曲线Fig.1 The water absorption curve of Paeonia ostii ‘Feng Dan’ seeds
2.2 层积过程中种子大小的变化
由层积过程中‘凤丹’种子大小的变化(表1)可知,层积30 d后(Ⅱ阶段),种子纵径由8.97 mm显著增加至10.44 mm,增加了16.4%;横径由6.42 mm显著增加至8.87 mm,增加了15.0%。之后种子大小增加缓慢,直至上胚轴出现的第Ⅴ阶段,种子大小基本保持不变。
2.3 层积过程中种胚形态的变化
5个不同层积阶段的‘凤丹’种子,纵切后种胚的形态变化见图2。层积处理前的成熟种子(Ⅰ阶段),种胚较小(图2 A);层积30 d(Ⅱ阶段)的种子,两片子叶略有增大,下胚轴略有增粗(图2B);胚根突破种皮即刚萌动的种子(Ⅲ阶段)时,子叶进一步增大,胚根、下胚轴明显伸长和增粗(图2C);胚根伸长1~3 cm时(Ⅳ阶段),可观察到随着胚根的不断伸长,子叶继续变大,但上胚轴仍然没有伸长(图2D);第Ⅴ阶段时才能够观察到上胚轴明显的伸长(图2E)。
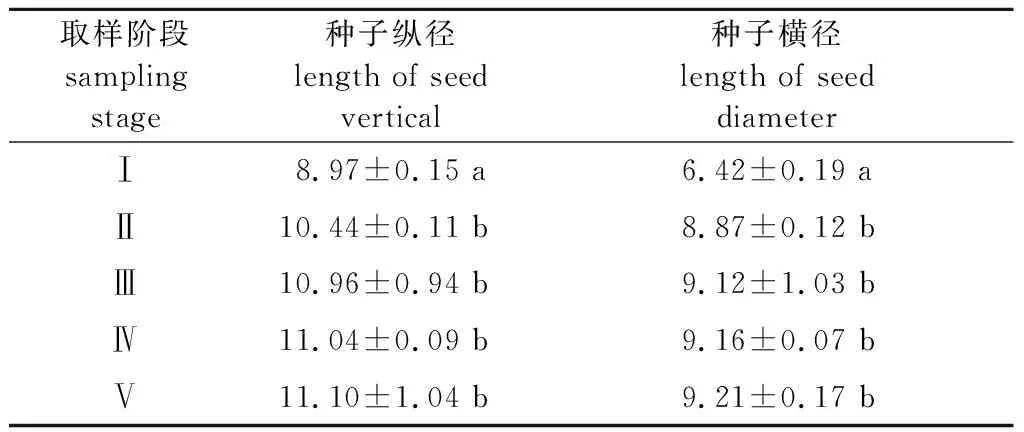
表1 层积过程中‘凤丹’种子大小变化
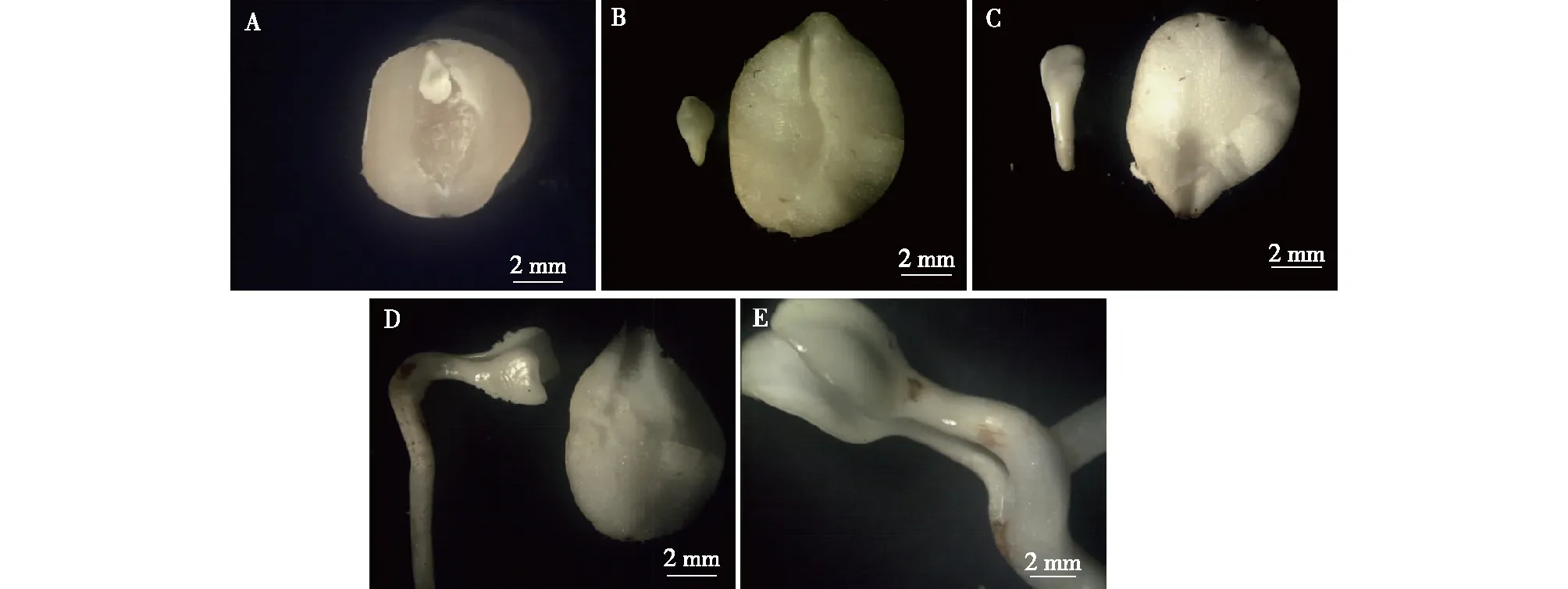
A.成熟种子matured seeds;B.层积30 d seeds stratified for 30 d;C.露白期radicle appeared;D.胚根伸长1~3 cm radicle elongated to 1~3 cm;E.上胚轴伸长且子叶露出The epicotyl is elongated and the cotyledons are exposed outside the seeds.图2 ‘凤丹’种子休眠解除不同阶段种胚的形态变化Fig.2 Changes of embryos at different stratification stages of Paeonia ostii ‘Feng Dan’ seeds
2.4 ‘凤丹’种皮结构的扫描电镜观察
层积处理前后‘凤丹’种皮剖面超微结构如图3所示。由图3可知,种脐、中间部位及合点端3个部位的种皮结构均无明显差异,种皮均由3层结构组成,由外而内分别是角质层(cutile layer)、栅栏层(palisade layer)和薄壁细胞层(parenchymatous layer)(图3A、3C、3E)。角质层位于最外侧,较薄,表面被一层蜡质所覆盖。与角质层紧挨着的是栅栏层,栅栏层占种皮结构绝大部分,由单层长柱状纵向排列的大石细胞构成,长轴一般与角质层相垂直。这些长柱状细胞排列整齐紧密,细胞间虽有一定空隙,但空隙不大(图3A、3C、3E中白色箭头所示);最里面是由很多细胞堆叠而成的薄壁细胞层,薄壁细胞间也有较多的空隙(下图中红色箭头所示)。低温层积30 d后,角质层与栅栏层间出现了明显的孔洞,使种皮透性进一步加大,薄壁细胞层中各细胞间的空隙也变得更大(图3B、3D、3F,图中黑色箭头所示)。由此可以推测,低温层积可以进一步软化种皮,增加种皮的透性,有利于种子的萌发。
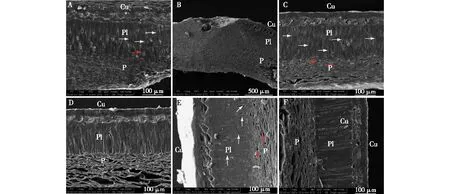
A.成熟种子种脐部位种皮(300×)the seed coat structure of matured seed at hilar region(300×);B.处理组种脐部位种皮(80×) the seed coat structure of seeds stratified for 30 d at hilar region(80×); C.干种子中间部位种皮(300×)the seed coat structure of dried seed at middle part(300×);D.处理组中间部位种皮(300×) the seed coat structure of seeds stratified for 30 d at middle part(300×); E.干种子子叶末端种皮(300×)the seed coat structure of dried seed at the bottom of cotyledon(300×);F.处理组子叶末端种皮(300×) the seed coat structure of seeds stratified for 30 d at the bottom of cotyledon (300×). Cu.角质层cuticle player; Pl.栅栏层palisade player; P. 薄壁细胞层parenchymatous layer。白色箭头表示栅栏层中的空隙 White arrows indicate that there is a crack in the palisade layer; 红色箭头表示薄壁细胞层中的空隙 Red arrows indicate that there is a crack in the parenchymatous layer; 黑色箭头表示角质层与栅栏层间出现了孔洞Black arrows indicate that there is a hole between the cuticle and palisade layers.图3 层积处理前后‘凤丹’种皮剖面结构观察Fig.3 Observation on the seed coat structures of Paeonia ostii ‘Feng Dan’ before and after stratification
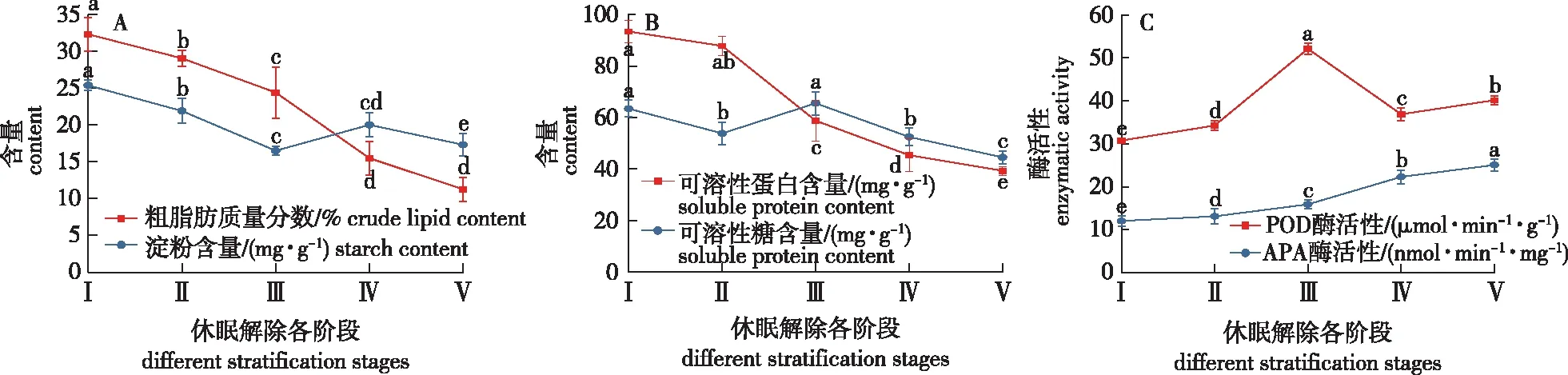
图4 休眠解除不同阶段‘凤丹’种子营养物质及其酶活性的变化Fig.4 The dynamic changes of nutrient contents and enzyme activity during the different stratification stages of Paeonia ostii ‘Feng Dan’ seeds
2.5 层积过程中种子生理生化指标的变化
2.5.1 粗脂肪含量的变化
‘凤丹’种子含油率一般在30%左右,因此粗脂肪是胚乳中的主要贮藏物质,在种子休眠解除与萌发过程中,在相关酶的作用下,粗脂肪逐渐被转化成小分子物质,为种子萌发提供能量和物质基础。由种子营养物质变化情况(图4A)可以看出,层积过程中,粗脂肪含量一直呈下降的趋势:层积处理前粗脂肪含量占种子鲜质量的32.3%;层积过程中,粗脂肪含量显著下降,胚根突破种皮之后(Ⅲ—Ⅳ阶段),下降速度尤其快,这可能是由于胚根伸出后,需要消耗更多的能量物质;随着层积时间的延长,上胚轴开始伸长,粗脂肪含量下降的速度有所变缓。第Ⅴ阶段时种子中脂肪含量仅为开始时的11.3%,说明大多数脂肪物质已被消耗用于种子的萌发、生长。
2.5.2 淀粉含量的变化
种子中的淀粉主要以淀粉粒的形式存在,是植物组织中最普遍的贮藏物质,也是种子中最重要的多糖之一。层积过程中,淀粉在淀粉酶的作用下逐渐分解为易吸收的小分子物质,并参与萌发过程中的代谢作用。由图4A可知,淀粉含量总的来说呈逐渐降低的趋势:层积处理前,淀粉含量最高,为26.7 mg/g;至第Ⅲ阶段时,淀粉含量显著下降至17.8 mg/g;但至第Ⅳ阶段时,淀粉含量有小幅增加,为18.4 mg/g,但与第Ⅲ阶段相比差异不显著。随着胚根的不断伸长,上胚轴也开始延伸,淀粉含量又继续缓慢下降,第Ⅴ阶段时,达到最低值14.7 mg/g,与Ⅰ阶段相比,下降了45.2%。
2.5.3 可溶性蛋白含量的变化
随着层积时间的延长,‘凤丹’种子中可溶性蛋白的含量也呈逐渐下降的趋势(图4B),只是开始阶段下降的速度较为缓慢,含量由层积处理前的93.4 mg/g下降至87.8 mg/g(Ⅱ阶段),并且二者差异不显著;但随后的几个阶段,可溶性蛋白含量下降速度较快,特别是Ⅱ—Ⅲ阶段,下降速度尤其快。这可能是由于胚根伸长需要较多的能量和营养物质,并且这些营养物质和能量更主要的是由可溶性蛋白的降解来提供;随后可溶性蛋白含量的下降速度略有减慢,但各阶段仍差异显著。至第Ⅴ阶段时,可溶性蛋白含量下降至整个层积过程的最低值39.3 mg/g,与第Ⅰ阶段的种子相比,下降了57.8%。
2.5.4 可溶性糖含量的变化
层积过程中,‘凤丹’种子中可溶性糖含量总体呈现下降—上升—下降的变化趋势(图4B)。层积前(第Ⅰ阶段)的种子内可溶性糖含量为63.4 mg/g;层积30 d后,可溶性糖含量显著下降至53.8 mg/g;但随着层积时间的延长,至Ⅲ阶段时,可溶性糖含量反而增加到65.5 mg/g,并且显著高于层积前的含量,这可能是由于种子内贮藏物质如淀粉大量分解转化成可溶性糖的原因;胚根突破种皮后,由于胚根以及胚轴的生长,可溶性糖被大量消耗,含量又开始不断下降,到Ⅳ阶段时,可溶性糖含量下降到52.5 mg/g,与第Ⅰ阶段相比下降了17.3%;随后由于胚根、子叶以及上胚轴的生长,可溶性糖被继续利用,至第V阶段时,含量显著降低到44.6 mg/g,比第I阶段下降了29.8%。
2.5.5 过氧化物酶(POD)活性的变化
以往研究表明,POD在调控种子休眠和胚根不断伸长等方面起着重要作用,其活性越高对种子萌发的促进作用越明显[14]。图4C的结果表明,层积前种子(第I阶段)内POD酶活性较低;随着层积处理时间的延长,POD酶活性呈现波动上升的趋势,至第Ⅲ阶段时,POD酶活性显著增强,达到整个休眠解除过程的最大值52.1 μmol/(min·g)。随后,POD的活性略有下降,至第Ⅳ阶段时,POD酶活性降低至36.9 μmol/(min·g);至第V阶段时,POD酶活性又开始缓慢回升,仍显著低于Ⅲ阶段。
2.5.6 酸性磷酸酶(APA)活性的变化
大多数植物种子中都存在APA,该酶可以促进种子中贮藏物质如粗脂肪的分解,在其他营养物质的转化中也起着重要作用[15-16],因此该酶的活性会伴随着代谢活动的进行而不断变化。本研究发现,层积过程中,APA逐渐被活化,其活性也不断提高(图4C),尤其是在胚根突破种皮之后的伸长阶段(Ⅲ—Ⅳ),APA酶活变化幅度最大,达到了22.3 nmol/(min·mg),之后,酶活性增加的速度变慢,在上胚轴伸长的第Ⅴ阶段达到最高值25.1 nmol/(min·mg)。
3 讨 论
3.1 ‘凤丹’种子休眠的原因
种子休眠是指在适宜的条件下具有生活力的种子不能发芽或延迟发芽的现象,是植物本身为了适应环境而进化的一种生存对策[17]。研究表明,导致种子休眠的原因有很多,通常与种皮结构、种胚发育状况和种子中存在萌发抑制物等有关[18-19]。贾书果[20]通过扫描电镜观察发现,秤锤树(Sinojackiaxylocarpa)种子外部结构致密,通透性差是引起秤锤树种子休眠的主要原因。银杏(Ginkgobiloba)种子成熟后胚极小,需要经过一个后熟过程才能得以分化生长,是典型的胚后熟休眠类型[21]。洑香香等[22]研究发现,山茱萸(Cornusofficinalis)种子属复杂的多因素综合休眠,既存在种皮机械阻碍,还存在胚的形态休眠。
已有研究表明,角质层和栅栏层的存在是阻碍种子吸水的主要原因,并且角质层和栅栏层越厚,种皮的透水性越差[23-24]。本研究种皮扫描电镜观察发现,‘凤丹’成熟种子的种皮虽然也有角质层、栅栏层,但角质层仅由一层很薄的蜡质所覆盖,栅栏层、薄壁细胞层中有较多的空隙。吸水曲线的结果表明,‘凤丹’种子在浸种72 h时,吸水率达到50.6%,因而种皮对种子的吸水没有影响。层积30 d时,薄壁细胞层中的空隙变得更大,角质层与栅栏层间也出现了明显的孔洞,这些结构的变化明显增加了种皮的透性。另外,层积30 d时种子纵径、横径明显变大,这些都从另一侧面说明吸水不是造成‘凤丹’种子休眠的主要原因。
层积过程中胚结构的解剖观察发现,层积近2个月后,胚根才能明显伸长、变粗,最终突破种皮;‘凤丹’种子属于子叶留土型萌发方式,胚根出现后还需经过3个多月的层积,上胚轴才能表现出较为明显的伸长并伸出土面。种胚的解剖观察,从另一角度证明下胚轴休眠和上胚轴休眠是‘凤丹’种子休眠的两个关键阶段[25]。
结合以往的同类研究可以进一步明确:‘凤丹’种子不存在吸水障碍,导致种子休眠的原因主要是存在胚生理后熟和上胚轴休眠现象,这与芍药属植物的休眠类型一致[8]。
3.2 营养物质代谢及其酶活性对‘凤丹’种子萌发的影响
3.2.1 营养物质含量变化对‘凤丹’种子萌发的影响
大量研究表明,种子的休眠与萌发状态取决于种子内部能量的动态平衡。当胚和胚乳中贮藏的大分子物质在各种酶的作用下分解并转化为易被吸收的小分子物质时,种子才会逐渐从休眠状态转化为萌发状态[26-27]。种子内营养物质主要包括蛋白质、糖类和脂肪三大类,蛋白质可分解成小分子氨基酸为种子萌发提供氮源,脂肪和糖类物质为种子解除休眠与萌发阶段的呼吸作用提供基础物质[28]。
有研究指出,对于粗脂肪含量丰富的油料种子,在休眠解除过程中,脂肪在脂肪酶的作用下水解成脂肪酸和甘油,再进一步转化为糖类物质,为种子的萌发奠定物质基础[29]。‘凤丹’种子粗脂肪含量丰富,占30%左右,层积过程中,随着休眠的不断解除,胚乳内的粗脂肪呈现逐渐降低的趋势,在测定的最后一个阶段达到最低值。由于粗脂肪的分解,为胚根的伸长和子叶的萌动提供了必要的能量。本研究测定的几个指标中,粗脂肪含量下降最多的较第Ⅰ阶段下降了88.7%。韩克杰等[30]在研究中同样发现,欧洲榛子(Corylusavellana)种子在胚根突破种皮后脂肪开始大量水解,供种子萌发利用。也有学者在南方红豆杉(Taxuschinensis)的研究中也发现,种子层积过程中粗脂肪含量呈逐渐下降趋势,且粗脂肪的分解和利用可能是种子休眠解除的关键原因[31-32]。
淀粉是种子中普遍存在的大分子贮藏物质,大多数淀粉可以在淀粉酶的催化下水解成葡萄糖,为种子萌发提供能量;而可溶性糖是种子呼吸作用进行的最直接的能量物质,它可由淀粉、脂肪等贮藏物质降解而得到补充[33]。本研究中,‘凤丹’种子中淀粉含量呈现逐渐下降的趋势,说明层积过程中,淀粉不断被水解为可溶性糖供胚生长利用,这与越南安息香(Styraxtonkinensis,俗称东京野茉莉)[34]、榧树(Torreyagrandis)的研究结果一致[35]。层积初期,可溶性糖含量逐渐减少,这可能是由于此时种子主要消耗胚乳中贮藏的可溶性糖,随着层积时间的延长,胚根开始突破种皮(Ⅲ阶段),虽然需要的可溶性糖更多,但由于伴随着淀粉和粗脂肪等物质分解速度的加快,种子中其他营养物质的代谢也会产生一定量的可溶性糖(淀粉和脂肪等大分子物质降解的速度大于呼吸消耗的速度),致使可溶性糖含量又逐渐增加;随后由于胚根的伸长,子叶的膨大,上胚轴的伸长,消耗了胚乳内更多的营养物质,可溶性糖含量又呈现不断下降的趋势。四川牡丹(P.decomposita)在层积过程中可溶性糖含量也呈现下降—上升—下降的变化[36],这与本研究结果一致。
种子中贮藏的可溶性蛋白质会经过一系列的生理活动最终降解为氨基酸,为种子休眠的解除和萌发提供足够的氮源,而蛋白质含量的高低也可以间接反映出种子内部生命活动的强弱[37]。本研究中,层积初期可溶性蛋白质基本没有变化,但随着层积的不断进行,其含量呈现逐渐下降的趋势,这与王家源等[15]和戴萍[33]的研究结果一致。
‘凤丹’种子休眠解除过程中,尽管各营养物质的含量基本都呈下降的趋势,但各物质的代谢速度并不一致。如层积初期(Ⅰ—Ⅱ阶段)只有可溶性蛋白质的含量下降不显著,但在Ⅱ—Ⅲ阶段,该指标的下降速度却非常快;而粗脂肪则是在Ⅲ—Ⅳ阶段,下降速度较快。这也从另一个侧面说明,层积过程中,种子体内发生的生理变化不同,代谢的营养物质种类也不相同。
3.2.2 酶活性变化对‘凤丹’种子萌发的影响
种子萌发需要完成大量胚乳贮藏物质的转化,而一系列的转化过程中都离不开酶的作用[38]。本研究中,随着层积时间的延长,过氧化物酶POD活性呈现波动上升的趋势,在胚根突破种皮(第Ⅲ阶段)时,参加反应的POD酶活性显著增强,达到整个层积过程的最大值,正是由于POD酶活性的增加,才更有助于细胞分裂、细胞体积增大以及新细胞壁形成等过程,帮助种子解除休眠。
酸性磷酸酶APA能够协调种子内部物质的转化,在蛋白质的合成和脂肪的代谢中发挥着重要作用[24]。由于‘凤丹’种子中含有大量的粗脂肪,脂肪的水解离不开APA的催化作用,APA在碳水化合物的转化和蛋白质合成中同样起着重要作用[39]。本研究中,随着层积作用的进行,APA活性呈现不断增强的趋势,且与胚乳中粗脂肪含量的变化趋势相吻合,可能正是由于APA在种子休眠解除与萌发过程中不断被激活,才促进了粗脂肪的降解,为种子的萌发提供能量[40]。刘亚萍等[41]在研究中也发现,APA对胡杨(Populuseuphratica)种子的萌发具有重要的调控作用,戴萍[33]、李金霞等[35]在研究中也发现了相同的规律。
