电解原理的理解与运用
2021-02-02袁李李朱怀义
袁李李 朱怀义
(江苏省睢宁县第一中学 221200)
实验是化学的学科特征.课堂教学就是要尽可能地利用教材实验,就可以水到渠成般揭示重点、突破难点,从而提高学生的解题能力.下面以对“电解原理的理解和运用”为例,加以粗浅阐释.
一、将简单实验组合揭示重点——溶液中离子放电顺序的归纳
在学习电解池装置特点后,结合外电路中电流方向(实质电子移动方向),就能够从整体的高度,推断出电极反应的实质——阳极发生失去电子的氧化反应、阴极发生得到电子的还原反应.但电解质溶液中有多种离子,放电顺序究竟如何?可通过已经了解的简单实验组合来归纳(见表1).
这两个实验,均源于课本——电解氯化铜溶液见《化学2》P44、电解硫酸钠溶液见《化学2》P42.通过现象确定放电产物、就明确了各自环境下离子的放电顺序;将二者组合起来,就可以指导我们分析较为复杂情况的电解历程(见第二部分).
二、借鉴显性重点、突破隐形难点——电极反应式的调整书写
在中学阶段,一般认为显性重点是电解NaCl溶液、隐性难点是电解CuSO4溶液.只要把握离子放电的“核心顺序”,则可顺利突破(见表2).
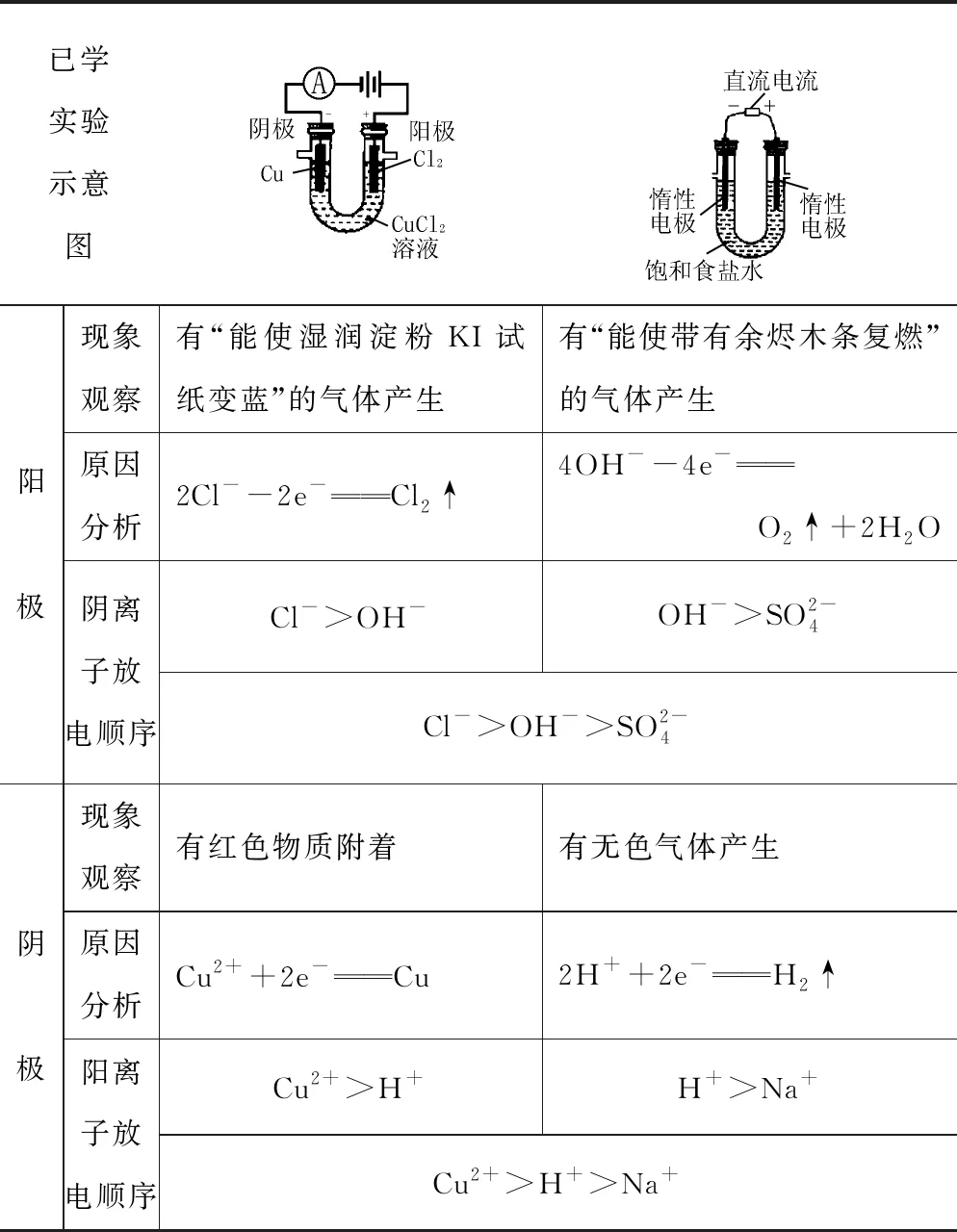
表1

表2
电解氯化钠溶液也源于课本——见《化学1》P40.电解总反应的离子方程式,显然不只是在电量相等原则下将电极反应式的简单加和.这就是实质和表现形式的统一问题:在NaCl溶液和CuSO4溶液中,放电的H+和OH-都是由极弱电解质水电离提供的,所以在书写电解总反应式时,要保留H2O分子形式;在电极反应式合并前,要先将电极反应式稍加调整(见上表).教材未出现电解硫酸铜溶液的实验,但对其电解原理的分析,可以借鉴对氯碱工业生产原理分析.
三、较为复杂情况下电解历程的分析——解题能力的形成
例1在恒定电压和电流的情况下,用惰性电极电解含0.02mol NaCl与0.01mol CuSO4的混合溶液.请分析电解历程分为哪几个阶段?
简析大多学生并不理解此题真意,以为很简单,历程分为电解NaCl溶液、 电解CuSO4溶液两个阶段.此题意在提醒学生,应按放电先后顺序、从离子重组角度来回答.电解历程先是电解溶液中0.01mol CuCl2、后是电解含0.01mol Na2SO4水溶液(实质电解水、Na2SO4起增强溶液导电性作用)两个阶段.
例2在恒定电压和电流的情况下,用惰性电极电解含0.04mol NaCl与0.01mol CuSO4的混合溶液.当20s时,阴极开始产生气体,当两极产生的气体体积理论上相同时,停止电解.请分析电解过程分为几段?写出相应的电极反应式;电解停止时,通电多长时间?
简析受例1启发,大多学生可以推断出电解过程分为三阶段;由于电解第二阶段有氢氧化钠产生,所以第三阶段电极反应式书写要调整为碱性表达形式,这点容易被大多数同学所忽视.由于20s时,阴极开始产生气体,所以据此可以推断电解时段与通过电子电量之间关系,从而进一步推出电解第二阶段也用时20s、但此时(通电40s)两极产生的气体体积并不相同;第三阶段必然进行,且需再用时40s(见表3).

表3
例3用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,若要恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解),需向所得的溶液中加入0.1mol Cu2(OH)2CO3.则电解过程中共转移的电子数为( ).
A. 0.4mol B. 0.5mol C. 0.6mol D. 0.8mol
简析用惰性电极电解一定浓度的硫酸铜溶液(电解原理见二部分),当Cu2+放电结束后,电解历程转化为电解硫酸溶液(实质电解水).将Cu2(OH)2CO3改写为氧化物表达形式[2CuO·H2O·CO2];可知恰好恢复到电解前状态,需要补充0.2mol CuO和0.1mol H2O;进而推求电解过程中共转移电子为0.6mol.
基础知识和学习思维都是形成解题能力的必备支撑.简单中蕴含复杂、显性背后有可供借鉴的思维,分析问题抓本质、从离子角度构建电解历程等等,都是在学习电解原理时厚重收获.
