阿里红多糖通过激活Nrf2/ARE通路改善阿尔茨海默病大鼠海马及脑皮层的氧化应激损伤
2021-02-01苏丽燕赛力木江依木然马瑞士丛媛媛阿依江哈拜克帕丽达阿不力孜
苏丽燕·赛力木江,依木然·马瑞士,丛媛媛,阿依江·哈拜克,帕丽达·阿不力孜
新疆医科大学药学院,乌鲁木齐 830011
阿尔茨海默病(AD)是一种以认知功能障碍、记忆和判断丧失、推理和情绪稳定性中断等症状作为主要表现的慢性进展性中枢神经系统退行性疾病[1]。目前AD发病机制尚不明确,一般认为AD是一种多病因疾病,其发病受年龄、环境、免疫因素、神经突触功能等因素的影响[2]。Aβ沉积导致老年斑的形成是AD的主要病理标志物之一。过量的活性氧(ROS)主要来源于功能紊乱的线粒体(线粒体复合物IV),引起核酸、脂质和蛋白等物质的过氧化损伤[3,4]损伤正常生理机能,因此,ROS的过量产生被看作神经退行性疾病病理过程的推动者之一。
NF-E2相关因子2(Nrf2)是细胞氧化后应激反应中的关键因子,Nrf2转录因子普遍存在于各种器官和组织中[5],在稳态条件下,Nrf2转录受其负调节物Keapl的抑制。当机体暴露于ROS时,Nrf2从胞质Keapl游离出来并转移到细胞核中,结合编码抗氧化酶的基因的启动子区域中的ARE,从而诱导内源性抗氧化酶如NOQl、HO-1、GSH等的产生[6]。由于Nrf2/ARE通路的激活可以增强缓冲自由基生成的能力,因此它为治疗神经退行性疾病(nurodegenerative diseases,NDD)提供了有价值的治疗靶点[7,8]。
阿里红(FomesofficinalisAmes)为多孔菌科药用层孔菌的干燥子实体,是新疆地区的道地药材[11],相关研究报道阿里红多糖具有清除氧自由基、抗衰老、抗氧化、免疫调节、平喘祛痰等生物活性作用[12]。本课题组前期研究结果证明,阿里红多糖对Aβ神经元损伤具有一定的保护作用[13,14],提示阿里红多糖在神经系统疾病治疗方面具有潜在的应用价值,本研究从氧化损伤通路入手,通过双侧脑室注射Aβ建立大鼠AD模型,通过测定Nrf2、Keap1、HO-1、NQO1的mRNA转录水平及蛋白表达水平,探讨阿里红多糖对Nrf2/ARE信号通路的调控,了解其抗氧化机制。
1 材料
1.1 动物
3月龄80只健康雄性SD大鼠,体重250±50 g,由新疆医科大学动物中心提供,质量合格证编号:(SCXK(新)2019-0008),实验对象在SPF级实验室正常饲养,保持充足的光照和通风,笼饲养(3~4只/笼)自由饮水和进食。
1.2 药物及试剂
阿里红粗多糖课题组自制[12]。盐酸多奈哌齐片[卫材(中国)药业有限公司,批号1707094];Aβ1-42(大连美仑生物技术有限公司,批号MB3894);荧光定量试剂盒、逆转录试剂盒(日本TaKaRa公司,批号分别为RR047A、RR820A);Total RNA提取试剂盒(上海玉博生物科技有限公司,批号229009);赛默飞PageRuler预染蛋白marker(美国赛默飞世尔科技公司,批号26619);BCA蛋白浓度测定试剂盒、高效RIPA组织/细胞裂解液、4×蛋白上样缓冲液、抗体稀释液、SDS-PAGE凝胶制备试剂盒、10×TBST缓冲液(北京索莱宝科技有限公司,批号分别为PC0020、R0010、P1016、A1800、P1200-1/P1200-2、D1060);兔抗大鼠多克隆抗体Nrf2、兔抗大鼠单克隆抗体[EPR3309]NQO1(美国Abcam公司,批号分别为Ab929464、Ab80588);兔抗大鼠多克隆抗体keap1(D6B12)、兔抗大鼠多克隆抗体HO-1(E3F4S)(美国Cell Signaling公司,批号分别为8047、43966);β-actin(Affinity Biosciences,批号AF7018);Goat anti rabbit IgG-HRP标记二抗(北京博奥森生物技术有限公司,批号bs-0295G-HRP);三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、甘氨酸(Glycine)、脱脂奶粉(德国Biofroxx公司,批号分别为 1115GR500、3250GR500、1275GR500、1172GR100)。
1.3 仪器
脑立体定位仪(TSE Systems JAPAN);Morris水迷宫视频跟踪分析系统(成都泰盟科技有限公司);全波长酶标仪、实时荧光定量 PCR仪、核酸蛋白定量仪(美国赛默飞世尔科技公司);化学发光凝胶成像系统(美国ProteinSimple公司)。
2 方法
2.1 动物模型的建立及干预
实验前先将所有实验动物进行第一次行为学测试,剔除先天愚钝的大鼠,选取72只作为实验用。无菌条件下,将1 mg Aβ1-42溶于50%的DMSO中,再用无菌生理盐水将其溶解稀释成2 μg/μL,37 ℃恒温箱孵育7天,使其变为聚集态的Aβ1-42。1%戊巴比妥钠(45 mg/kg)腹腔麻醉后,固定大鼠立体定位,使用微量注射器缓慢注射凝聚态Aβ1-42各5 μL于双侧海马内以诱导AD模型。根据大鼠脑立体定位图定位注射部位,前囟后3 mm,矢状缝左右旁开2.5 mm,硬膜下3 mm。注射完毕后缝合皮肤,肌肉注射8万单位青霉素防感染。72只健康雄性SD大鼠称体质量并按随机原则分为空白组、模型组、盐酸多奈哌齐组(0.5 mg/kg),阿里红多糖高、中、低剂量组(100、50、25 mg/kg),每组12只。各组大鼠Aβ1-42注射三天后进行灌胃给药(1.0 mL/100g),每日一次,连续30天。正常对照组和模型组大鼠给予蒸馏水灌胃;阳性对照组给予盐酸多奈哌齐溶液进行灌胃;阿里红高,中,低剂量组使用不同浓度阿里红灌胃治疗。由于脑部手术对动物健康损害较大,造模和恢复期各组均有少数大鼠死亡。因此为了更好的运用统计方法分析资料最后每组取9只大鼠进行下一步实验。
2.2 Morris水迷宫行为学测试
灌胃治疗结束后使用Morris水迷宫测量SD大鼠学习记忆能力。定位航行试验进行连续5天,每天训练2次,圆形水池壁上标有东西南北的四个入水点,它们将水池分为四个象限(A、B、C、D象限),每次从固定的C平台象限及平台对侧象限为入水点将大鼠面向池壁放入水中,然后计算机分析处理系统记录每只大鼠找到安全平台所需的时间(逃避潜伏期)。第六天为空间探索实验,历时1天。移走平台后任选一个入水点将大鼠放入水中,时间为1 min,由计算机分析处理系统记录大鼠原平台所在象限滞留时间百分比和有效区域进入次数等数据。
2.3 RT-qPCR法检测各组大鼠海马和脑皮层中Nrf2、Keap1、HO-1、NQO1 mRNA表达水平
取-80 ℃保存的大鼠海马组织及大脑皮质层,用trizol试剂盒抽提获取总RNA。利用逆转录酶逆转录得到cDNA。然后利用各目的基因序列设计特异性引物,进行荧光定量PCR实验。引物序列见表1。最后根据各反应孔的ct值,采用2-ΔΔCt法计算各组mRNA的相对表达量。

表1 引物序列
2.4 Western blotting法检测各组大鼠海马和脑皮质层中Nrf2、Keap1、HO-1、NQO1蛋白的表达水平
将SD大鼠麻醉后快速断头,冰上取出大鼠新鲜海马组织及大脑皮质层,-80 ℃冻存。取各组大鼠海马组织和大脑皮质层,剪切成细小的碎片,按照每200 mg组织加入150~250 μL裂解液的比例加入RIPA组织裂解液。将裂解后的样品10 000~14 000g在4 ℃ 12 000 rpm条件下,离心10 min,取上清,然后用BCA蛋白定量试剂盒测定蛋白浓度。根据蛋白定量标准曲线计算各样本内蛋白含量。每组取10 μL进行聚丙烯酰胺凝胶电(SDS-PAGE),将蛋白转移至PVDF膜上,加入含5%脱脂奶粉的TBST缓冲液,室温摇床封闭1 h。将封闭的PVDF膜浸泡在以抗体稀释液稀释的Keap1(1∶1 000)、Nrf2(1∶1 000)、HO-1(1∶1 000)和NQO1(1∶10 000)一抗中,4 ℃孵育过夜,洗涤后浸泡在以TBST(1∶10 000)稀释的二抗中,室温孵育1 h。最后将PVDF膜至于凝胶成像仪上加入ECL化学发光剂显色成像并保存。用Image J软件进行灰度分析,以Nrf2、Keap1、HO-1和NQO1与β-actin灰度值的比值表示目的蛋白的相对表达含量。
2.5 统计学方法
3 结果
3.1 对大鼠行为学的影响
结果表明,与空白组比较,模型组大鼠逃避潜伏期显著增长,原平台所在象限滞留时间百分比和有效区域进入次数显著减少(P<0.01);与模型组比较,盐酸多奈哌齐组和阿里红多糖高,中剂量组逃避潜伏期均显著减短,原平台所在象限滞留时间百分比和有效区域进入次数显著增加(P<0.01),结果提示阿里红多糖能够改善Aβ1-42诱导的AD大鼠模型学习记忆能力损。
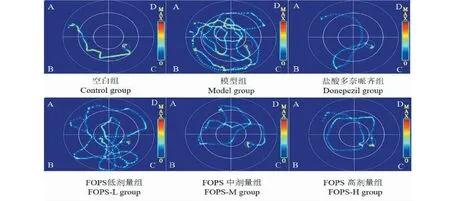
图1 各组大鼠第五天定位航行轨迹图Fig.1 Location trajectory of rats in each group on the fifth day
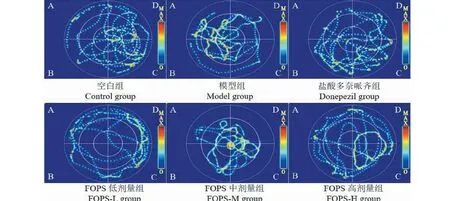
图2 各组大鼠第六天空间搜索轨迹图Fig.2 The spatial search trajectory of rats in each group
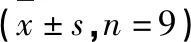
表2 FOPS对大鼠定位航行实验中逃避潜伏期的影响
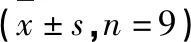
表3 FOPS对大鼠空间搜索实验结果的影响
3.2 对大鼠海马和脑皮层Nrf2、Keap1、HO-1及NQO1 mRNA表达量的影响
结果表明,与空白组比较,模型组Keap1表达量显著升高(P<0.01),而Nrf2、HO-1及NQO1表达量显著降低(P<0.01);与模型组比较,盐酸多奈哌齐组和FOPS高、中剂量组可降低AD大鼠海马组织和脑皮质层中Keapl基因的mRNA表达水平(P<0.01),增加Nrf2基因的激活,从而升高其下游抗氧化反应元件HO-1、NQO1基因的mRNA表达水平(P<0.05,P<0.01)。结果提示阿里红多糖可抑制Keap1的表达量,并提高Nrf2、HO-1及NQO1表达量。
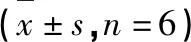
表4 FOPS对大鼠海马区中Nrf2、Keap1、HO-1及NQO1 mRNA表达的影响
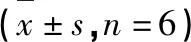
表5 FOPS对大鼠脑皮层中Nrf2、Keap1、HO-1及NQO1 mRNA表达的影响
3.3 对大鼠海马和脑皮层Nrf2、Keap1、HO-1及NQO1蛋白表达量的影响
结果表明,与空白组比较,模型组Keap1蛋白表达量显著升高(P<0.01),而Nrf2、HO-1及NQO1蛋白表达量显著降低(P<0.01);与模型组比较,盐酸多奈哌齐组和FOPS高、中剂量组可降低AD大鼠海马组织和脑皮质层中Keapl蛋白的表达水平(P<0.05,P<0.01),增加Nrf2蛋白的激活,从而升高其下游抗氧化反应元件HO-1、NQO1蛋白的表达水平(P<0.01)。结果提示阿里红多糖可激活Nrf2/ARE抗氧化应激通路发挥抗氧化作用。
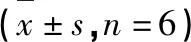
表6 FOPS对大鼠海马组织中Nrf2、Keap1、HO-1及NQO1蛋白表达的影响
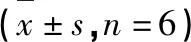
表7 FOPS对大鼠脑皮层中Nrf2、Keap1、HO-1及NQO1蛋白表达的影响
4 讨论与结论
淀粉样蛋白前体蛋白(APP)由γ分泌酶和β分泌酶裂解后,成Aβ,大量的Aβ在脑内异常沉积形成老年斑是阿尔茨海默病最具特征的病理改变,与大脑认知障碍密切相关并且有实验表明,在体外培养海马神经元时,低浓度的Aβ1-42寡聚体可以直接导致神经元的损伤,且随着浓度的升高表现出线性关系[15]。由此本研究中将Aβ1-42注射入大鼠双侧海马以模拟Aβ在脑组织内的沉积,建立大鼠AD模型。并在注射前先将Aβ1-42于37 ℃水浴一周使其老化形成聚集态,从而使其毒性显著增强。Morris水迷宫实验可敏感反映动物空间认知能力变化,是AD行为学评价的常用方法。此研究通过Morris水迷宫实验研究发现,模型组大鼠较空白组逃逸潜伏期显著增加,原平台象限滞留时间百分比和有效区域进入次数显著减少,表明AD大鼠模型建立成功;经阿里红多糖高,中剂量组治疗后AD大鼠的逃逸潜伏期明显缩短,原平台象限滞留时间百分比和有效区域进入次数显著升高,证实阿里红多糖能够提高AD大鼠的学习和记忆能力。

图3 大鼠海马组织(a)和大脑皮质层(b)中Nrf2、Keap1、HO-1及NQO1蛋白表达电泳Fig.3 Nrf2,Keap1,HO-1 and NQO1 protein expression electrophoresis in rat hippocampus(a) and cerebral cortex(b)注:A.空白组;B.模型组;C.盐酸多奈哌齐组;D.FOPS低剂量组;E.FOPS中剂量组;F.FOPS高剂量组。Note:A.Control group;B.Model group;C.Donepezil group;D.FOPS-L group;E.FOPS-M group F.FOPS-H group.
AD发病机制的“Aβ学说”认为Aβ在特定脑区的聚集、介导氧化应激(oxidative stress,OS)损伤,而氧化还原稳态不稳定是阿尔茨海默病(AD)和帕金森氏病(PD)的共同标志在健康状态的机体中,ROS形成的水平与抗氧化能力平衡;然而,当ROS的产生超过了机体的抗氧化能力,ROS累积,从而引发OS和细胞损伤,中枢神经系统(central nervous system,CNS)由于其高耗氧量以及含有丰富的不饱和脂肪酸,极易受到OS的攻击,因而特别容易受到脂质过氧化作用的影响[16]。此外有研究发现,AD人群大脑中氧化蛋白的水平明显高于与年龄相配的对照组[17]。
Nrf2被认为是调节细胞内众多抗氧化物表达的关键性因子,具有维持细胞氧化一抗氧化平衡、抑制、凋亡、抗炎的多重生物活性;其与抗氧化反应序列元件(ARE)共同构成Nrf2/ARE信号通路,Nrf2/ARE信号通路的激活可诱导产生一系列内源性酶,如血红素加氧酶(HO-1)、醌氧化还原酶(NQO1)等,这些自由基清除酶能够参与机体的抗氧化防御机制,从而减少氧化应激和介导抗氧化的主要途径[18]。Nrf2的转录活性受细胞骨架相关性抑制蛋白Keap1的调节,该调控蛋白还引导Nrf2通过蛋白酶体进行泛素化和降解,从而限制其基本细胞水平。在基础条件下,该蛋白作为Nrf2抑制因子,与Nrf2结合并稳定存在于在细胞浆中,亲电子物质或者氧化刺激引起Keap1的修饰,使Keap1-Nrf2复合体解离,从而游离出Nrf2,进而激活抗氧化反应序列元件下游的Ⅱ相解毒酶基因及产生抗氧化酶的基因转录,并增加细胞对氧化应激、外源性化学物质及亲电子化合物刺激的抗性。许多研究表明,应激条件下,Nrf2的激活可以促进细胞存活[19]。
大脑皮质层和海马组织是两种具有不同结构和功能的脑组织。大脑皮质位于大脑的表层,是机体的最高级神经中枢;大脑皮层除了对外部世界感知,还具有语言、学习、记忆和思维等方面的高级功能;海马体位于大脑丘脑和内侧颞叶之间,属于边缘系统的一部分,主要负责长时记忆的存储转换和定向等功能。这两种脑组织是AD病变最为显著的区域,表现为老年斑的出现、NFTs的形成和神经元的大量丢失等[20]。因此本研究中我们选取了大脑皮质层和海马组织两种具有不同结构和功能的脑组织进行了检测。
研究结果表明,模型组大鼠较空白组大鼠海马区和脑皮质层Nrf2、HO-1及NQO1 mRNA水平及蛋白表达水平显著降低,而Keap1 mRNA水平及蛋白表达水平显著升高,说明AD模型已经存在严重脑组织氧化损伤,同时经阿里红多糖高,中剂量组治疗后AD大鼠海马组织和大脑皮层中Nrf2、HO-1及NQO1 mRNA水平及蛋白表达显著升高,而Keap1 mRNA水平及蛋白表达显著减弱,表明阿里红多糖高、中剂量组通过负向调节Keap1的表达,促进Nrf2的激活,诱导NQO1、HO-1的表达,通过增强抗氧化酶系活性,发挥提高机体抗氧化损伤作用,从而改善AD大鼠学习记忆能力。
综上所述,阿里红多糖治疗AD的作用机制可能与激活Nrf2/ARE信号转导途径有关。但记忆力形成与修复的过程和机制极其复杂,阿里红多糖改善AD患者记忆力的作用机制还有待进一步深入探讨,本研究为其奠定了初步的基础和参考。
