桂皮醛对DSS诱导的溃疡性结肠炎小鼠的保护作用研究
2021-02-01吴柯楠梁艳妮张东博任浪浪李璐含于金高唐志书
吴柯楠,梁艳妮,张东博,任浪浪,李璐含,于金高,张 珍,唐志书,王 征
陕西中医药大学 陕西中药资源产业化省部共建协同创新中心 省部共建秦药特色资源研究开发国家重点实验室(培育) 陕西省创新药物研究中心,咸阳 712083
溃疡性结肠炎(ulcerative colitis,UC)是一种发展缓慢、非特异性炎症性肠病,主要临床症状为腹痛、腹泻、黏液血便等,或伴有体重减轻、里急后重感、呕吐等症状[1]。主要是侵及结肠黏膜,破坏黏膜形成溃疡,常始自左半结肠,可由结肠近端发展至全结肠。UC的病因与发病机制目前尚未明确,随着近年来各学科的发展以及各学科间相互渗透,人们对UC的认识也在不断深入。研究表明UC的发生与患者肠道炎性因子的失衡和免疫反应的异常密切相关,炎症信号的激活导致促炎细胞因子和抗炎细胞因子分泌失衡,活性氧过度积累,进一步加速炎症的发展。而核转录因子(NF-κB)和信号传导及转录激活因子3(STAT3)在介导这一异常的免疫反应中起着重要作用,肿瘤坏死因子-α(TNF-α)[2]、白细胞介素-6(IL-6)[3]、白细胞介素-8(IL-8)等多种促炎因子的过量分泌以及抗炎因子白细胞介素-4(IL-4)[4]、白细胞介素-10(IL-10)[5,6]等的释放减少导致UC患者肠道发生炎症反应,因此临床治疗UC可以从抑制促炎因子的释放和促进抗炎因子的分泌来实现。
桂皮醛(cinnamaldehyde,CA)又名肉桂醛、苯丙烯醛、桂醛,是从肉桂树中提取的烯醛类有机化合物,是其挥发油中主要成分[7]。国内外对CA的大量药理研究表明,其具有抗炎[8,9]、抗溃疡、解热镇痛[10]、抗肿瘤[11]、抗菌、降糖、抗肥胖、降血压、抗抑郁[12]等多种药理活性。课题组前期对马齿苋-肉桂治疗UC的作用进行研究发现,两者联用可以显著改善UC小鼠的健康活动状况,且与肠道微生态平衡的改善密切相关[13]。据报道,CA可以抑制巨噬细胞中促炎症因子的表达,包括TNF-α、IL-1β和一氧化氮(NO)[14]。也有文献研究CA可以通过抑制NLRP3炎症小体的激活以及结肠和巨噬细胞中的miR-21和miR-155水平改善DSS诱导的结肠炎[15],故本课题组对CA治疗UC的作用进行研究。
1 仪器与试剂
1.1 仪器
TS100-F荧光倒置显微镜(日本Nikon公司);低温冷冻离心机(美国Thermo公司);低温保存箱(-80 ℃,美国Thermo公司);TGL-20B低速离心机(上海安亭科学仪器厂);CPA225D电子天平(北京赛多利斯科学仪器有限公司);BIO-RAD电泳槽(042BR16330,美国);GEL DocXR+伯乐凝胶成像系统(721BR11053,美国);Thermo热点Multiskan FC 酶标仪(美国Thermo公司);微量冷冻离心机Micro 17R(赛默飞世尔科技有限公司)。
1.2 试剂
桂皮醛(四川省维克奇生物科技有限公司,批号:wkq19031207,纯度:≥98%);葡聚糖硫酸钠(DSS,MP Biomedicals生物医学公司,批号:160110);柳氮磺胺吡啶片(上海信谊嘉华药业,批号:09170611);无菌PBS(博士德生物有限公司,批号:0030319);小鼠 IL-4(批号:M191028-003b)、IL-6(批号:M190322-004a)、IL-8(批号:M190322-104a)、IL-10(批号:M190322-003a)、TNF-α(批号:R200107-102a)ELISA试剂盒购自欣博盛生物科技有限公司;NF-κB/P65(#8242S)、IκBα(#4812S)、STAT3(#12460S)和p-STAT3(#9145S)兔抗鼠单克隆抗体购自Cell Signaling Technology;辣根过氧化物酶(HRP)标记的山羊抗兔二抗(博士德生物有限公司);marker蛋白(Thermo Scientifi);RIPA裂解液(博士德生物有限公司);BCA蛋白定量试剂盒(博士德生物有限公司);SDS-PAGE蛋白上样缓冲液(博士德生物有限公司);SDS-PAGE凝胶制备试剂盒(北京索莱宝生物有限公司);化学发光HRP底物ECL发光液(默克密理博)。
1.3 动物
SPF级雄性昆明种小鼠60只,4~6周龄,体重20±2 g,购于西安交通大学医学部实验动物中心,实验动物质量合格证许可证号:SCXK(陕)2017-003。
2 方法
2.1 动物实验
2.1.1 实验分组及给药方法
昆明种雄性小鼠60只,随机分6组,(每组小鼠体重进行方差分析,P>0.05)适应性饲养一周。分为空白组、UC模型组、柳氮磺胺吡啶组[16]、CA低、中、高剂量组(150、250、500 mg/kg)。空白组小鼠饮用纯净水,其他小鼠自饮3%DSS 9天诱导UC模型[17],自第10天起空白组及模型组小鼠灌胃蒸馏水,其余组灌胃相应剂量的药物,灌胃体积均为10 mL/kg;连续灌胃7天,最后一天禁食不禁水16 h后,摘眼球取血,小鼠处死后,剪取结肠组织,4%多聚甲醛固定。造模第一天起记录小鼠的体重,大便质地,潜血或便血特征[13,18,19],根据表1进行疾病活动指数(disease activity index,DAI)评分。
DAI=(体重下降评分+大便性状评分+
大便隐血情况评分)/3
2.1.2 石蜡包埋和H&E染色
将保存在4%多聚甲醛的结肠组织取出后在流水中冲洗1 h,后置入浓度梯度乙醇中脱水1 h,再用二甲苯透明,然后将透明后的标本放置在65 ℃熔解状态的石蜡中1 h,浸透取出放置于包埋模具内包埋成蜡块,并放于病理冷冻台待其冷却固定于切片机切成4 μm切片,4 ℃冷藏备用。
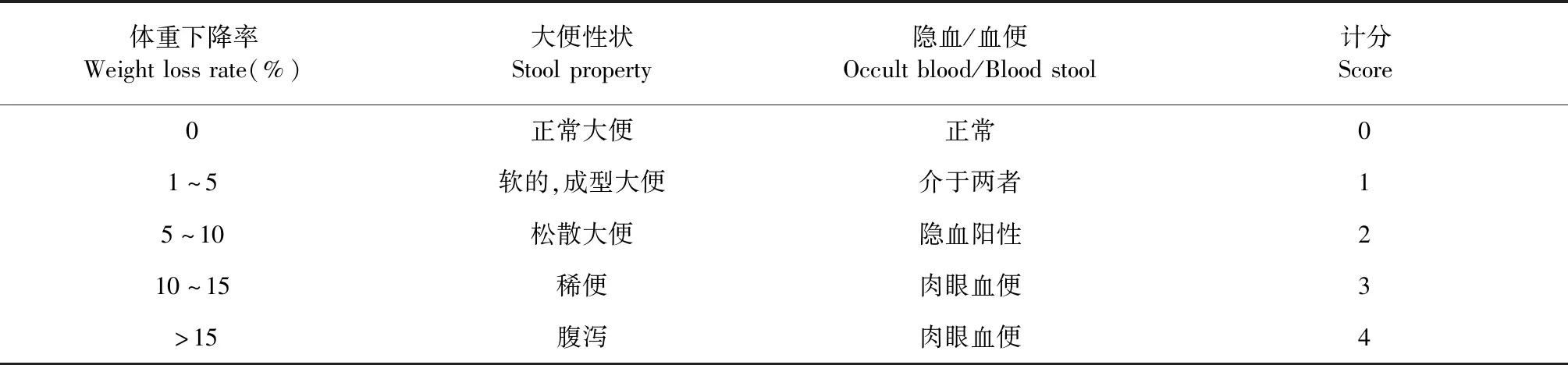
表1 DAI评分表
病理HE染色,将切片用二甲苯脱蜡,再移入苏木精染色5 min,然后用流水洗去苏木素染液终止染色,待其干后放入1%盐酸乙醇溶液分化,然后放入伊红液染色2 min并快速水洗以终止染色,最后将切片放入梯度酒精中脱水5 min后,放入二甲苯透明处理,滴加中性树胶并盖玻片封片固定。在微镜下观察比较各组大鼠HE染色结肠组织损伤的病理变化,并给予评分[20,21]比较(HAI=上皮组织破坏分数+炎性浸润分数)(见表2)。

表2 大鼠结肠组织HAI病理变化评分标准
2.1.3 IL-6、IL-8、IL-4、IL-10、TNF-α含量测定
对各组小鼠进行采取血液样本1.5 mL,4 ℃下以3 000 rpm离心10 min,收集上层血清。按照小鼠ELISA试剂盒说明书测定小鼠血清中IL-4、IL-6、IL-8、IL-10、TNF-α的含量。
2.1.4 Western blot法检测结肠组织中NF-κB/P65、STAT3蛋白表达
在病变明显处取结肠组织放入1.5 mL的EP管中,加裂解液匀浆,离心后吸取上清,4 ℃保存备用;配制BSA浓度梯度标准液及BCA工作液,进行蛋白质定量分析;将提取的蛋白电泳(90 V,30 min后转120 V)、转膜(100 V,90 min)后,封闭2 h,孵育一抗(4 ℃,过夜),辣根过氧化物酶标记的二抗与一抗结合(37 ℃,1 h);将PVDF膜平铺于保鲜膜上,加入ECL发光液避光反应2 min,采用BIO-RAD凝胶成像系统对PVDF膜进行曝光。
2.2 统计学方法
3 结果
3.1 DAI评分结果
根据表1小鼠DAI评分表,得出图1评分结果,小鼠以3% DSS饮水9天后各实验组DAI评分均升高,表明小鼠造模成功,第10天灌胃治疗开始,给药组小鼠DAI评分均逐渐下降,且随给药浓度的增大,小鼠DAI评分下降趋势更明显,表明CA对UC有疗效。
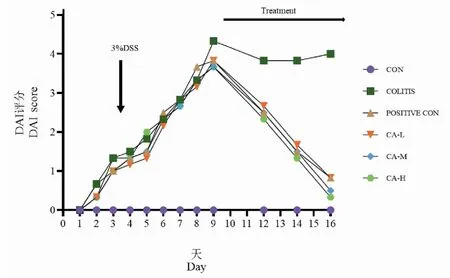
图1 小鼠的DAI评分Fig.1 DAI of mice注:CON:对照组;COLITIS:模型组;POSITIVE CON:柳氮磺胺吡啶组;CA-L:CA低剂量组(150 mg/kg);CA-M:CA中剂量组(250 mg/kg);CA-H:CA高剂量组(500 mg/kg);下同。Note:CON:Control group;COLITIS:Model group;POSITIVE CON:Sulfasalazine group;CA-L:CA low-dose group (150 mg/kg);CA-M:CA middle-dose group (250 mg/kg);CA-H:CA high-dose group (500 mg/kg);the same below.
3.2 炎症因子的变化
由图2可知,模型组血清中抑炎因子IL-4、IL-10的含量较空白组明显降低,差异有统计学意义(P<0.01),促炎因子IL-6、IL-8及TNF-α含量较空白组明显升高,差异有统计学意义(P<0.01)。给药后,CA低、中、高剂量组IL-4、IL-10的含量较模型组均明显升高,差异有统计学意义(P<0.01),且高于阳性对照组;CA低、高剂量组IL-6、IL-8及TNF-α含量较模型组明显降低,差异有统计学意义(P<0.01),且高于阳性对照组;CA中剂量组IL-6、IL-8及TNF-α含量较模型组降低,差异有统计学意义(P<0.05),较柳氮磺胺吡啶组差异无统计学意义(P>0.05)。结果表明CA能显著改变UC小鼠炎症因子的含量。
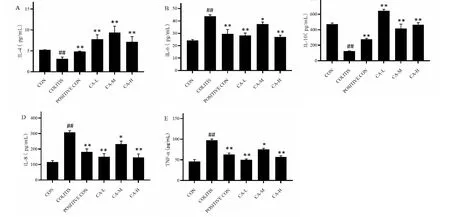
图2 炎症因子的含量变化Fig.2 Changes in the levels of inflammatory cytokines注:与UC模型组比较,**P <0.01,*P <0.05;与空白组比较,##P<0.01,#P<0.05。Note:Compared with the model group, **P <0.01,*P <0.05.Compared with the control group,##P<0.01,#P<0.05.
3.3 结肠组织观察
最后一次给药后,所有小鼠禁食24 h乙醚麻醉,处死小鼠,从肛门以上5 cm处取出小鼠结肠段约1 cm,发现空白对照组小鼠结肠颜色为淡红色,肠管有部分成形粪便。DSS模型组小鼠结肠肠壁充血肿胀,严重者结肠段为血性肠内容物。给药组小鼠肠管可见基本成型粪便,低剂量组肠壁有轻微充血。空白组镜下可见结肠组织完整,包括肠黏膜层、肌层,有明显的隐窝、杯状细胞,腺体排列整齐,无炎症细胞浸润(图3A);模型组镜下可见肠黏膜组织细胞(黑色箭头)、腺体遭受不同程度破坏(黄色箭头),隐窝和杯状细胞明显减少(白色箭头),有大量炎症因子(红圈),主要集中在黏膜层及黏膜下层(图3B),HAI评分明显高于空白组,表明UC模型诱导成功(图3G);阳性对照组柳氮磺胺吡啶治疗后,结肠结构相对完整,有大量杯状细胞和隐窝出现,但黏膜层仍有少量炎症细胞(图3C),HAI评分显著降低,表明磺胺吡啶300 mg/kg可改善DSS诱导的结肠炎症状,但炎症细胞浸润对结肠组织的损伤并没有完全消除;用浓度为150、250、500 mg/kg的CA溶液治疗,可见结肠组织结构完整,隐窝排布规范,杯状细胞清晰可见,但仍有少量炎症细胞浸润,粘膜结构有不同程度修复(图3D、3E、3F)。HAI 评分较模型组显著降低,高浓度组比阳性药的疗效更好(图3G),表明CA可修复UC结肠组织,但是不能完全消除炎症因子对结肠组织的损伤(P<0.01)。
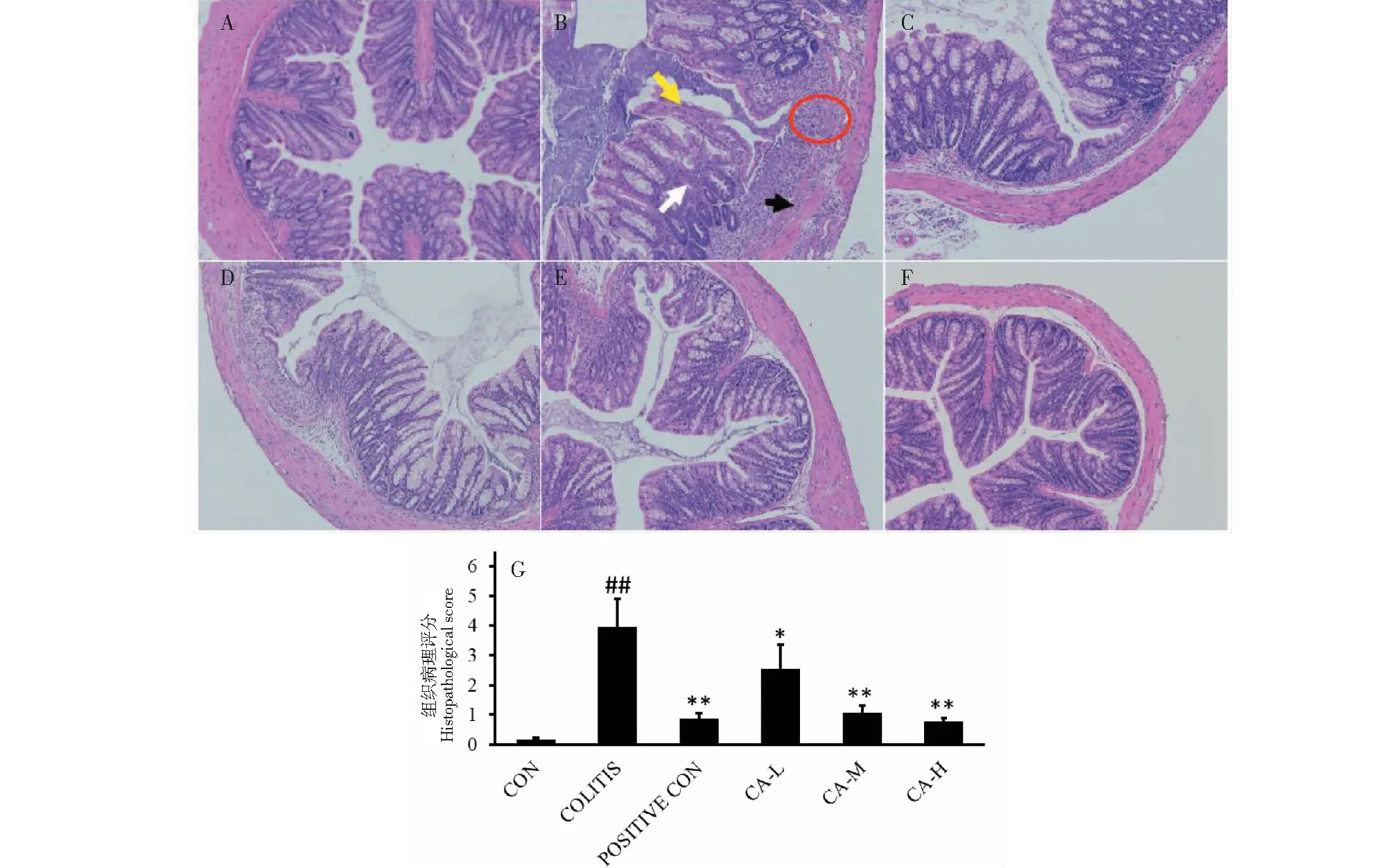
图3 小鼠结肠组织HE染色图(×400,横切)及结肠组织病理切片HAI评分Fig.3 HE staining of mouse colon tissue(×400,crosscutting) and HAI in pathological sections of the colon注:A:对照组;B:模型组;C:柳氮磺胺吡啶组;D:CA低剂量组;E:CA中剂量组;F:CA高剂量组;G:HAI评分;黑色箭头:肠黏膜组织;黄色箭头:腺体破坏;白色箭头:隐窝及杯状细胞;红圈:炎症因子;与UC模型组比较,**P <0.01,*P <0.05;与空白组比较,##P<0.01,#P<0.05。Note:A:Control group;B:Model group;C:Sulfasalazine group;D:CA-L;E:CA-M;F:CA-H;G:HAI score;Black arrow:Intestinal mucosal tissue;Yellow arrow:Gland destruction;White arrow:Crypt and goblet cells;Red circle:Inflammatory factor;Compared with the model group, **P <0.01,*P <0.05;Compared with the control group,##P<0.01,#P<0.05.
3.4 结肠组织中NF-κB/P65、STAT3蛋白表达情况
从“3.1”、“3.2”、“3.3”的实验结果来看,药物改善不呈剂量依赖性,所以我们从药物的三个剂量对溃疡性结肠炎的效果综合分析,选择中剂量作为检测结肠组织中NF-κB/P65、STAT3蛋白表达的实验剂量。
在炎症反应中,NF-κB的活化是一个中心环节,静息状态下,NF-κB(p50/p65)与其抑制性蛋白IκB(IκBα)结合形成三聚体稳定存在于胞质中,抑制NF-κB向细胞核内转移。一旦胞外信号传递进胞内,IκB在其激酶IKK和ELKs的作用下被磷酸化或泛素化降解,NF-κB以活化的形式进入细胞核内与靶基因结合。
由图4可知,与空白组相比,模型组NF-κB和IκBα在细胞质中的蛋白表达明显降低,表明NF-κB被激活进入细胞核;与模型组相比,阳性对照组和CA组NF-κB和IκBα在细胞质中的蛋白水平显著升高,另外,CA组的蛋白表达水平高于阳性对照组。总之,这些结果表明CA是通过抑制IκBα的降解从而抑制NF-κB进入细胞核来改善溃疡性结肠炎。
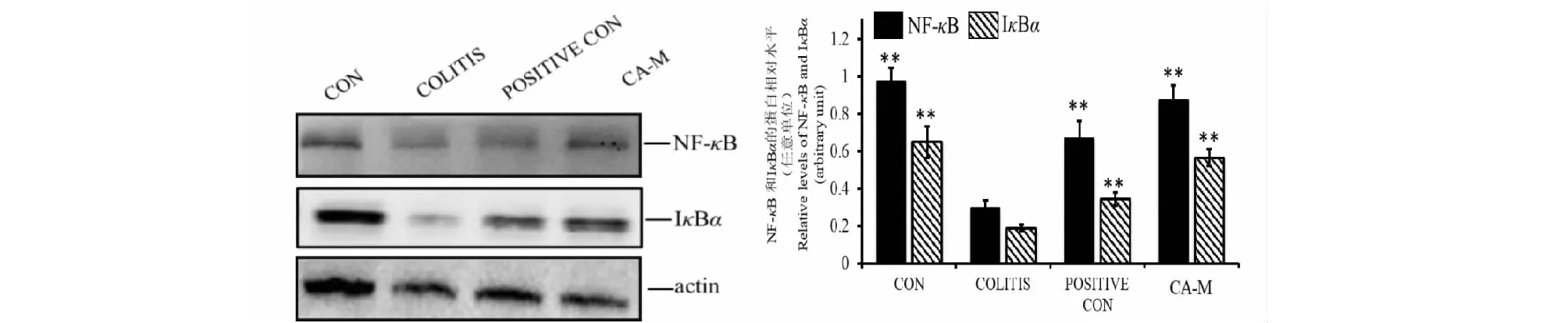
图4 小鼠结肠组织中NF-κB/p65和IκBα(细胞质)的蛋白表达Fig.4 Protein expression of NF-κB/p65 and IκBα in mice colon (in cytoplasm)注:与UC模型组比较,**P<0.01,*P<0.05。Note:Compared with the model group,**P<0.01,*P<0.05.
IL-6通过“反式传导信号” 诱导STAT3磷酸化,STAT3可诱导抗凋亡因子Bcl-2和Bcl-xL,抗凋亡因子阻止炎性细胞凋亡,促进T淋巴细胞增殖、刺激细胞毒性T细胞反应,导致慢性炎症的发生。IL-6/STAT3信号通路也可激活造血干细胞从G0期进入G1期,促进巨噬细胞和中性粒细胞分泌、增殖,诱发UC发生并加重发展[22]。
由图5可得,与空白组比较,模型组p-STAT3/STAT3的蛋白表达比值明显升高(P<0.01)。给药后,与模型组比较,阳性对照组和CA组的p-STAT3/STAT3表达比值明显降低(P<0.01)。这些结果表明,CA可抑制STAT3的磷酸化来阻止STAT3在细胞核中的调控作用[22]。
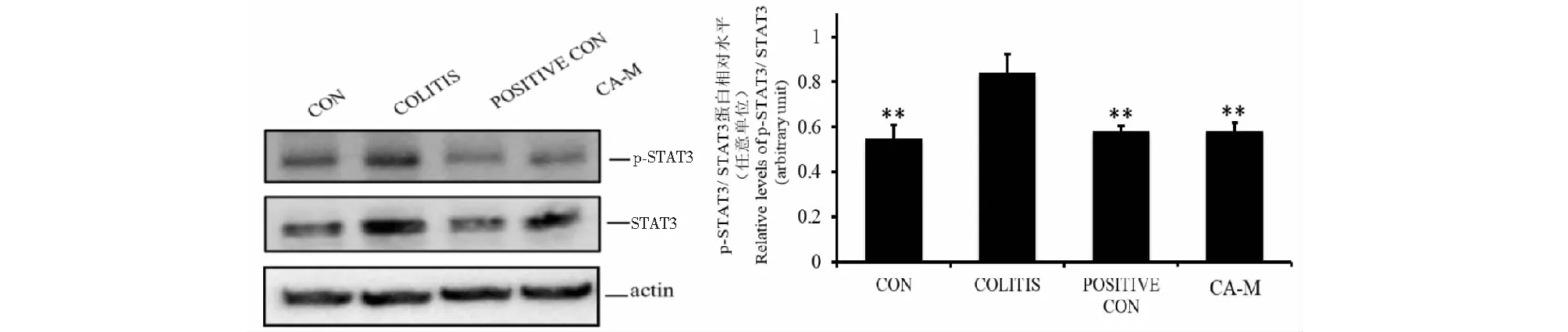
图5 小鼠结肠组织中p-STAT3/ STAT3的蛋白表达Fig.5 Protein expression of p-STAT3/ STAT3 in mice colon注:与UC模型组比较,**P <0.01,*P<0.05。Note:Compared with the model group, **P<0.01,*P<0.05.
4 讨论
溃疡性结肠炎(UC)常见于经济生活水平较好的欧美发达国家,发病率远高于亚洲国家。但近年随着亚洲国家经济水平的发展和生活水平的提高,UC的发病率在我国逐年上升。UC的发病机制至今尚未明确,已知肠道内菌群失衡、内环境紊乱将对肠黏膜免疫系统进行刺激,改变黏膜通透性,进而诱发免疫反应,促使UC发生。
桂皮醛(CA)是一种有效的抗炎抗菌的药物,能对肠道菌群进行调整并促使其稳定,有助于改善肠道屏障功能。本课题组在对马齿苋-肉桂的前期研究发现,两者联用对小鼠UC有显著效果。为了进一步明确肉桂在溃疡性结肠炎中发挥作用的主要成分,本研究通过建立DSS诱导UC小鼠模型,给予CA治疗,评估CA的治疗效果。DAI评分结果显示CA可改善小鼠体重下降、腹泻、血便等症状;病理评分结果显示CA能够保护肠粘膜,减少隐窝细胞的损伤以及炎症细胞浸润,腺体紊乱和消失减轻,改善炎症。溃疡性结肠炎的发生很大程度与炎性因子的失衡和免疫反应的异常密切相关[23],UC患者结肠中促炎细胞因子水平升高,抗炎细胞因子水平降低,从而产生免疫功能紊乱,导致UC的发展。本研究中,CA显著降低了结肠组织中促炎因子IL-6、IL-8、TNF-α含量(P<0.01),这可能与抑制STAT3信号通路的表达有关,同时CA还使小鼠结肠组织中抑炎因子IL-4、IL-10含量显著升高(P<0.01)。炎症因子的表达变化影响因素较多,由于动物的个体差异等因素影响,我们的实验结果没有呈现出剂量依赖性,而病理评分却呈剂量依赖性,这是由于炎性因子是微量指标,病理评分显示的是肠道整体情况,所以应该主要依据动物疾病活动指数及病理评分来判断药物的作用效果。
促炎细胞因子都是由细胞内信号分子的复杂网络转录调控,核转录因子(NF-κB)和信号传导及转录激活因子3(STAT3)在介导这一异常的免疫反应中起着重要作用。NF-κB有明显的促炎特性,通过Western blot技术显示NF-κB蛋白的表达条带,可以看到CA组NF-κB蛋白在细胞质中的表达较模型组显著升高,且有显著性差异(P< 0.01);从p-STAT3及STAT3蛋白的条带表达和灰度值得出,CA组较模型组p-STAT3/STAT3蛋白表达明显降低,且有显著性差异(P< 0.01)。上述实验结果说明CA对DSS诱导的UC小鼠的保护作用与炎症关键蛋白NF-κB和STAT3的激活密切相关。
综上所述,CA可以显著改善肠炎引发的体重减轻、肠炎疾病评分降低,和结肠组织炎性改变,减少促炎因子TNF-α、IL-6和IL-8的分泌,促进抗炎因子IL-4、IL-10的表达,其减轻炎症的作用可能与抑制NF-κB及STAT3的免疫炎症信号通路有关。本实验仅研究了其在动物水平的疗效,今后将研究其在细胞、分子和基因水平的治疗机制,为我国治疗UC提供更多选择。
