血府逐瘀汤提取过程中成分的量变规律研究*
2021-01-26薛梦洁于卉娟王璐瑶柴欣杨静王跃飞
薛梦洁,于卉娟,王璐瑶,柴欣,杨静,王跃飞
(天津中医药大学中医药研究院,天津市中药化学与分析重点实验室,天津 301617)
血府逐瘀汤源自清代医家王清任的《医林改错》,是“逐瘀汤”系列方中临床应用较为广泛的方剂,由桃仁、红花、当归、生地、牛膝、甘草等11味药组成[1]。该方具有活血祛瘀、行气止痛的功效,主要治疗“胸中血府血瘀”所致诸证,多应用于心血管疾病、神经系统疾病、妇科疾病等。其组成药味中含有黄酮、有机酸、生物碱等化合物,特别是含有大量黄酮类化合物[2]。现代药理研究证实,血府逐瘀汤具有抗动脉粥样硬化,抑制心肌细胞坏死及凋亡,诱导内皮细胞增殖和血管新生,抗肺纤维化等药理作用[3-4]。
血府逐瘀汤在防治心血管疾病方面具有显著优势,被开发成多种剂型,如片剂、胶囊剂、口服液等。课题组前期采用超高效液相色谱法开展了血府逐瘀汤主要剂型的12个成分差异分析,研究表明不同剂型中指标成分的差异较大,可能是由于提取工艺和制剂工艺不同引起的[5]。文献也报道了传统煎煮法、超临界CO2萃取法对血府逐瘀汤主要化学成分的提取效果,超临界CO2萃取物的有效成分提取率明显高于煎煮法[6]。以芍药苷为指标,系统开展不同提取时间、煎煮方法、干燥条件下血府逐瘀汤的提取效率研究,延长提取时间、减压干燥有助于提高芍药苷转移率[7-8]。目前,关于不同提取条件下血府逐瘀汤水提液紫外光谱变化情况及不同极性成分提取过程中的量变情况鲜有报道。
本研究采用水提法系统研究不同提取时间和提取次数对血府逐瘀汤成分的提取效率的影响,通过紫外分光光度法和超高效液相色谱法测定不同提取液的吸收光谱和主要成分(苦杏仁苷、芍药苷、阿魏酸、柚皮苷、新橙皮苷、异甘草素、甘草素、甘草酸、橙皮苷),揭示随提取时间和提取次数变化血府逐瘀汤提取液吸收光谱和主要成分含量的动态变化规律,为更加有效的利用血府逐瘀汤提供数据支撑。
1 仪器与试药
1.1 仪器 超高效液相色谱仪:Waters Acquity UPLC system(美国沃特世公司),ME204型电子天平(瑞士METTLER TOLEDO公司),Centrifuge 5430 R离心机(德国艾本德公司),VARIAN Cary 50紫外分光光度计(美国瓦里安技术有限公司)。
1.2 试药 甲醇(色谱纯,Sigma Aldrich),乙腈(色谱纯,Sigma Aldrich),甲酸(色谱纯,上海阿拉丁生化科技股份有限公司),超纯水(实验室自制,Milli-Q超纯水),甲醇(天津市康科德科技有限公司);柴胡、当归、生地、赤芍、红花、桔梗、炒桃仁、炒枳壳、甘草、川芎、牛膝均购于河北美威药业股份有限公司,经企业提供检验报告均符合2015版中国药典饮片质量要求;对照品:苦杏仁苷、芍药苷、阿魏酸、柚皮苷、新橙皮苷、异甘草素、甘草素、甘草酸、橙皮苷均购于上海源叶生物科技有限公司,纯度均大于98%。
2 水提液的制备
取当归 12.0 g,生地 12.0 g,柴胡 4.0 g,赤芍8.0 g,红花 12.0 g,桔梗 6.0 g,炒桃仁 15.0 g,炒枳壳8.0 g,甘草 8.0 g,川芎 6.0 g,牛膝 12.0 g,精密称定,置于2 L圆底烧瓶中,加入8倍量水;分别提取0.5、1、1.5、2、2.5 h,过滤,得不同提取时间血府逐瘀汤的水提液;分别提取 1、2、3 次,每次提取 2 h,过滤,得不同提取次数血府逐瘀汤的水提液。
不同提取时间及次数的样品各平行制备3份,分别量取水提液体积。
3 实验方法
3.1 紫外分光光度法
3.1.1 检测条件 检测波长:200~500 nm。
3.1.2 供试品溶液的制备方法 精密移取水提液1 mL,与1 mL甲醇混匀,12 000 r/min离心10 min,离心半径8.9 cm,吸取上清液1 mL,置于10 mL容量瓶中,用50%甲醇溶液定容至刻度,摇匀;精密移取1 mL,置于10 mL容量瓶中,用50%甲醇溶液定容至刻度,摇匀,即得。
3.2 超高效液相色谱法
3.2.1 色谱条件 色谱柱为ACQUITY UPLC BEH Shield RP18(2.1 mm×100 mm,1.7 μm,美国Waters公司);进样量:2 μL;流速:0.3 mL/min;柱温:50 ℃;流动相:0.1%甲酸水(A)-乙腈(B),梯度洗脱程序如下:0~3 min,90%~17%B;3~13 min,17%~35%B;13~17 min,35%~43%B;17~19 min,43%~44%B;19~20 min,44%~50%B;20~23 min,50%~90%B;23~26 min,90%B;26~28 min,90%~10%B;28~32 min,10%B。
采用二极管阵列检测器进行全波长扫描,同时采用波长切换方法以最大吸收波长分别检测待测化合物,波长切换条件如下:0~2.34 min,254 nm;2.35~3.89 min,211 nm;3.90~5.24 min,230 nm;5.25~6.47 min,323 nm;6.48 ~7.39 min,283 nm;7.40 ~16.74 min,283 nm;16.75~17.99 min,250 nm;18.00~20.00 min,254 nm[5]。
3.2.2对照品溶液的配制 称取苦杏仁苷、芍药苷、阿魏酸、柚皮苷、新橙皮苷、异甘草素、甘草素、甘草酸、橙皮苷对照品,加入甲醇与二甲基亚砜(DMSO)(1∶1),制成浓度分别为 5.01、5.02、1.01、0.995、0.98、1.05、1.03、1.07、0.96 mg/mL 的对照品储备液;取适量对照品储备液混合,制得混合对照品溶液,浓度分别为苦杏仁苷 0.351 mg/mL、芍药苷 0.100 mg/mL、阿魏酸 0.010 mg/mL、柚皮苷 0.289 mg/mL、新橙皮苷 0.289 mg/mL、异甘草素 0.012 mg/mL、甘草素0.014mg/mL、甘草酸 0.171mg/mL、橙皮苷 0.038mg/mL。
3.2.3 供试品溶液的制备 精密移取水提液1 mL,置于2 mL容量瓶中,加入甲醇定容至刻度,摇匀,12 000 r/min 离心 10 min,离心半径 8.9 cm,取上清液,0.45 μm 滤膜过滤,即得。
4 结果与分析
4.1 紫外分光光度法研究不同提取时间和次数下血府逐瘀汤中化学成分量变规律 参照“2水提液的制备”“3.1紫外分光光度法”方法制备水提液样品并检测水提液的吸收曲线,不同提取时间和提取次数的血府逐瘀汤吸收曲线如图1A、1C所示。为了消除血府逐瘀汤投料饮片质量、水提液体积差异对测定结果的影响,将最大吸收波长(278±1)nm处的测定结果A值按公式(1)进行处理。

上式中,A′代表水提液供试品溶液最大吸收波长处校正吸光度值,A代表水提液供试品溶液最大吸收波长处吸光度值,M代表血府逐瘀汤投料饮片的质量,V代表水提液的体积。
以血府逐瘀汤提取时间2.5 h水提液供试品溶液的最大吸收波长(278±1)nm处校正吸光度值为参照,以 A′t/A′2.5(t为提取时间)为纵坐标,提取时间为横坐标,绘制不同提取时间血府逐瘀汤水提液供试品溶液最大吸收波长(278±1)nm处校正吸光度值变化趋势图,如图1B所示。以血府逐瘀汤提取3次的水提液供试品溶液的最大吸收波长(278±1)nm 处校正吸光度值为参照,以 A′n/A′3(n 为提取次数)为纵坐标,提取次数为横坐标,绘制不同提取次数血府逐瘀汤水提液供试品溶液最大吸收波长(278±1)nm处校正吸光度值变化趋势图,如图1D所示。
如图 1B 所示,提取时间为 0.5~2.5 h 时,水提液供试品溶液最大吸收波长(278±1)nm处校正吸光度随提取时间延长不断增加并趋于稳定,提示随着提取时间的延长水提液中化合物浓度趋于饱和。如图1D所示,提取次数为1~3次时,水提液供试品溶液最大吸收波长(278±1)nm处校正吸光度随次数增加而增大,但增长的趋势逐步减缓,提示随着提取次数的增多药渣留存的化合物逐步减少。
如图1A和C所示,水提液在200~400 nm范围内有较强的紫外吸收,最大吸收波长(278±1)nm;黄酮化合物基本母核为2-苯基色原酮,都具有C6-C3-C6的结构,因此,多数黄酮类化合物存在两个特征吸收,即300~400 nm区间由桂皮酰基系统电子跃迁引起的带Ⅰ和240~285 nm区间由苯甲酰基系统电子跃迁引起的带Ⅱ,分子中取代基的类型、位置和数量影响吸收带的峰位、强度和峰形[9-10]。本实验中,血府逐瘀汤水提液供试品溶液存在300~400 nm区间和240~285 nm区间的强紫外吸收,结合黄酮类化合物紫外吸收光谱特征及文献报道,说明血府逐瘀汤中含大量黄酮类化合物。
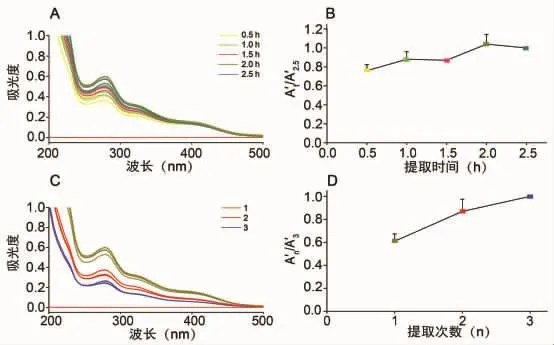
图1 不同提取时间和提取次数血府逐瘀汤供试品溶液吸收曲线及最大吸收波长(278±1)nm处校正吸光度变化趋势图(n=3)Fig.1 Absorption curve and trend of corrected absorbance at maximum absorption wavelength(278±1)nm for sample solution of Xuefu Zhuyu Decoction obtained by the different extraction time and extraction frequency(n=3)
4.2 超高效液相色谱法研究不同提取时间和次数下血府逐瘀汤中化学成分量变规律 参照“2水提液的制备”“3.2超高效液相色谱法”方法制备水提液样品并检测水提液中的苦杏仁苷、芍药苷、阿魏酸、柚皮苷、新橙皮苷、异甘草素、甘草素、甘草酸、橙皮苷,血府逐瘀汤水提液供试品溶液超高效液相色谱图如图2所示。
如图2所示,血府逐瘀汤水提液检测到苦杏仁苷、芍药苷、阿魏酸、柚皮苷、新橙皮苷、甘草酸及少量橙皮苷,未检测到甘草素、异甘草素。以“3.2.2”项下配制的混合标准品溶液为对照溶液,计算不同提取时间、提取次数血府逐瘀汤水提液中苦杏仁苷、芍药苷、阿魏酸、柚皮苷、新橙皮苷、甘草酸的含量(为了便于比较,水提液中化合物的含量均以饮片计),根据公式(2)、(3)计算。

图2 血府逐瘀汤供试品溶液(A)和混合对照品溶液(B)的超高效液相色谱图(n=3)Fig.2 UPLC chromatograms of the sample solution of Xuefu Zhuyu Decoction(A)and mixed standard solution(B)(n=3)

上式中,A标代表对照品的峰面积,A样代表供试品溶液中相应化合物的峰面积,C标代表对照品浓度,C样代表供试品溶液中相应化合物的浓度,V代表供试品溶液的体积,V′代表水提液的体积,M代表血府逐瘀汤投料饮片的质量,W代表从单位质量饮片中提取的相应化合物的量。
如图 3 A 所示,提取时间为 0.5~2.5 h,随提取时间延长,饮片中被提出的化合物量逐步增加,其中,苦杏仁苷、柚皮苷、新橙皮苷等糖苷类成分增加明显;阿魏酸基本保持稳定,至提取时间为2 h时各化合物提出的量趋于稳定。如图3B所示,提取次数为1~3次时,随着提取次数增加,饮片中被提出的化合物量越多,但增长的趋势逐步减缓,而阿魏酸基本保持稳定,该研究结果与紫外分光光度法研究结果一致。
5 结论
本研究采用紫外分光光度法和超高效液相色谱法研究不同提取时间和不同提取次数血府逐瘀汤水提液中成分的动态变化规律,发现随着提取时间的延长和提取次数的增加,饮片中被提出的化合物量逐渐增加,说明提取时间和次数的增加有助于饮片中成分的提取,在实际应用中应综合考虑药效、生产效率、成本等多方面因素确定提取次数和时间。
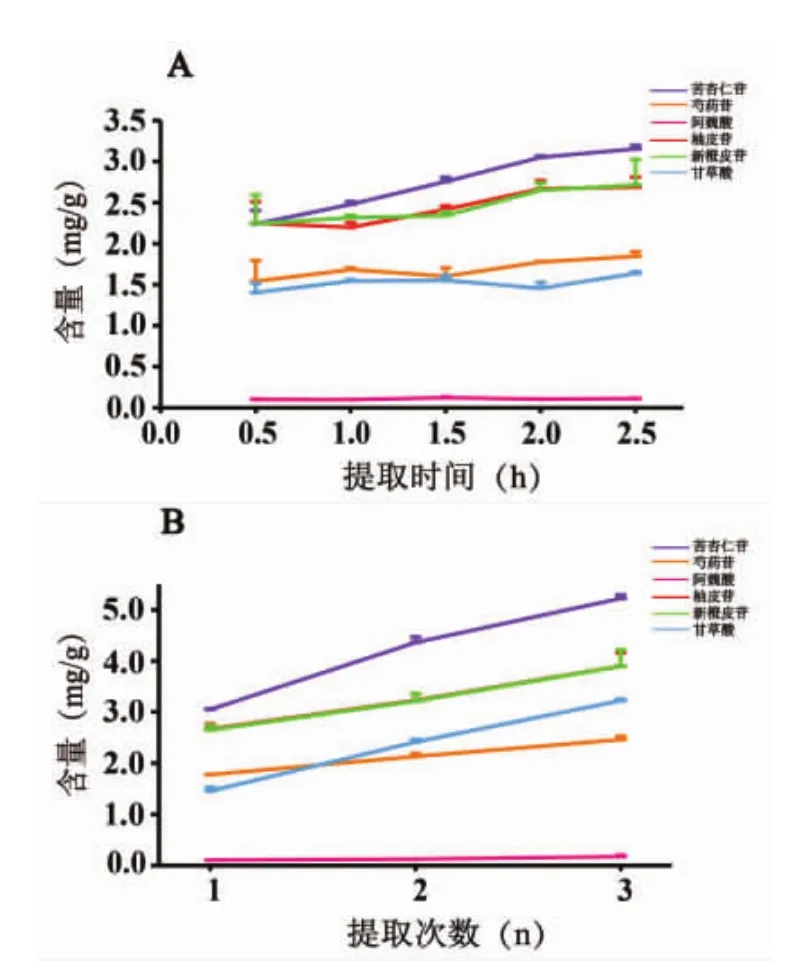
图3 不同提取时间(A)和提取次数(B)血府逐瘀汤提取的指标成分趋势图(n=3)Fig.3 Trend of the index components extracted in XuefuZhuyu Decoction obtained by the different extraction time(A)and extraction frequency(B)(n=3)
