沉默TIPE基因下调Wnt/β⁃catenin信号对非小细胞肺癌细胞增殖、凋亡的影响
2021-01-22才德吉措毛吉万玛南杰
才德吉 措毛吉 万玛南杰
青海红十字医院1呼吸内科,2产科,3小儿外科(西宁810000)
非小细胞肺癌(non small cell lung cancer,NSCLC)发生率约占肺癌80%以上,5年生存率不足20%[1-2],由于目前对肺癌的发病机制尚未明确,晚期肺癌尚无有效的化疗药物[3⁃4],世界范围内肺癌发病率和死亡率均居恶性肿瘤第一位。肿瘤坏死因子α诱导蛋白TIPE(tumor necrosis factor⁃α⁃induced protein 8,TNFAIP8)基因家族是新发现的一类癌基因家族[5],在胰腺癌、胃癌等肿瘤组织中呈高表达状态,近年来研究表明TIPE 可能与肺癌的发生发展有关[6-7]。虽然有研究报道TIPE与肺癌细胞迁移、化疗敏感性有关,但迄今为止,TIPE在肺癌发生发展中的作用机制尚未明晰。有研究发现TIPE 可能通过Wnt/β⁃catenin 信号通路调控细胞生物学特性,Wnt 信号通路是传递细胞生长刺激信号的一类重要通路,其异常活化与肿瘤的生长和转移密切相关[8]。本实验通过沉默非小细胞肺癌A549 细胞中TIPE 基因的表达,检测β⁃catenin在非小细胞肺癌细胞中的表达,为明确TIPE 基因、Wnt/β⁃catenin 信号通路在非小细胞肺癌中的机制研究初步奠定基础。
1 材料与方法
1.1 材料人非小细胞肺癌细胞系A549 购自中国科学院上海细胞库;DMEM 培养基、10%胎牛血清(美国Sigma 公司);TIPE、β⁃catenin 抗体(美国Abcam 公司)、流式凋亡检测试剂盒(南京凯基生物科技发展有限公司);RT⁃PCR 逆转录试剂盒(美国Thermo 公司);CCK8 试剂盒购自上海碧云天生物科技有限公司;GFP 荧标记的shRNA⁃TIPE 慢病毒载体、TIPE、β⁃catenin、β⁃actin 引物序列由上海生工生物工程有限公司构建制备(表1)。
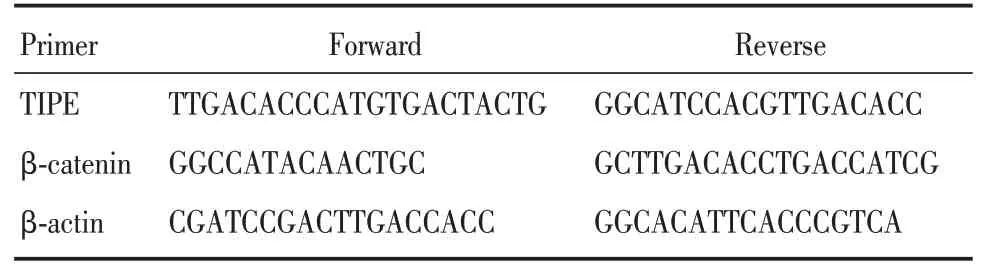
表1 TIPE、β⁃catenin、β⁃actin 引物序列Tab.1 Primer sequences of TIPE,β⁃catenin and β⁃actin
1.2 方法
1.2.1 非小细胞肺癌细胞系A549 培养及shRNA⁃TIPE 慢病毒转染将非小细胞肺癌细胞系A549放入10%胎牛血清的DMEM 培养基中培养,培养条件:37 ℃、5%CO2。取对数生长期A549 细胞,使用感染液将细胞制成5×105个/mL 悬液种植到6 孔细胞培养板中,按照慢病毒转染说明加入适量的病毒液,培养12 h,收集细胞3 000 r/min离心1 min,去掉上清液,更换为DMEM 完全培养基,继续培养72 h,荧光显微镜下观察GFP 的表达情况,感染效率高于90%后细胞用于后续实验,稳定感染shRNA⁃TIPE 慢病毒的细胞记为shRNA⁃TIPE,稳定感染shRNA 阴性对照的慢病毒记为shRNA⁃NC,无质粒载体的细胞为空白对照。
1.2.2 非小细胞肺癌细胞系A549内TIPE、β⁃catenin的表达取上述3 组细胞,加入TRIZOL 细胞裂解液,提取细胞总内RNA,根据逆转录试剂盒反转录成cDNA,以β⁃actin 为内参,TIPE、β⁃catenin 引物为模板检测mRNA 表达水平,反转录条件:95 ℃预变性2 min,95 ℃变性10 s,55 ℃退火30 s,共35 个循环,72 ℃延伸6 min。根据公式Folds=2⁃△△Ct计算TIPE、β⁃catenin 基因的相对表达量,其中△△Ct=(Ct检测基因⁃Ctβ⁃actin)实验组⁃(Ct检测基因⁃Ctβ⁃actin)对照组,实验重复3 次。取3 组转染细胞,1 000 r/min 离心5 min,加入RIPA 蛋白裂解液抽提总蛋白,BCA 法测定蛋白浓度,每孔取50 μg 总蛋白,加上样缓冲液100 ℃变性5 min,10%SDS⁃PAGE 电泳分离,电泳后转移至NC 膜,5%脱脂奶粉封闭过夜,洗膜,按顺序加入一抗、二抗,ECL 显色,Bandscan5.0 软件对图像进行分析,实验重复3 次。
1.2.3 沉默TIPE基因对非小细胞肺癌细胞系A549细胞增殖、凋亡的影响CCK8 实验取对数生长期慢病毒转染A549 细胞,0.25%胰酶消化制备单细胞悬液,1 × 104个/孔浓度接种于96 孔板,培养箱中孵育0、24、48、72 h 时间点加入10 μL CCK8 试剂,继续孵育4 h,酶标仪测定各组细胞在波长490 nm 处吸光度(OD)值,每实验组设3 个复孔,计算细胞抑制率,细胞抑制率(%)=(1⁃实验组OD值/空白对照组OD值)×100%,培养板四周设置空白对照孔,实验重复3 次;细胞克隆形成实验:取对数生长期转染A549 细胞,1 000 个/孔接种于6 孔板,待细胞形成肉眼可见细胞克隆后加入0.1%结晶紫染色,显微镜下观察并计数;细胞凋亡检测:取上述转染48 h 后A549 细胞,加入500 μL 的An⁃nexin V 缓冲液重悬细胞,Annexin V⁃FITC/PI 细胞凋亡试剂盒检测各组细胞的凋亡情况。
1.3 统计学方法应用SPSS 16.0 软件对数据进行分析,计量数据采用()表示,两组间比较采用两样本t检验,两组以上间数据比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 shRNA⁃TIPE 慢病毒转染后TIPE、β⁃catenin表达变化shRNA⁃TIPE 慢病毒转染非小细胞肺癌细胞系A549 后,TIPE mRNA 相对表达量为(0.33 ±0.07),低于阴性对照组(1.00±0.13)和空白对照组,差异有统计学意义(F=103.0,P<0.000 1);shRNA⁃TIPE 转染后,TIPE 蛋白相对表达量减少至(0.23 ±0.06),低于阴性对照组(0.75 ± 0.22)和空白对照组(0.76±0.28)(F=10.57,P=0.002 3)(图1)。shR⁃NA⁃TIPE 转染A549 细胞后,β⁃catenin mRNA、蛋白表达均低于阴性对照组和空白对照组(图2),表明shRNA⁃TIPE 慢病毒感染可成功沉默TIPE 基因的转录和表达,同时下调A549 细胞内β⁃catenin mRNA 和蛋白水平。
2.2 shRNA⁃TIPE 慢病毒转染后细胞增殖、凋亡变化细胞克隆形成实验显示TIPE 基因沉默后A549 细胞克隆形成能力显著下降,差异有统计学意义(F= 17.48,P= 0.000 3),表明TIPE 基因能促进非小细胞肺癌细胞系A549 增殖。采用生长曲线实验检测沉默TIPE 基因后细胞增殖情况,沉默TIPE 基因后A549 细胞增殖能力下降(图3)。
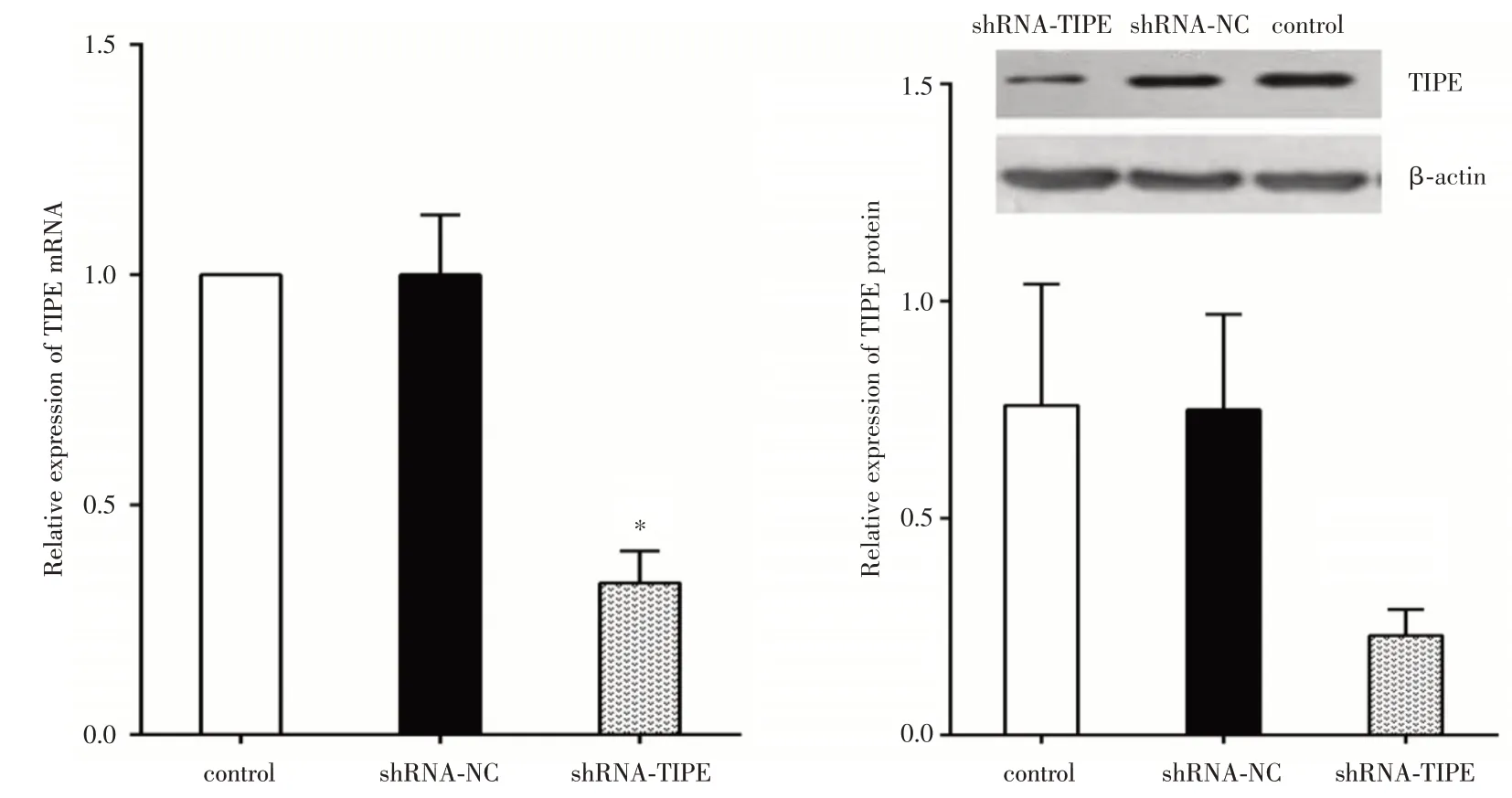
图1 shRNA⁃TIPE 慢病毒转染后A549 细胞内TIPE mRNA、蛋白表达变化Fig.1 The expression of TIPE mRNA and protein in A549 cells transfected with shRNA TIPE lentivirus
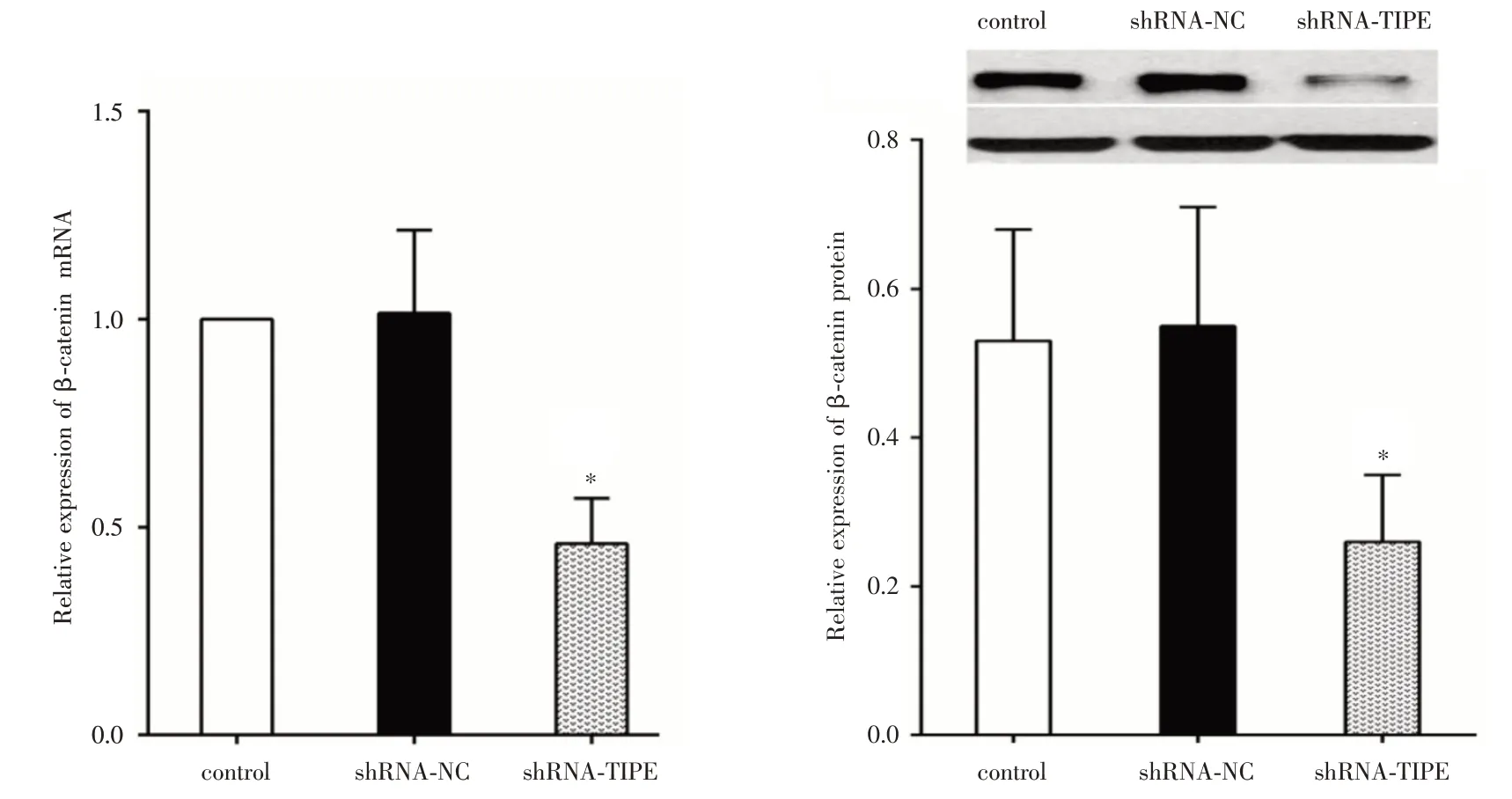
图2 shRNA⁃TIPE 慢病毒转染后A549 细胞内β⁃catenin mRNA、蛋白表达变化Fig.2 The expression of β⁃catenin mRNA and protein in A549 cells transfected with shRNA TIPE lentivirus
2.3 shRNA⁃TIPE慢病毒转染后细胞凋亡变化为进一步确认TIPE 在A549 细胞中的致癌作用,采用流式细胞仪检测细胞凋亡率。见图4,shRNA⁃TIPE慢病毒转染后,A549细胞凋亡率(18.4±4.5)%明显高于阴性对照(12.7 ± 3.6)%和空白对照组(11.5 ±3.4)%,差异有统计学意义(F=4.484 4,P=0.035 1),表明沉默TIPE 基因后可促进A549 细胞凋亡。
3 讨论
NSCLC 包括鳞状细胞癌、腺癌和大细胞癌,占肺癌80%以上,是癌症主要死亡原因之一[9]。据报道中国肺癌患者中男性的发病率接近70%,女性发病率超过30%,世界范围内每年有180 万例肺癌新发病例和160 万例肺癌患者死亡[10],因此阐明肺癌发病机制刻不容缓。手术、放化疗等手段是目前NSCLC 患者的主要治疗方案,但局部复发、远处转移是NSCLC患者最终死亡的主要原因[11-12],因此阐明肺癌发病过程中关键基因可能为肺癌临床诊治提供新思路。
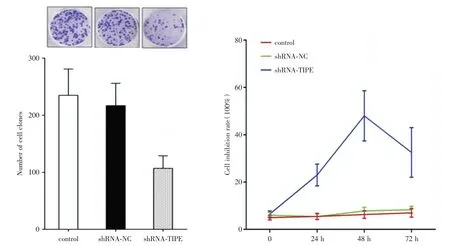
图3 shRNA⁃TIPE 慢病毒转染后细胞增殖变化Fig.3 The change of cell proliferation after shRNA TIPE lentivirus transfection
TIPE 家族是近年来新发现的与肿瘤密切相关的癌基因家族,目前发现TIPE 家族成员包括TIPE、TIPE1、TIPE2、TIPE3,TIPE 是首先被发现的家族成员,参与细胞凋亡、肿瘤细胞增殖等生物学过程[13]。有研究发现TIPE 在多种实体肿瘤中呈高表达状态,TIPE 的表达水平与肿瘤的TNM 分期相关[14-15]。TIPE 家族成员具有高度同源性的序列,其核酸序列的氨基末端包含一个死亡效应结构域(death effector domain,DED),DED 通过Fas 结合调节细胞凋亡[16-17]。有学者通过构建TIPE 过表达质粒载体转染人宫颈癌细胞Hela 细胞,结果发现未转染的Hela 细胞的亚G1 期细胞数量增加,转染的Hela 细胞由G1 期向S 期转变,进一步发现TIPE 的DED 能负向抑制Caspase 介导的细胞凋亡[18-19]。本研究通过构建shRNA⁃TIPE 慢病毒转染非小细胞肺癌细胞系A549 后,A549 细胞克隆形成能力、增殖能力下降,A549细胞凋亡率(18.4±4.5)%明显高于阴性对照(12.7 ± 3.6)%和空白对照组(11.5 ±3.4)%,差异有统计学意义(F=4.484 4,P=0.035 1),表明TIPE 基因具有促进A549 细胞增殖、抑制凋亡的作用,然而其机制原因尚未完全明确。既往研究证实β⁃catenin 信号通路的异常活化与肺癌发生发展密切相关,Wnt/β⁃catenin 通路是Wnt 信号在细胞质中传递的经典途径,β⁃catenin 更是该信号调控通路中的核心,其表达量或活性改变将直接影响Wnt/β⁃catenin 信号通路的功能[20]。研究证实NSCLC 组织、细胞中Wnt/β⁃catenin 信号呈异常活化状态,其异常活化状态受c⁃Myc、p53 等癌基因表达调控[21],且异常活化的β⁃catenin 使肺癌细胞具有更强的增殖、迁移、侵袭和抗凋亡能力[22]。本研究发现shRNA⁃TIPE 慢病毒转染非小细胞肺癌细胞系A549 后,TIPE 和β⁃catenin mRNA、蛋白表达均下降,表明shRNA⁃TIPE 慢病毒感染可成功沉默TIPE 基因的转录和表达,同时下调A549 细胞内β⁃catenin mRNA 和蛋白表达水平。本研究初步探讨TIPE 下调Wnt/β⁃catenin 信号通路对非小细胞肺癌细胞系A549 增殖、凋亡的影响,推测TIPE 可能通过Wnt/β⁃catenin 参与肺癌的发生发展过程。
综上所述,TIPE可能通过激活Wnt/β⁃catenin信号通路促进非小细胞肺癌细胞系A549细胞增殖,抑制凋亡,通过构建shRNA⁃TIPE 慢病毒进一步明确了TIPE、β⁃catenin 在肺癌发生发展中作用机制,为后续NSCLC发病机制的研究提供了新的研究方向。
