不同接种方式下小片球菌C30对‘赤霞珠’葡萄酒品质的影响
2021-01-20浩楠马腾臻杨学山张波韩舜愈
浩楠,马腾臻,2,杨学山,2,张波,2,韩舜愈,2,3*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州,730070)3(中国葡萄酒产业技术研究院,宁夏 银川,750021)
苹果酸乳酸发酵(malolactic fermentation, MLF)是葡萄酒的“二次发酵”,该过程不仅使葡萄酒脱酸产生更柔软的口感,而且通过除去具有生物活性的有机酸(L-苹果酸)来提高葡萄酒的微生物学稳定性和改善葡萄酒感官品质[1]。传统的葡萄酒酿造通常采用酵母先进行酒精发酵(alcohol fermentation,AF),后利用乳酸菌自然启酵或人工接种乳酸菌进行MLF,其弊端主要为酿造时间较长,成本较高,且AF后再进行MLF时已进入秋季,温度降低抑制了MLF的启动。若能在AF过程中接种乳酸菌进行MLF,则可节约时间、降低成本,同时获得较好的MLF启动条件。但有研究发现在AF过程中接种乳酸菌进行MLF存在酵母与乳酸菌之间的拮抗作用,影响葡萄酒品质或导致葡萄酒酿造的失败[2]。
小片球菌(Pediococcusparvulus)是启动MLF的乳酸菌之一,前期自筛得到了P.parvulusC30,具有不亚于商品乳酸菌的酿造特性[3]。过去认为片球菌属细菌因其会导致葡萄酒黏稠、产生不良风味次级代谢物,是葡萄酒中的腐败菌[4-5]。但随着研究的深入,发现某些片球菌属细菌不仅能完成MLF而且对葡萄酒的风味、感官等具有积极影响。JUEGA 等[6]将本土有害片球菌(Pediococcusdamnosus)应用在Albario和Caio葡萄酒中进行MLF,发现葡萄酒未变质且赋予葡萄酒蜂蜜香气与浓郁酒香。刘莉萌等[7]也从白酒窖池中分离出了2个新种:酒窖片球菌(Pediococcuscellicola)和耐乙醇片球菌(Pediococcusethanolidurans)。因此,研究葡萄酒中存在的片球菌属细菌对葡萄酒的品质影响,对国内地域特色葡萄酒的酿造具有重要的意义。
本实验以甘肃河西走廊产区“赤霞珠”葡萄为原料,将自筛P.parvulusC30在葡萄酒AF过程中的早、中、后期分别进行接种,并以商品菌株OMEGA与VP41为对照触发MLF,比较在不同接种时期下P.parvulusC30的发酵动力学、安全性及对黑比诺葡萄酒各理化参数、颜色和香气成分等品质的影响,并结合感官评价探讨P.parvulusC30在干红葡萄酒酿造工艺中的应用潜力,以期改进葡萄酒酿造工艺,节约酿造时间,降低酿造成本,为甘肃河西走廊葡萄酒产区酿造区域特色风格的干红葡萄酒提供依据与开创新方向。
1 材料与方法
1.1 材料与试剂
试验材料:本试验所用乳酸菌为实验室自筛P.parvulusC30;赤霞珠(Cabernet Sauvignon)葡萄,含糖量约为26.2~26.4 °Brix,2017年采样于甘肃武威莫高酒业有限责任公司。
药品与试剂:酿酒酵母(LALVIN BM4X4),丹麦Home Brew Ohio公司;商品乳酸菌(OMEGA和VP41)、果胶酶(Cuvee Blanc),法国Lallemand公司;福林酚、福林丹尼斯、2-辛醇(色谱纯)、放线菌酮,美国Sigma公司;L-苹果酸、L-乳酸含量测定试剂盒,爱尔兰Megazyme公司;无水葡萄糖、没食子酸及无水碳酸钠等其他试剂均为国产试剂;费林试剂、次甲基蓝及酚酞指示剂等均按GB/T 603—2002《化学试剂 试验方法中所用制剂及制品的制备》进行配制。
1.2 仪器与设备
827型pH计,上海雷磁公司;Genesis 10S型紫外-可见分光光度仪、RACE 1310气象色谱-质谱联用仪,美国Thermo Fisher Scientific公司;色谱柱DB-WAX(60 m×2.5 mm,0.25 μm),美国Agilent Technologies公司;固相微萃取(solid phase microextractio,SPME)装置、50/30 μm二乙基苯/碳分子筛/聚二甲基硅(divinylbenzene/carboxen/polydimethyl-siloxane,DVB/CAR/PDMS)萃取头,美国Surpelco公司;SPX-150-II生化培养箱,上海新苗医疗器械制造有限公司;1810 D超纯水机,重庆摩尔水处理设备有限公司;CP 214型电子天平,上海奥豪斯仪器有限公司;Mix Plus漩涡振荡仪,合肥艾本森科技仪器有限公司;H2050R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司。
1.3 实验方法
1.3.1 酿造发酵实验
葡萄酒的酿制:筛选适量品质较好且成熟度一致的赤霞珠葡萄除梗破碎后分装于2.5 L发酵罐中,添加50 mg/L SO2(以偏重亚硫酸钾形式)及200 mg/L果胶酶,低温浸渍72 h后,接种0.2 g/L酿酒酵母 BM 4X4并于22 ℃下进行AF,按照以下3种接种方式进行酿造[8]:
早期接种:在接种酵母菌进行AF后的24~72 h内接种P.parvulusC30、商品乳酸菌OMEGA与VP41。
中期接种:在接种酵母菌进行AF的1/2~2/3过程中接种P.parvulusC30、商品乳酸菌OMEGA与VP41。
后期接种:在接种酵母菌完成AF后接种P.parvulusC30、商品乳酸菌OMEGA与VP41。
至残糖低于4 g/L且通过纸层析法判断MLF完成,进行2次倒罐去酒泥并用0.45 μm滤膜过滤,酒样在低温下密封贮存备用。所有实验均设置3个平行。
1.3.2 MLF发酵动力学测定
乳酸菌生物量监测:采用平板计数法[9]。在发酵过程中每隔3 d取酒样,用生理盐水稀释成10-7~10-1菌悬液。吸取0.1 mL 10-7~10-5各菌悬液,涂布于添加50 mg/L放线菌酮的乳酸细菌培养基上。27 ℃培养5 d后观察各菌落形成情况并计数,菌落总数以菌落形成单位(CFU/mL)表示。
苹果酸、乳酸含量监测:采用试剂盒测定。在发酵过程中每隔3 d取酒样,并以纸层析法判断L-苹果酸斑点消失,则MLF结束。将待测酒样以体积比1∶10稀释后,用96孔微孔板在340 nm下分析,根据公式(1)计算:

(1)
式中:标准L-苹果酸和L-乳酸的质量浓度为0.15 mg/mL;n,稀释倍数。
1.3.3 葡萄酒安全性测定
氨基甲酸乙酯(ethyl carbamate,EC)测定:参照郝兰兰等[10]同位素内标定量的气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法测定。
生物胺测定:采用(氯仿∶正丁醇)萃取剂提取内标定量的超高压液相色谱-串联质谱(ultra high pressure liquid chromatography-tandem mass spectrometry,UHPLC-MS/MS)法[11]。
多糖测定:多糖的提取采用无水乙醇法,多糖含量采用苯酚硫酸法测定[12]。
1.3.4 葡萄酒基本理化指标的测定
依据GB/T 15038—2006《葡萄酒、果酒通用分析方法》[13]测定发酵液中总糖、总酸、挥发酸含量、pH等指标,乙醇体积分数的测定采用沸点测定仪。
柔和指数的测定参照张佳涛[14]方法,按公式(2)计算:
S=φ乙醇-(ρ总酸+ρ单宁)
(2)
式中:S,样品柔和指数;φ乙醇,乙醇体积分数,%;ρ总酸,总酸含量,g/L;ρ单宁,单宁质量浓度,g/L。
色度、色调:参照SIMONATO等[15]方法,测定酒样在波长为420、520和620 nm处的吸光度值,即A1、A2、A3,三者之和为酒样色度,前两者之比为色调。
1.3.5 葡萄酒挥发性化合物的测定
香气富集:取8 mL酒样于15 mL样品瓶中,加入2.5 g NaCl和10 μL 2-辛醇(内标物),加转子密封,40 ℃恒温搅拌30 min后顶空萃取30 min。萃取结束后,取出萃取头插入GC-MS联用仪进行香气检测[16]。
1.3.6 感官评价
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[13],并略作调整。由11位葡萄酒专业人员及组成评价小组。分别从色泽(10分)、澄清度(10分)、香气(30分)、口感(40分)与典型性(10分)5个方面对酒样进行感官评价,标准如表1。
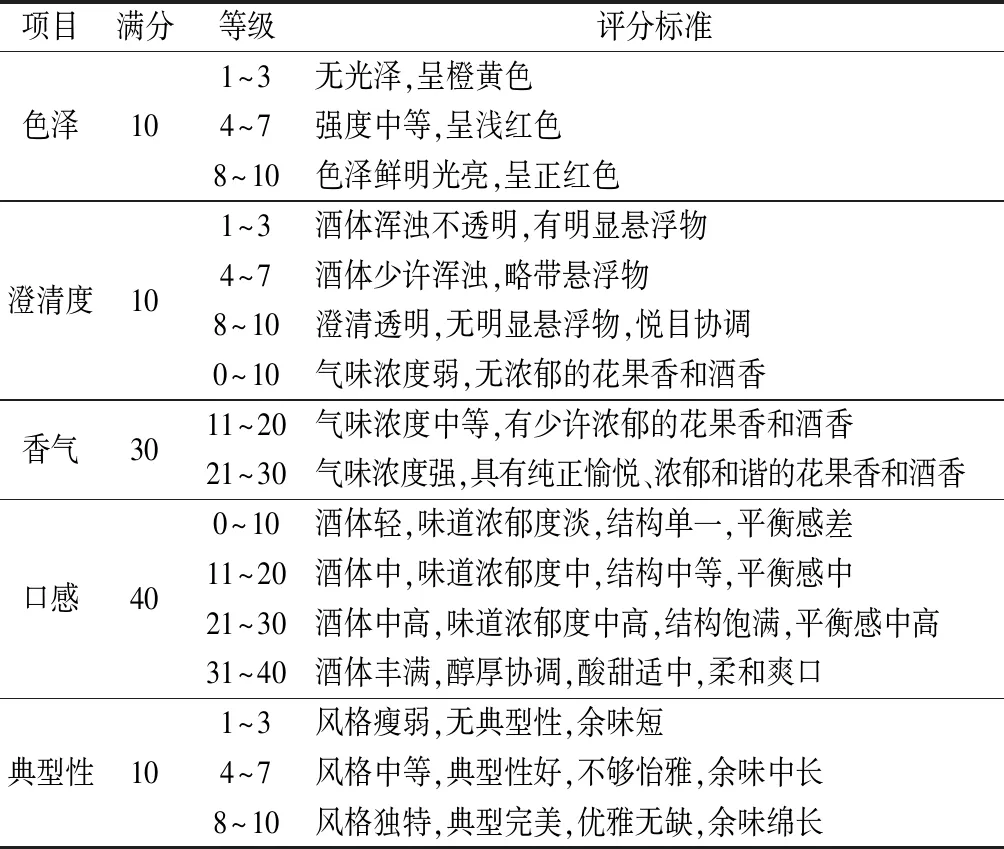
表1 葡萄酒感官评价标准Table 1 Criteria for sensory evalution of wine
1.4 数据处理与分析
数据采用Excel 2010进行计算及相关图表绘制,SPSS 20.0软件进行统计分析、单因素方差分析、主成分分析等。
2 结果与分析
2.1 MLF动力学分析
2.1.1 不同接种方式进行MLF对P.parvulusC30生物量的影响
由图1可知,接种3株乳酸菌后,菌体数量呈先下降后上升再下降的趋势,最终保持在105CFU/mL。这主要是由于AF时,酵母大量生长并产生酒精对乳酸菌的生长造成了一定的抑制作用[17]。在早期与中期接种方式下,P.parvulusC30在第42天与第39天完成MLF,较2株商品菌株慢。而在后期接种方式下,P.parvulusC30在第27天完成MLF,较2株商品菌株快。表明,P.parvulusC30在后期接种具有一定的优势。
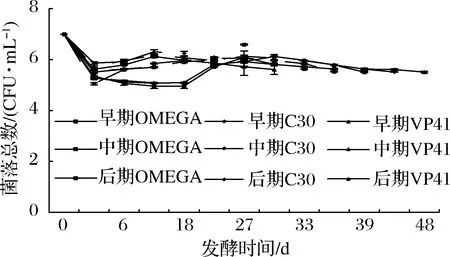
图1 不同接种方式对菌株的生物量的影响Fig.1 Effect of different inoculation methods on the growth of strains
2.1.2 不同接种方式进行MLF过程中L-苹果酸和L-乳酸含量的变化
由图2-a、图2-b可知,在早期、中期、后期接种方式下,酒样中L-苹果酸的含量随着发酵时间的增加而逐渐减少,L-乳酸的含量随着发酵时间的增加而逐渐增加。与2株商品菌株相比,P.parvulusC30在后期接种方式下的L-苹果酸含量最低,L-乳酸含量最高。虽然在早期与中期接种P.parvulusC30可以完成MLF,但其发酵时间较商品菌株长。表明P.parvulusC30在不同接种方式下具有较好的L-苹果酸分解能力。

a-L-苹果酸含量的动力学;b-L-乳酸含量的动力学图2 发酵过程中L-苹果酸和L-乳酸含量的动力学Fig.2 Kinetics of L-malic acid and L-lactic acid during MLF of wine
2.2 葡萄酒的安全性分析
片球菌属细菌是产生生物胺与EC的主要菌种,这些物质的存在会对人体产生危害。此外,片球菌还会产生胞外多糖而引起葡萄酒黏稠[18-19]。由表2可知,不同接种方式下进行MLF后酒样的EC及7种生物胺含量均低于国际相关标准。其中,P.parvulusC30发酵酒样的酪胺、色胺差异与商品菌株差异不显著,而腐胺、组胺含量在早期接种时较商品菌株差异显著。此外,P.parvulusC30发酵酒样的多糖含量差异显著但不会引起葡萄酒的黏稠。表明,P.parvulusC30发酵葡萄酒具有安全性。
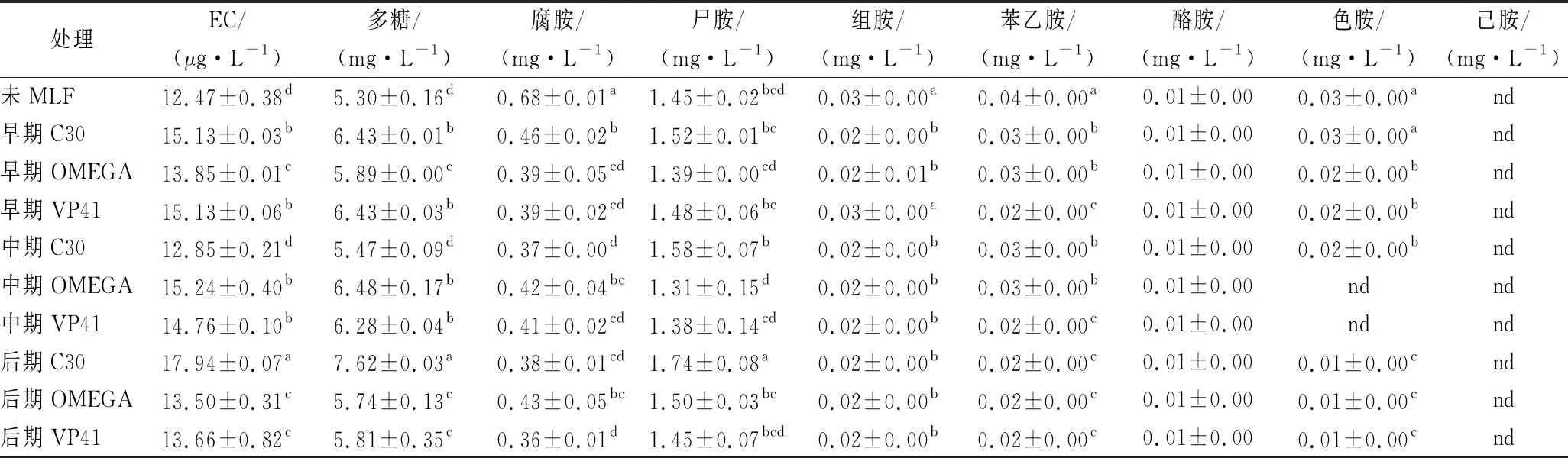
表2 葡萄酒中氨基甲酸乙酯、生物胺及多糖含量Table 2 Ethyl carbamate, biogenic amine and polysaccharide content of wines
2.3 葡萄酒理化指标分析
由表3可知,与未进行MLF的酒样相比,经3种不同接种方式进行MLF后,发酵酒样的残糖含量差异不显著(约为3.00 g/L),酒样的乙醇体积分数在14.00%~16.00%,挥发酸含量低于1.20 g/L。P.parvulusC30发酵酒样总酸含量在后期接种下降幅最大,下降21.93%,pH则随着总酸的降低而升高,酒样的柔和指数上升,色度值降低、色调值升高。综上,表明P.parvulusC30对葡萄酒的基本理化指标影响较小,具有较好的应用潜力。

表3 不同接种方式对葡萄酒基本理化指标的影响Table 3 Physico-chemical indices of wine under different inoculation methods
2.4 不同接种方式进行MLF对葡萄酒香气的影响
2.4.1 葡萄酒挥发性化合物分析
结合以上分析结果,采用HS-SPME-GC-MS法对酒样的挥发性香气化合物进行了检测分析(详细数据见附件表1)。共检出106种香气物质,包括42种酯类(约占香气总量32.46%~47.84%)、27种醇类(45.69%~59.94%)、15种有机酸类(3.18%~7.34%)、10种羰基类(0.01%~0.19%)、8种萜烯类(0.16%~0.76%)及4种其他化合物(0.02%~0.52%)。不同处理酒样的香气物质种类及含量有所差异:与未进行MLF相比,MLF后的P.parvulusC30酒样香气总量均低于未进行MLF的酒样,后期接种P.parvulusC30酒样香气含量较商品菌株显著高(P<0.05)。与商品菌株相比,早期与中期接种P.parvulusC30发酵酒样的酯类物质总含量较商品菌株显著低,分别为0.79倍与0.75倍;醇类物质中的2-甲基-1-丁醇、正己醇及苯乙醇含量显著低于商品菌株VP41发酵酒样。而后期接种P.parvulusC30发酵酒样中辛酸乙酯、丙酸辛酯等含量较高,赋予葡萄酒果香、蜂蜡香,醇类物质中的正戊醇、4-甲基1-戊醇、苄醇等的含量较商品菌株显著高,赋予葡萄酒酒香、柠檬香、玫瑰花香等气味,但呈现红色水果香、酒香的正己酸乙酯、癸酸乙酯含量较低且带有生青味。萜烯类物质是葡萄重要的特征香气[20],数据显示后期接种P.parvulusC30酒样中萜烯类物质的总含量较商品菌株显著高,其发酵酒样中香茅醇与大马士酮含量较高,赋予葡萄酒柑橘香、玫瑰花香气味,但在花香、清香气味方面略差。
2.4.2 主成分分析
由于葡萄酒香气成分复杂多样,且不同酒样香气物质的种类及含量有所差异,因此可通过主成分分析这种多元统计分析方法进行降维,而后研究各处理酒样的香气变化并对其品质进行综合评价[21]。以特征值大于1为依据,共提取7个公因子,其中,PC1、PC2和PC3的累计方差贡献率为72.96%,基本可以解释原变量大多数的变异信息。
载荷系数反映原始变量与主成分间的相关性,即初始变量在降维后因子中的贡献率大小[22]。由图3-a、图3-b可知,PC1主要反映了乙酸苯乙酯、苄醇、苯乙醇、己酸等香气化合物的变异信息(载荷系数>0.8),甲酸异戊酯、辛酸甲酯等则与PC1呈负相关;PC2主要体现了2-甲基戊酸,正己酸乙酯和庚酸乙酯在PC2上的载荷系数则为负;而PC3主要由苯甲醛(正相关)和2,3-丁二醇(负相关)所贡献。
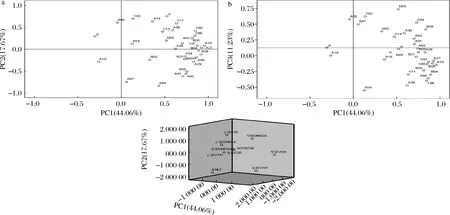
a-PC1-PC2因子载荷图;b-PC1-PC3因子载荷图;c-样品分布图图3 香气化合物主成分分析的因子载荷图及样品分布图Fig.3 Loadings plot and score plot from principal component analysis of volatile aroma compounds
图3-c为主成分分析的样品分布图,早期与中期接种P.parvulusC30处理的PC2得分高于平均水平,但其PC1和PC3得分较低,说明早期接种P.parvulusC30发酵酒样中水杨酸甲酯、正戊醇、辛酸等含量低于其他处理,而对辛酸甲酯、正己酸乙酯和庚酸乙酯等无太大影响。此外,后期接种P.parvulusC30发酵酒样的PC1和PC3得分最高,PC2得分最低,说明后期接种P.parvulusC30发酵酒样的香气物质较商品菌株差异显著。
2.5 不同接种方式进行MLF后葡萄酒的感官分析
由图4可知,所有经MLF的酒样的酒体丰满圆润、口感柔和协调。中期接种P.parvulusC30发酵酒样的澄清度与色泽评分最高;与商品菌株相比,早期接种P.parvulusC30发酵酒样的香气浓度和酒体丰满度、浓郁度、结构感、平衡感都差异显著,但中期与后期接种P.parvulusC30发酵酒样的典型性较高。表明P.parvulusC30在酿造区域特色干红葡萄酒中具有一定的应用潜力。

图4 葡萄酒感官感官分析雷达图Fig.4 Radar map of sensory analysis of wine
3 讨论
3.1 不同接种方式进行MLF的选择
葡萄酒的酿造主要包括由酵母代谢糖类产生乙醇的AF过程与乳酸菌利用L-苹果酸产生L-乳酸的MLF过程[23]。MLF是降低葡萄酒酸度、改善风味的重要方式,传统的工艺是在酵母进行AF后经乳酸菌自然启酵或人工接种商品乳酸菌进行MLF[1,23]。然而,由于AF结束后葡萄酒中乙醇体积分数高、pH低等严苛的环境因素会使MLF难以启动与控制,造成MLF的延迟、增加葡萄酒被微生物感染的风险,甚至会产生一些不良物质[24]。目前研究发现,某些乳酸菌可与酵母以不同的接种方式进行接种,进而达到MLF的顺利进行且缩短发酵时间[17,25]。然而,一些学者研究发现在AF过程中接种乳酸菌进行MLF存在酵母与乳酸菌之间的拮抗作用,导致AF的延迟或终止,或产生具有不良气味的代谢产物[2,26]。
前期从自然启酵的葡萄酒中分离获得1株具有启动MLF且发酵性能优良的P.parvulusC30[3],本实验对所筛选的P.parvulusC30以不同接种方式进行MLF,结果发现P.parvulusC30并没有与酵母产生拮抗作用且能顺利完成MLF,挥发酸也在标准限定范围内,但其在早期与中期接种发酵总时间较商品菌株显著长。而在后期接种时其总发酵时间较商品菌株短,且发酵酒样的香气物质总含量高,这使得在后期接种方式下葡萄酒的果香、酒香更加浓郁,与EDWARDS等[27]研究结果相一致,在赤霞珠葡萄酒中小片球菌改变了葡萄酒的酒香等气味。然而,目前片球菌属细菌对葡萄酒品质影响的研究较少,因此本研究对葡萄酒进行MLF具有重要的意义。
3.2 片球菌属细菌进行MLF对葡萄酒品质的影响
目前已确定可进行MLF的乳酸菌分别为酒球菌属(Oenococcus)、明串珠菌属(Leuconostoc)、乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)[28]。其中,酒类酒球菌(Oenococcusoeni)与植物乳杆菌(Lactobacillusplantarum)因其快速启动MLF、耐受性能优良、产香能力强等优点在葡萄酒MLF中得到广泛使用[29-31]。通常认为片球菌属细菌是葡萄酒中的腐败细菌,因为某些菌株可产生胞外多糖导致葡萄酒“黏稠病”、造成葡萄酒颜色损失及产生不良的风味物质与代谢副产物(生物胺、EC等)[4-5,32]。然而,现已在全世界范围的葡萄酒中发现片球菌属细菌的存在,并有学者研究发现在某些情况下片球菌属细菌可能会增加葡萄酒的风味和香气,不一定会引起葡萄酒的腐败变质[6-7,33]。本实验结果表明接种P.parvulusC30进行MLF,酒样具有安全性[34]。另外,有研究发现在发酵过程中片球菌属细菌会产生高浓度的乙酸及挥发酸[35]使葡萄酒具有尖酸风味,本实验P.parvulusC30发酵酒样的总酸和挥发酸含量均在干红葡萄酒正常发酵范围内(表3)。此外,经MLF后的葡萄酒的色调值升高、色度值降低这一结果与文献报道一致[36]。总体而言,采用P.parvulusC30进行MLF后对葡萄酒理化指标与颜色品质影响较小。
葡萄酒的风格与特色主要是由酒体中不同香气物质共同作用的结果。MLF作为“二次发酵”对葡萄酒感官品质具有较大的影响,接种的乳酸菌不同其产生的风味物质也不同。多数研究认为片球菌属细菌的生长会使葡萄酒腐败,产生异味和不良风味[18-19,37]。然而有少量研究发现,P.parvulus改变了未被认为变质的赤霞珠葡萄酒的酒香[27]以及片球菌属细菌具有大量的酶编码基因,这对葡萄酒香气的产生具有重要作用[19]。本实验研究表明P.parvulusC30可赋予葡萄酒蜂蜡香、酒香、玫瑰香等香气但略带生青气味,小片球菌改变了赤霞珠葡萄酒的酒香、甜香味[20]。并且在后期接种P.parvulusC30酒样中的香茅醇与大马士酮含量显著高与商品菌株发酵酒样。STRICKLAND等[34]也研究了片球菌对葡萄酒感官品质的影响,经评价小组评价并未感觉到不良的黄油风味,这一研究也支持了本研究的感官分析结果。
4 结论
P.parvulusC30具有较好的降酸能力及MLF动力学,可用于赤霞珠葡萄酒的MLF。其在AF的早、中、后期接种进行MLF发酵的酒样符合葡萄酒酿造标准、具有安全性,且其产生的香气物质(苯乙醇、苄醇、香茅醇、大马士酮等)对葡萄酒品质有积极影响。尤其在AF后期进行MLF葡萄酒的酒香丰盈,口感圆润,品质较好,有助于区域特色干红葡萄酒的酿造。
