牛蒡根际土壤中解磷菌筛选、鉴定及解磷条件优化
2021-01-20耿凤英于秋菊
孙 科 耿凤英 于秋菊 王 锋
(徐州生物职业技术学院药品食品学院,江苏徐州 221006)
牛蒡(Arctium lappaL.)为菊科牛蒡属植物,是一种典型的药食同源植物(徐孝梁,2015),具有降血压、降血脂、抗病毒、抗肿瘤等作用(伏卉等,2015)。中国牛蒡产量居世界第一(赵凯 等,2015),而徐州市丰县的牛蒡种植面积大约占全国种植面积的70%,因此,徐州丰县有“牛蒡之乡”之称(任媛媛 等,2016)。
磷是牛蒡生长发育重要的营养元素之一。虽然土壤中含磷量较高,但95%以上的磷元素是以植物体不能吸收的方式存在的(闫小梅 等,2015)。因此,要满足牛蒡生长对磷的需求就要靠施用磷肥,而磷肥的施用不仅增加生产成本,还容易造成土壤、水体等环境的污染(刘文干 等,2012)。在土壤中存在一些微生物利用自身的代谢功能,把土壤中植物不能利用的磷转化为植物可以利用的磷,人们称其为解磷微生物或解磷菌(phosphatesolubilizing microorganisms)(赵越 等,2013)。国家提倡建立资源节约型、环境友好型可持续发展的农业(银婷婷 等,2015),解磷菌成为现代生态农业的研究热点之一(史国英 等,2015)。目前,有关解磷微生物菌肥研究较多,但是针对牛蒡专用复合微生物有机肥的研究还鲜见报道。本试验从牛蒡根际土壤分离筛选解磷菌并通过16S rDNA 进行菌种鉴定和解磷条件优化,为牛蒡专用有机肥提供解磷微生物菌剂。
1 材料与方法
1.1 试验材料
1.1.1 材料 通过5 点取样法在徐州市丰县牛蒡标准化种植基地采集牛蒡根际5~15 cm深土壤样本,装入无菌牛皮纸袋密封。
1.1.2 试 剂 浓H2SO4、Na2CO3、Ca3(PO4)2、NaCl、MnSO4、(NH4)2SO4、MgSO4、FeSO4、KCl、KH2PO4、葡萄糖(分析纯)购自格里斯(天津)医药化学技术有限公司;酵母浸膏、酵母粉、蔗糖、琼脂购自北京陆桥技术股份有限责任公司;升汞(试剂级)购自广州达威化工有限公司;二硝基酚、溴酚蓝购自深圳子科生物科技有限公司;(NH4)6Mo7O24·H2O(分析纯)购自杭州邦易化工有限公司;KSbOC4H4O6·1/2H2O(分析纯)购自广州市锦源化学有限公司;C6H8O6(抗坏血酸)(分析纯)购自无锡市亚泰联合化工有限公司。
1.1.3 培养基 改良PVK 固体培养基:Ca3(PO4)25.0 g·L-1,NaCl 0.2 g·L-1,MnSO40.002 g·L-1,(NH4)2SO40.5 g·L-1,MgSO40.1 g·L-1,FeSO40.002 g·L-1,KCl 0.2 g·L-1,葡萄糖10.0 g ·L-1,琼脂18 g·L-1,双蒸水1 000 mL,pH值7.0~7.2。
改良PVK 液体培养基:在改良PVK 固体培养基基础上去掉琼脂。
NBRIP 固 体 培 养 基:NaCl 0.2 g·L-1,Ca3(PO4)25.0 g·L-1,MgSO40.1 g·L-1,(NH4)2SO40.5 g·L-1,蔗糖 15.0 g·L-1,琼脂 18 g ·L-1,双蒸水1 000 mL,pH 值6.8~7.0。
NBRIP 液体培养基:在NBRIP 固体培养基基础上去掉琼脂。
LB 液体培养基:NaCl 10.0 g·L-1,酵母提取物 5.0 g·L-1,胰蛋白胨10.0 g·L-1,双蒸水1 000 mL,pH 值6.8~7.2。
1.2 仪器与设备
VD-850 台式超净工作台(杭州旭清科技有限公司),XW-80A 漩涡混合器(广森实验器材有限公司),BX43/53 生物显微镜(北京瑞科中仪科技有限公司),HZ-124/85S 半微量电子天平(上海诺宣科学仪器有限公司),LH-PYX3M 生化培养箱(常州金南仪器制造有限公司),HNY-200B 恒温摇床(上海乔跃电子科技有限公司),TDZ4 离心机(青岛诺凯达机械制造有限公司),UV2800S 紫外分光光度计(上海力辰仪器科技有限公司)。
1.3 试验方法
1.3.1 解磷菌富集培养 在装有100 mL 灭过菌的改良PVK 液体培养基的250 mL 三角瓶中加入1 g土壤,置于恒温摇床28 ℃、200 r·min-1振荡培养。36 h 后,取10 mL 培养液接种于100 mL 灭过菌的改良PVK 液体培养基继续富集培养;连续富集培养3 次。
1.3.2 解磷菌初筛 取富集培养菌液,采用平板涂布的方法接种于改良PVK 固体培养基上,28 ℃倒置培养60 h。挑选带有透明圈的菌落,通过划线的方法进行菌株的分离纯化。重复以上操作3~5 次,得到产生透明圈的解磷菌纯菌落,并测量记录菌落直径(d)及透明圈直径(D)。选择D/d 值较大的菌落,斜面保藏备用。
1.3.3 解磷菌复筛 将1.3.2 初筛挑选出的菌株接种到改良PVK 液体培养基上,28 ℃、180 r·min-1培养20 h 后,每隔2 h 取样涂平板检查活菌数。当活菌数达到1×108CFU·mL-1,取5 mL 菌液接种于50 mL 灭过菌的NBRIP 液体培养基,28 ℃、180 r·min-1培养5 d。5 d 后转接入灭菌离心管中,10 000 r·min-1离心20 min,取上清液;采用钼锑抗比色法进行可溶性磷含量的测定,同时利用pH 计测定培养液的pH 值。每株进行3 次平行试验,以灭完菌但没接种的NBRIP 液体培养基作空白对照。
1.3.4 解磷菌的土壤试验 在直径25 cm 的培养盆中装入新鲜牛蒡田土壤5 000 g 和100 g 处理过的柠檬酸发酵废渣,加入复筛后的解磷菌发酵液500 mL,以添加500 mL 无菌水为空白对照,28 ℃培养30 d。30 d 后以去离子水处理试验土壤制备土壤悬液,采用钼锑抗比色法测定可溶性磷含量。设3次平行试验。
1.3.5 解磷菌株的鉴定 形态观察:借助BX43 生物显微镜油镜进行菌株的形态特征观察,在NBRIP固体培养基上观察菌落特征。
生理生化特性鉴定:生理生化特性鉴定参考文献(Bashan et al.,2013;Liu et al.,2014)的方法。
16S rDNA 序 列 分 析(Vassilev et al.,2012):利用北京Solarbio 公司细菌基因组提取DNA 试剂盒提取纯化的菌株DNA。使用通用引物F:5′-AGAGTTTGATCCTGGCTCAG-3′,R:5′-GGTTACCTTGTTACGACTT-3′。采 用PCR 法克隆菌株基因组DNA 的16S rDNA 基因。PCR 反应体系20 μL:10×PCR 缓冲液2 μL,模板DNA 20 ng,dNTPs(10 mmol·L-1)0.45 μL,上、下游引物(20 μL·L-1)各0.25 μL,TaqDNA 聚合酶0.4 μL,加ddH2O 至终体积。PCR 扩增程序:95 ℃预变性5 min;95 ℃变性30 s,55.5 ℃退火45 s,72 ℃延伸2 min,共35 个循环;72 ℃最后延伸10 min。回收琼脂糖凝胶PCR 克隆片段,送至南京世和基因生物技术有限公司进行基因测序,测序结果和NCBI 数据库进行比对,利用Mega 6 软件进行发育进化树的构建。
1.3.6 解磷菌株解磷能力测定 采用钼锑抗比色法进行可溶性磷含量的测定(Mehta et al.,2013;Zeng et al.,2017)。
1.3.7 温度对菌株解磷的影响 把培养的菌液以2%的接种量接种到含有100 mL NBRIP 液体培养基的250 mL 三角瓶中,分别放于5、10、15、20、25、30、35、40 ℃恒温培养箱中,180 r·min-1培养3 d,每个温度进行3 次平行试验,培养结束后采用钼锑抗比色法进行可溶性磷含量的测定。
1.3.8 初始pH 值对菌株解磷的影响 把培养的菌液以2%的接种量接种到含有100 mL NBRIP 液体培养基的250 mL 三角瓶中,NBRIP 液体培养基初始pH 值分别为2、3、4、5、6、7、8、9,放入28℃恒温培养箱中,180 r·min-1培养3 d,每个初始pH 值进行3 次平行试验,培养结束后采用钼锑抗比色法进行可溶性磷含量的测定。
1.3.9 盐浓度对菌株解磷的影响 把培养的菌液以2%的接种量接种到含有100 mL NBRIP 液体培养基的250 mL 三角瓶中,NBRIP 液体培养基盐浓度(NaCl 浓度)分别为3、6、9、12、15、18、21、24 g·L-1,放入28 ℃恒温培养箱中,180 r·min-1培养3 d,每个盐浓度进行3 次平行试验,培养结束后采用钼锑抗比色法进行可溶性磷含量的测定。
2 结果与分析
2.1 解磷菌初筛
把通过3 次富集培养的菌液进行平板涂布,共获得61 株菌株,其中具有明显透明圈(溶磷圈)的菌株24 株,即具有解磷能力菌株24 株,对其进行编号PSM-1~PSM-24。对菌落直径(d)和透明圈直径(D)进行测量,并计算比值(D/d)。从表1 可以看出,菌株PSM-1、PSM-2、PSM-5、PSM-9、PSM-14、PSM-15、PSM-17、PSM-22 和PSM-24 的D/d 值较大,都大于1.5。说明这9 株菌株的解磷能力较强,作为出发菌株进行复筛。
2.2 解磷菌复筛
2.2.1 解磷菌培养液中可溶性磷含量测定 将初筛挑选出来的9 株D/d 值大于1.5 的解磷菌作为复筛的出发菌株,按1.3.3 的方法复筛。9 株解磷菌培养液中可溶性磷含量如图1 所示。可以看出9 株解磷菌培养液中可溶性磷含量均显著高于对照,表明复筛的9 株解磷菌解磷能力较强。特别是PSM-5菌株培养液中可溶性磷含量达到198.28 mg·L-1,PSM-22 菌株培养液中可溶性磷含量达到173.58 mg·L-1,PSM-9 菌株培养液中可溶性磷含量达到了166.43 mg·L-1,挑选这3 株菌株进一步进行小范围的土壤试验。
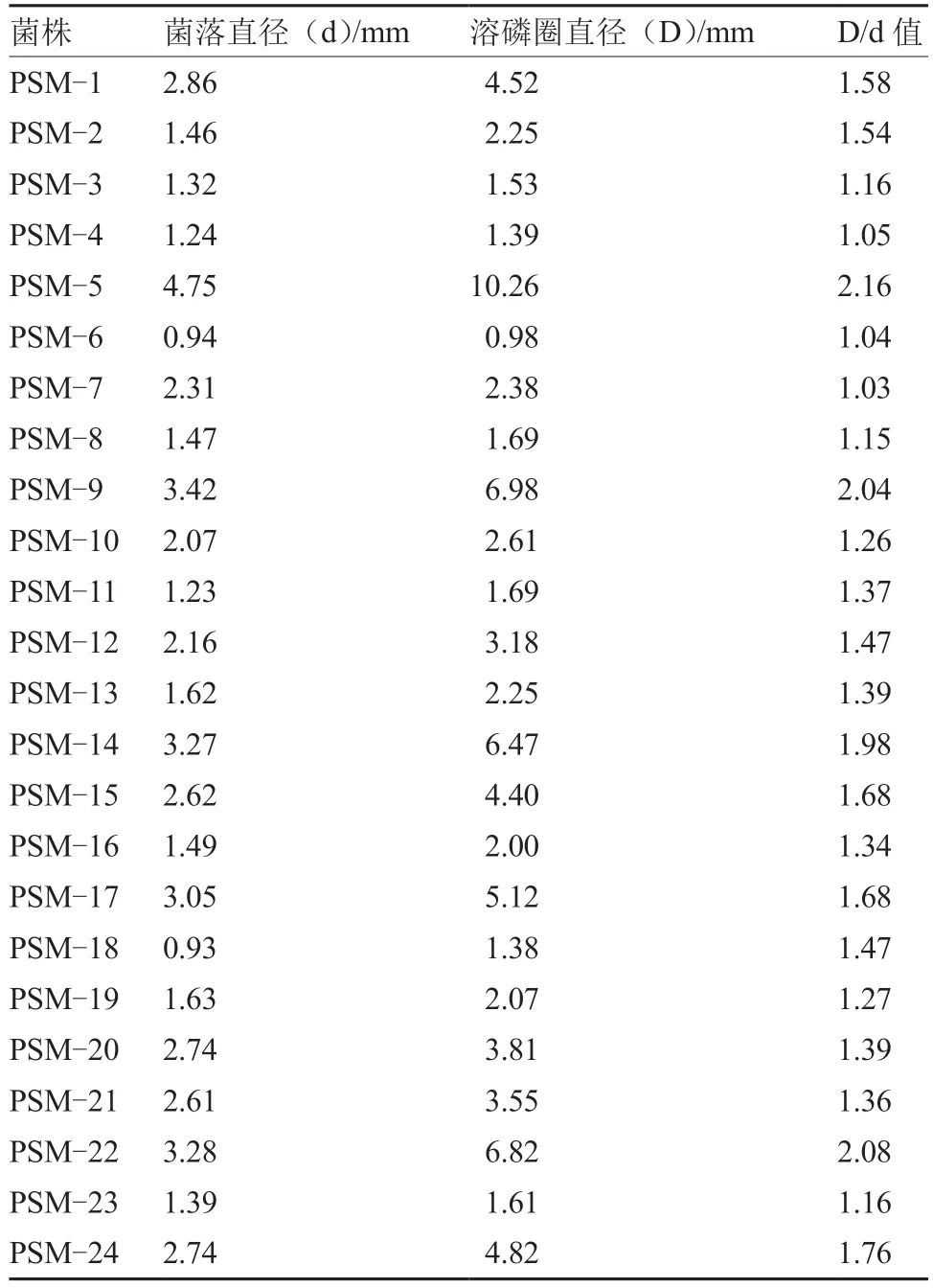
表1 解磷菌菌落直径(d)、溶磷圈直径(D)和D/d 值
2.2.2 复筛解磷菌培养液中可溶性磷含量与初筛解磷菌D/d 值的相关性 对解磷菌培养液中可溶性磷含量和解磷菌溶磷圈直径(D)与解磷菌菌落直径(d)比值进行相关性分析,结果如图2 所示。可以看出:R=0.988 5、P<0.05,解磷菌培养液中可溶性磷含量和D/d 值呈显著的正相关性。也就是说D/d值越大,解磷菌培养液中可溶性磷含量越高。
2.2.3 解磷菌培养液中可溶性磷含量与培养液pH值的相关性 从图3 可以看出,9 株解磷菌培养液和对照pH 值的大小顺序为:CK >PSM-2 >PSM-1 >PSM-15 >PSM-17 >PSM-24 >PSM-14 >PSM-9 >PSM-22 >PSM-5,9 株解磷菌培养液的pH 值均显著低于对照。对比图1 可以看出,培养液pH 值大小顺序和可溶性磷含量大小顺序正好相反,即解磷能力强的菌株产酸能力也强。
对9 株解磷菌培养液中可溶性磷含量与pH值进行相关性分析,如图4 所示。可以看出:R=-0.986 1、P<0.05,解磷菌培养液中可溶性磷含量与pH 值之间具有显著的负相关性。即解磷菌解磷能力越强,产酸能力也越强;解磷菌解磷能力弱,产酸能力也差。原因可能是解磷菌在代谢过程中产生某些酸性物质,降低了环境中的pH 值,而pH 值的降低有利于磷的溶出,这也和现有研究结果(Gong et al.,2013)一致。
2.3 解磷菌对土壤中可溶性磷含量的影响
将复筛中培养液可溶性磷含量较高的3 株解磷菌PSM-5、PSM-22 和PSM-9 挑选出来,按1.3.4的方法进行土壤测试试验。从图5 可以看出:3 株解磷菌在土壤中培养30 d,土壤中可溶性磷含量在前20 d 都呈现直线增加的趋势,但之后出现下降趋势,而对照的可溶性磷含量一直处于较低的水平。可见解磷菌接种土壤可以提高土壤中可溶性磷含量。而土壤中可溶性磷含量呈现先增加后减少的趋势,可能是因为前期土壤中营养物质较为丰富,随着时间推移营养物质逐渐消耗,解磷菌的活力下降,所以制备牛蒡专用生物有机肥除了微生物菌剂之外还要有足够的营养辅料。从图5 还可以看出,虽然3 株解磷菌都可以增加土壤中可溶性磷含量,但与实验室的结果(2.2.1)相差甚远,原因可能与解磷菌培养基的丰富程度、培养条件、菌体的适用性等有关。总体看来,3 株解磷菌中PSM-5 的表现最好。
2.4 解磷菌PSM-5 的鉴定
2.4.1 菌株PSM-5 的形态特征鉴定及生理生化特征鉴定 菌株PSM-5 在NBRIP 固体培养基平板培养2 d 后,菌落形态如图6 所示。菌落圆形,不透明,乳白色,表明光滑、隆起,边缘湿润,菌落周围有明显的溶磷圈。图7 为菌株显微镜下形态,PSM-5 革兰氏染色阴性,显微镜下呈棒状,大小为(0.5~0.7)μm×(1.5~2.2)μm,单生或成对存在。菌株有芽孢、菌毛,无鞭毛。菌株PSM-5 生理生化特性见表2。

表2 菌株PSM-5 生理生化特性
2.4.2 菌株PSM-5 的16S rDNA 基因鉴定结果从图8 可以看出,菌株PSM-5 的扩增产物在1 500 kb 处有1 条明亮的条带,说明基因片段纯度较高,DNA 长度大约为1 500 kb。经检测,菌株PSM-5 的16S rDNA 长度为1 406 个碱基。将测序结果和NCBI 数据库进行比对,从NCBI 数据库中选取与菌株PSM-5 同源性大于95%作为模式菌种,采用NJ 法(邻接法)构建系统进化树。从图9 可以看出,菌株PSM-5 与Bacillus subtilis(GenBank:EU233271)相似度达到99.9%以上,亲缘关系最近。结合菌株PSM-5 的菌落特征、显微观察特征和生理生化特性,将菌株PSM-5 鉴定为枯草芽孢杆菌(Bacillus subtilis)。
2.5 解磷菌PSM-5 最优解磷条件测定
2.5.1 温度对菌株PSM-5 解磷的影响 从图10 可以看出,菌株PSM-5 解磷的温度范围较广:5~40℃都具有解磷能力,只是两端的解磷能力较低。适宜的解磷温度为25~32 ℃,最适解磷温度是28℃,对应的可溶性磷含量最高并达到显著水平(P<0.05)。根据回归方程求解,菌株PSM-5 解磷的最适温度是28.46 ℃。原因可能是温度影响菌株PSM-5 酶的催化活性,从而影响菌株解磷能力,而28.46 ℃正好是菌株酶最适催化温度。
2.5.2 初始pH 值对菌株PSM-5 解磷的影响 从图11 可以看出,初始pH 值较低时,菌株PSM-5 解磷能力较强,可溶性磷含量较高。随着初始pH 值升高,菌株的解磷能力迅速下降,pH 值为9 时,可溶性磷含量已降到5 mg·L-1以下。初始pH 值在3.5~4.5 之间,菌株解磷能力最强,可溶性磷含量最高,根据回归方程求解,菌株PSM-5 解磷的最适初始pH 值是3.79。原因可能是环境的pH 值会影响菌株PSM-5 酶活性,影响菌体代谢,从而影响菌株的产酸和酶的分泌,进而影响菌株的解磷能力。
2.5.3 盐浓度对菌株PSM-5 解磷的影响 从图12 可以看出,当盐浓度低于12 g·L-1时,随着盐浓度增加可溶性磷含量迅速增加,即菌株PSM-5解磷能力迅速增加。当盐浓度高于12 g·L-1时,随着盐浓度增加可溶性磷含量迅速降低,菌株PSM-5解磷能力迅速减小。当盐浓度为9~12 g·L-1时,可溶性磷含量最大,根据回归方程求解,菌株PSM-5 解磷最适的盐浓度为10.46 g·L-1。原因可能是盐浓度影响菌株的渗透压,从而影响了细胞膜的透性,有利于菌株分泌酸性物质和酶。
3 讨论与结论
本试验从徐州丰县牛蒡种植区土壤中初筛出具有解磷能力的微生物24 株,通过测定可溶性磷含量复筛出9 株解磷能力较强的菌株,利用土壤接种方法最终筛选出解磷能力最强的菌株PSM-5。通过菌落特征和显微特征观察、生理生化特性测定和16S rDNA 测定,最终确定PSM-5 为枯草芽孢杆菌(Bacillus subtilis),同时优化了不同温度、初始pH 值和盐浓度条件下菌株PSM-5 的解磷最优条件。要达到最大可溶性磷含量菌株PSM-5 最适的培养温度、初始pH 值和盐浓度分别为:28.46 ℃、3.79 和10.46 g·L-1。
本试验筛选出的解磷菌PSM-5 具有相对较强的解磷能力,28 ℃、180 r·min-1条件下培养5 d,菌株培养液中可溶性磷含量达到198.28 mg·L-1。吕睿等(2017)从陕西省西安市周至县猕猴桃园农田土壤中分离出具有高效降解无机磷能力的菌株JWP3,鉴定结果为胶质芽孢杆菌(Paenibacillus mucilaginosus),当接种量为4%、培养温度30 ℃、摇床转速200 r·min-1、初始pH 值为7 时,培养液中可溶性磷含量最高可达99.56 mg·L-1。苏辉兰等(2019)以广西钟山县贡柑果园土壤为试验材料进行解磷菌筛选,筛选出解磷菌株W3 初步鉴定为黄丝曲霉属(Talaromyces),当接种量为7%、培养温度30 ℃、摇床转速220 r·min-1、培养时间7 d 时,培养液中可溶性磷含量最高可达148.57 mg·L-1。本试验对菌株PSM-5 进行了土壤试验,后续还将进行盆栽试验、大田试验,逐步对菌株进行驯化,使其真正成为牛蒡专用生物有机肥的解磷菌剂,为农业生产服务。
