响应面法对山竹壳中果胶提取条件的优化
2021-01-18刘晓雨李立国朱亮亮马朝红
刘晓雨,李立国,朱亮亮,马朝红
吉林农业科技学院(吉林 132101)
果胶属于一种亲水性植物胶,主要成分是半乳糖醛酸,广泛存在于高等植物的根、茎、叶、果实的细胞壁中。果胶在医药、食品和化妆品工业等领域应用广泛。果胶在预防动脉粥样硬化方面有一定效果,同时可以净化体内的细菌和铅、汞等重金属及放射性元素,对调节餐后血糖上升也具有辅助作用等[1]。商品果胶主要以柑橘皮、苹果渣等为原料生产,我国果胶需求量的80%需要进口,而进口果胶的价格远高于国产果胶,因此,大力开发中国果胶生产显得愈加重要[2]。
山竹(Garcinia mangostanaL.)属藤黄科藤黄属。山竹果实中果肉呈白色瓣状,可食用。果壳呈深紫色或红紫色,厚6~10 mm,约占整果质量的70%。近年,以山竹整果、果肉为原料的功能产品增长迅速,山竹类产品仅在美国就有超过每年2亿美元的市场[3]。但是对于山竹果壳的利用程度很低,只是粗略处理后制成活性炭、微纤维乳化稳定剂等新型工业产品,没有发挥其最大功效,造成极大浪费。所以,对于山竹壳的深入开发利用必定具有商业价值。
试验探究用酸提取法从山竹壳中提取果胶的主要因素,并通过响应面分析法优化最佳提取工艺条件,为进一步开发利用其价值提供依据。
1 材料与方法
1.1 材料与试剂
山竹(市售);D-半乳糖醛酸标品(纯度>93%,Sigma);咔唑(分析纯,中国国药集团上海化学试剂公司)。
1.2 方法
1.2.1 果壳的预处理
山竹果壳切小块,加入沸水中浸泡5~10 min,以灭活果胶酶。蒸馏水漂洗后自然风干,放入电热恒温鼓风中在60 ℃下烘干,研磨,并过孔径0.850 mm筛[4],得到山竹果壳粉,备用。
1.2.2 果胶的提取与沉淀
称取山竹壳粉3.0 g于烧杯中,加入适当盐酸溶液。调节适当温度,提取一定时间。趁热抽滤,洗涤滤渣。取抽滤瓶中的滤液倒入烧杯中。加入适量活性炭脱色即得到果胶提取液。
95%乙醇加入果胶提取液,并保证持续搅拌。稳定后静置0.5~1 h,待出现胶态黏稠状物质。抽滤,即得粗果胶。将所得的粗果胶放入50 ℃干燥箱内干燥,直至水分达到5%以下。得到山竹壳果胶成品。
1.2.3 半乳糖醛酸标准曲线的绘制[5-6]
精确称取D-半乳糖醛酸标准品0.100 0 g,溶解于水中,定容至100 mL。取0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0和9.0 mL分别注入10 mL容量瓶,定容得一组半乳糖醛酸标准溶液(质量浓度0,10,20,30,40,50,60,70,80和90 μg/mL)。取10支50 mL比色管加入1 mL不同质量浓度的半乳糖醛酸标准溶液,分别沿比色管壁加入6 mL浓H2SO4混匀,置于沸水浴中反应20 min,冰浴降至室温。最后加入质量浓度为0.15%咔唑-乙醇溶液0.5 mL,摇匀静放在暗处显色1 h,在λ=528 nm处测定其吸光度,每组试验平行3次。以x(半乳糖醛酸质量浓度)为横坐标,y(吸光度)为纵坐标,绘制出标准曲线。
由图1可知,半乳糖醛酸溶液的线性方程为y=0.041 5x-0.018,R2=0.999 1,表明半乳糖醛酸的含量在10~90 μg/mL范围内有良好线性关系。

图1 果胶含量标准曲线
1.2.4 山竹壳果胶提取率测定
称取获得的果胶样品蒸馏水复溶后,精密移取一定体积稀释,稀释液按图1标准曲线制备方法平行测定3次吸光度,按式(1)计算山竹壳果胶提取率[7]。
果胶提取率=C×V×N/(106×W)×100% (1)
式中:C为样品的半乳糖醛酸质量浓度,μg/mL;V为果胶总体积,mL;N为稀释倍数;W为山竹壳粉质量,g。
1.2.5 果胶提取单因素试验
设置不同梯度的提取温度(40,50,60,70和80 ℃)、pH(1.0,1.5,2.0,2.5和3.0)、提取时间(0.5,1.0,1.5,2.0和2.5 h)和液料比(V(酸解液)∶m(山竹壳粉)=10∶1,15∶1,20∶1,25∶1和30∶1 mL/g),以果胶提取率为评价指标,考察提取温度、pH、提取时间及液料比对果胶提取的影响。
1.2.6 果胶提取条件优化试验
在单因素试验基础上,运用Design-Expert 8.0.6软件程序根据Box-Behnken试验设计原理,以提取温度(A)、pH(B)、提取时间(C)及液料比(D)为影响因素,果胶提取率(Y)为响应值,对提取条件进行优化(表1)。
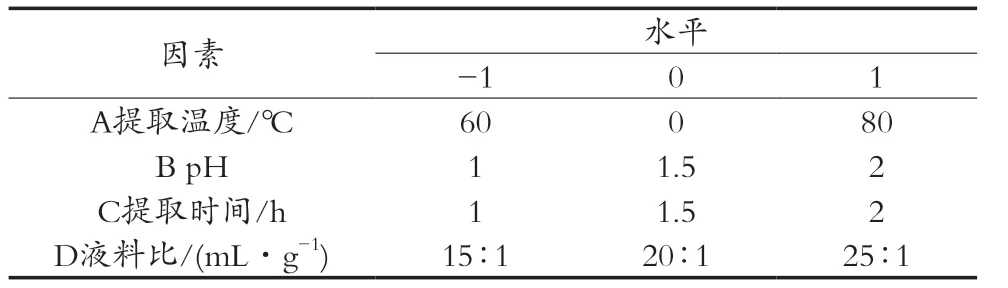
表1 Box-Behnken试验因素与水平
2 结果与分析
2.1 山竹果胶提取单因素试验
2.1.1 酸度对果胶提取率的影响
由图2可以看出,pH 1.5左右时果胶的提取率最大。pH过低,酸性较强,原果胶水解过于强烈,果胶脱酯裂解[8],使得果胶的提取率偏低。pH过高,酸性减弱时,果胶的稳定性下降,导致果胶分解成果胶酸,使提取率降低[9]。
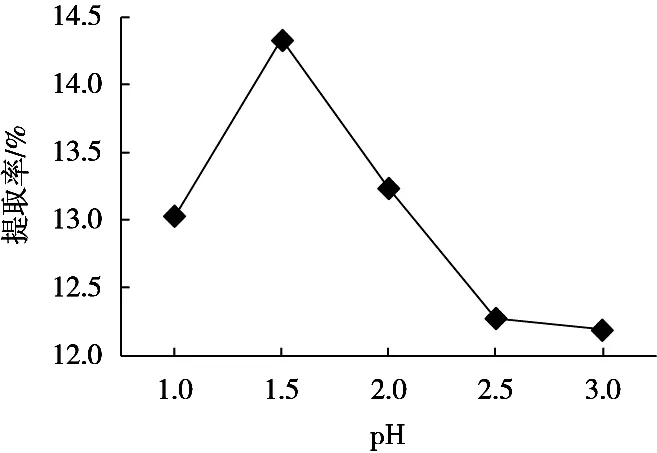
图2 提取液pH对果胶提取率的影响
2.1.2 提取温度对果胶提取率的影响
由图3可以看出,70 ℃左右时果胶提取率最大。温度偏低,水解速度较慢,使提取效果不彻底,提取率偏低。温度过高,由于果胶的耐热性[10]较差,导致果胶的结构本身被破坏[11],使果胶的提取率降低。
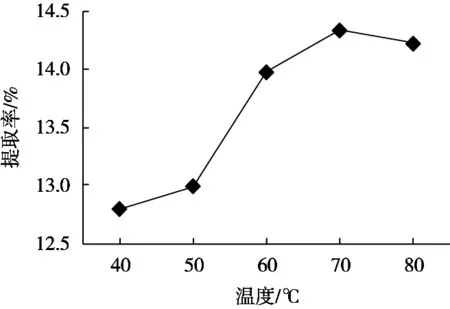
图3 提取温度对果胶提取率的影响
2.1.3 提取时间对果胶提取率的影响
由图4可以看出,加热1.5 h左右时果胶提取率最大。加热时间过短,果胶水解不彻底,提取率低。加热时间过长长,果胶会发生解酯、裂解[12]导致提取率降低。
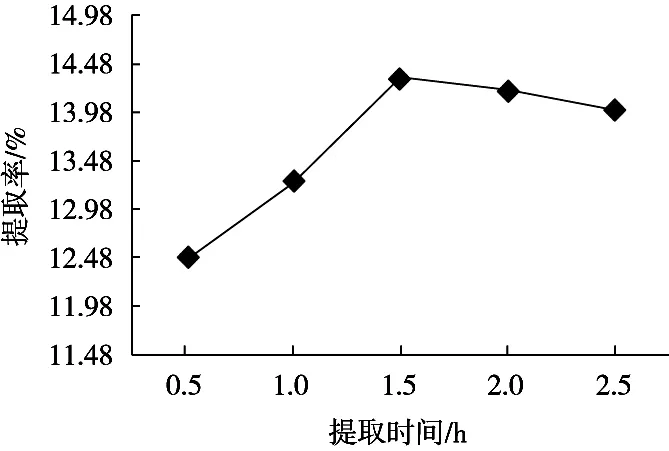
图4 提取时间对果胶提取率的影响
2.1.4 液料比对果胶提取率的影响
由图5可以看出,液料比>20∶1(mL/g),提取率趋于平衡。这是因为液料比较小时,溶液的黏度较大,分子扩散速度低,提取率小,同时叶片中果胶含量与酸解程度相当,反应趋于平衡,提取率不再变化。
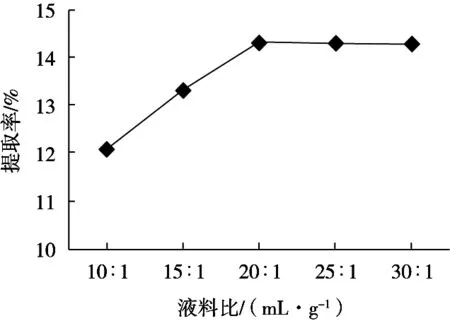
图5 液料比对果胶提取率的影响
2.2 响应面分析试验
2.2.1 试验设计及结果
根据单因素试验结果,试验设计及结果见表2。通过Design-Expert 8.0.6软件,建立二次响应面回归模型,以果胶提取率Y为响应值进行二次多元回归拟合,得回归模型:Y=14.86+0.26A+0.40B+0.12C+0.29D-0.20AB-0.038AC-0.18AD-0.50BC-0.29BD+0.21CD-1.12A2-1.22B2-1.29C2-0.75D2。
2.2.2 山竹壳果胶提取条件响应面法优化结果
以提取温度(A)、pH(B)、提取时间(C)及液料比(D)为影响因素,以果胶提取率(Y)为响应值,对提取条件进行优化。Box-Behnken响应面试验结果见表2,方差分析结果见表3。
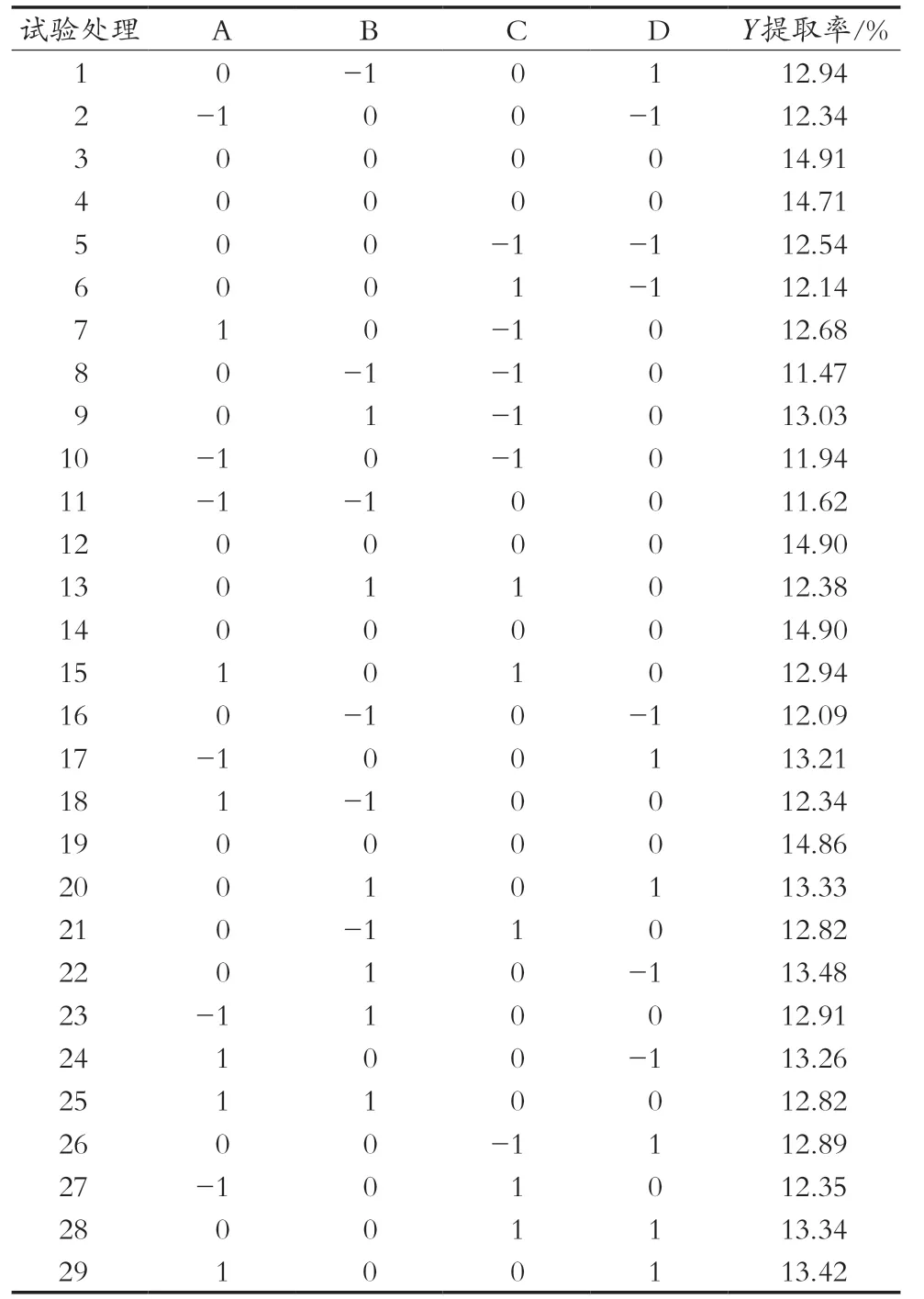
表2 Box-Behnken响应面试验设计结果
由表3可知,模型的p<0.000 1,表示回归模型的方差关系是显著的。失拟项的p=0.051 5>0.05,表示方程与实际拟合中非正常误差所占比例小,回归方程的关系是好的。R2=0.983 9,表示响应值的变化有98.39%来源于所选因素,表明模型拟合度较好。回归模型一次项A、B、D对果胶提取率影响极显著,C对果胶提取率影响显著;交互项BC、BD影响极显著,交互项AB、CD影响显著,其余不显著;二次项均达到极显著水平,说明各因素对响应值的影响较为复杂,并非简单的线性关系。响应曲面图可以描述各因素间的相互作用,见图2~图5。响应曲面坡度越陡峭,表明响应值对于操作条件的改变越敏感[13],且其中心位于所考察区域内,说明在考察区域范围内存在最大响应值。通过软件响应面分析优化得到果胶提取最佳工艺条件为提取温度70.50 ℃、pH 1.56、提取时间1.53 h、液料比20.67∶1(mL/g)。此时果胶提取率为14.92%。考虑到实际操作,修正条件为提取温度70℃、pH 1.5、提取时间1.5 h、液料比20∶1(mL/g)。进行3次平行试验,得到果胶提取率均值为14.56%。
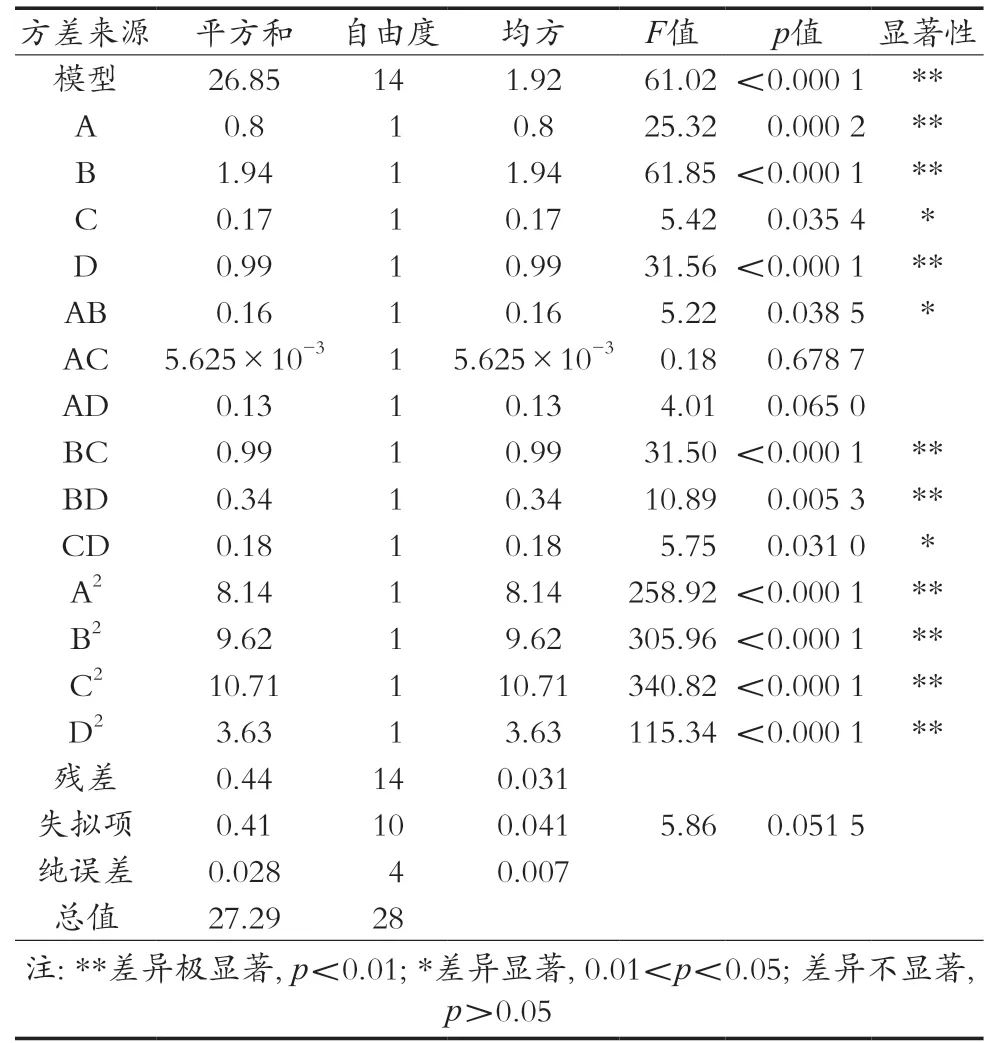
表3 回归方程方差分析
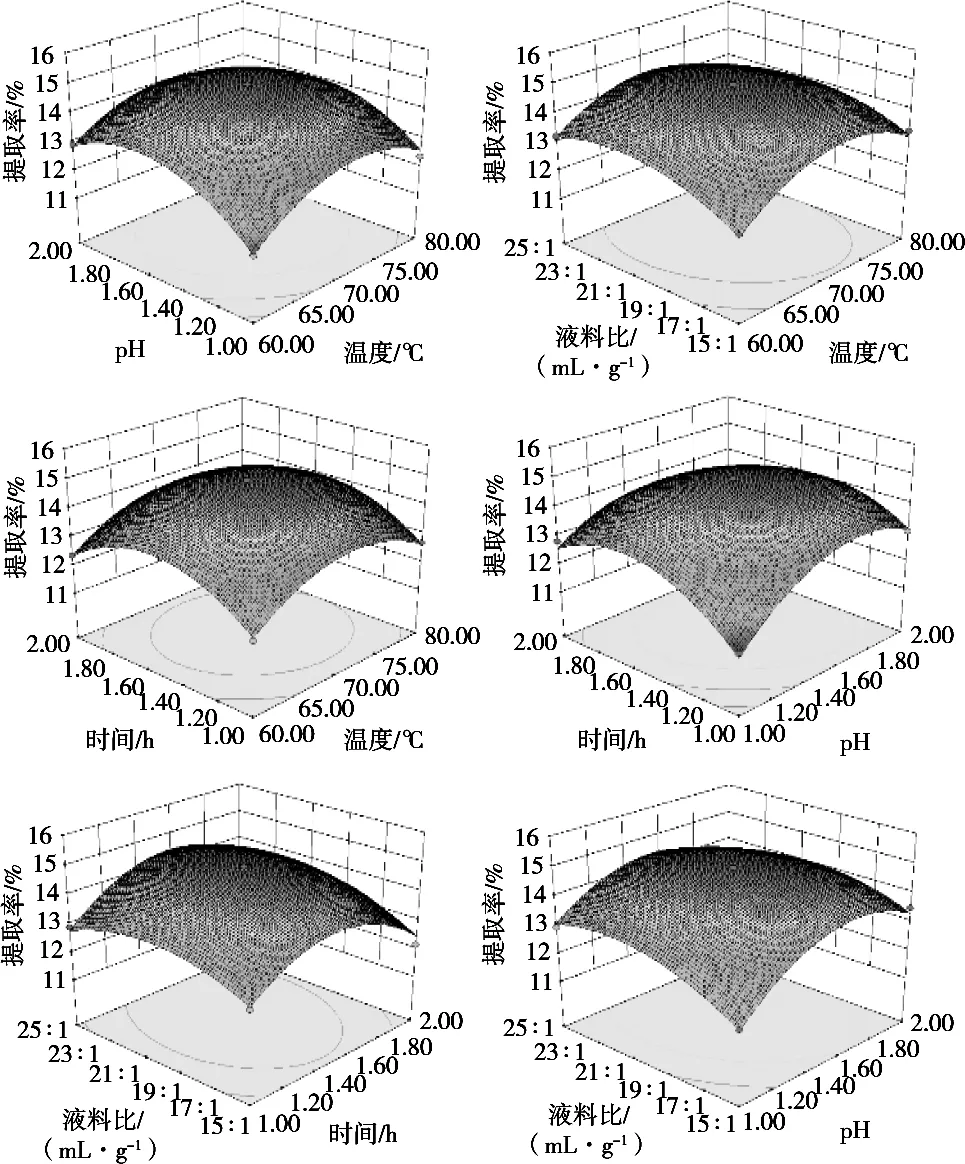
图6 液料比、pH、提取温度及提取时间交互作用对果胶提取率的响应面及等高线
3 结论
试验采用酸提取法提取山竹壳中果胶,在单因素试验基础上采用响应曲面法优化提取工艺。结果表明,采用响应面法所得到的试验模型可靠,具有一定实用和参考价值,其优化的提取工艺条件为提取温度70 ℃、pH 1.5、提取时间1.5 h、液料比20∶1(mL/g)。果胶提取率为14.56%,与理论值14.92%较接近,方法可行。
