胶质母细胞瘤临床病理及预后因素分析
2021-01-15杨治花杨亚丽刘晓莉张自新陆海洋
杨治花,杨亚丽,刘晓莉,张自新,陆海洋,折 虹
胶质母细胞瘤(GBM)是最常见的原发中枢神经系统恶性肿瘤[1],手术联合术后放疗及同步、辅助替莫唑胺化疗是成人新诊断GBM的标准治疗方案,年龄、手术切除程度、肿瘤大小、KPS评分等是影响GBM预后的常见因素。组织学特征和分子分型的整合提出了新的胶质瘤分类标准,其中异柠檬酸脱氢酶(IDH)突变、1p/19q联合缺失对胶质瘤诊断及预后判断具有一定的价值[2]。端粒酶逆转录酶(TERT)启动子区突变是另一个重要的分子标记物,在多种肿瘤中都有特征性的端粒延长,并与预后相关[3]。但胶质瘤发生、发展是一个错综复杂的过程,多项分子改变参与其中,各个分子指标之间相互作用的具体机制有待进一步研究探讨。本文收集了我院手术病理确诊的60例GBM患者临床病理资料,分析其生存情况,同时检测TERT突变、IDH突变、1p/19q联合缺失情况,研究不同分子组合的预后,以更精准地判断GBM患者的临床预后。
1 资料与方法
1.1 一般资料:本研究筛选我院2014年1月-2018年12月行手术治疗、病理诊断明确的GBM患者60例,其中男性36例,女性24例;年龄20~75岁,中位年龄50岁;替莫唑胺辅助化疗1~17周期,中位6周期。所有患者均进行了术后同步放化疗+辅助化疗。
1.2 检测方法:采用免疫组化方法检测IDH1表达,阳性者直接判定为IDH突变型,阴性者则进一步采用PCR测序检测IDH1/2突变;采用PCR测序检测TERT启动子区突变,采用荧光原位杂交法(FISH)检测1p/19q联合缺失。
1.3 放射治疗:术后4~6周开始放疗。CT模拟定位,放疗靶区勾画参考RTOG、EORTC、脑胶质瘤诊疗规范(2018年版)[4],具体如下,即GTV:残存病灶+瘤床区+T2flair异常信号区;CTV:GTV外扩1~2 cm,修改避开重要解剖结构;PTV:CTV外扩0.3 cm。放疗剂量,即GTV:2 Gy/次,总剂量60 Gy/30次;PTV:1.8 Gy/次,总剂量54 Gy/30次。
1.4 同步及辅助化疗:同步化疗,即:替莫唑胺75 mg/m2/d,放疗第1天开始,连续服用6周至放疗结束;辅助化疗:同步放化疗后休息1个月,开始辅助化疗,替莫唑胺第1周期150 mg/m2/d,如耐受性良好,后续加量至200 mg/m2/d,连服5 d,28 d/周期。
1.5 随访:采用到院复查、电话随访的方式对所有患者进行随访。
1.6 统计学方法:采用SPSS 16.0统计软件,相关性采用Spearman等级相关分析,Kaplan-Meier法计算生存率并用Logrank检验和单因素预后分析,Cox模型多因素预后分析,以P<0.05为差异有统计学意义。
2 结果
2.1 随访情况:随访截止日期2019年12月31日,中位随访时间12.2个月(4.5~35.8个月),最后入组患者随访满1年,随访率100%。截止随访日期,死亡36例,均死于GBM疾病复发进展期。
2.2 生存情况:全组患者中位生存期14.4个月,1、2、3年生存率分别为57.5%、34.2%、22.8%。
2.3 临床病理特征与预后关系:年龄、肿瘤最大径、放疗前KPS评分、IDH突变、TERT突变、1p/19q联合缺失、化疗周期数与GBM预后有相关性,见表1。Cox多因素分析显示,肿瘤最大径、放疗前KPS评分、TERT突变是GBM的独立预后因素,见表2。
2.4 TERT突变情况及不同分子组合与预后的关系:60例GBM中TERT启动子区突变型42例,其中C228T突变34例,C250T突变8例,野生型18例,TERT突变率70%。Spearman相关分析显示,TERT突变与1p/19q联合缺失相关;TERT突变型、野生型中1p/19q联合缺失率分别为0(0/42)、50%(6/12)(P<0.05)。TERT突变、1p/19q联合缺失、IDH突变联合分析显示,仅IDH突变占3.3%,仅TERT突变占61.7%,三阴性占16.7%,其它占18.3%。仅IDH突变组预后最好,仅TERT突变组预后最差,三阴性及其它分组介于二者中间(P<0.05)。
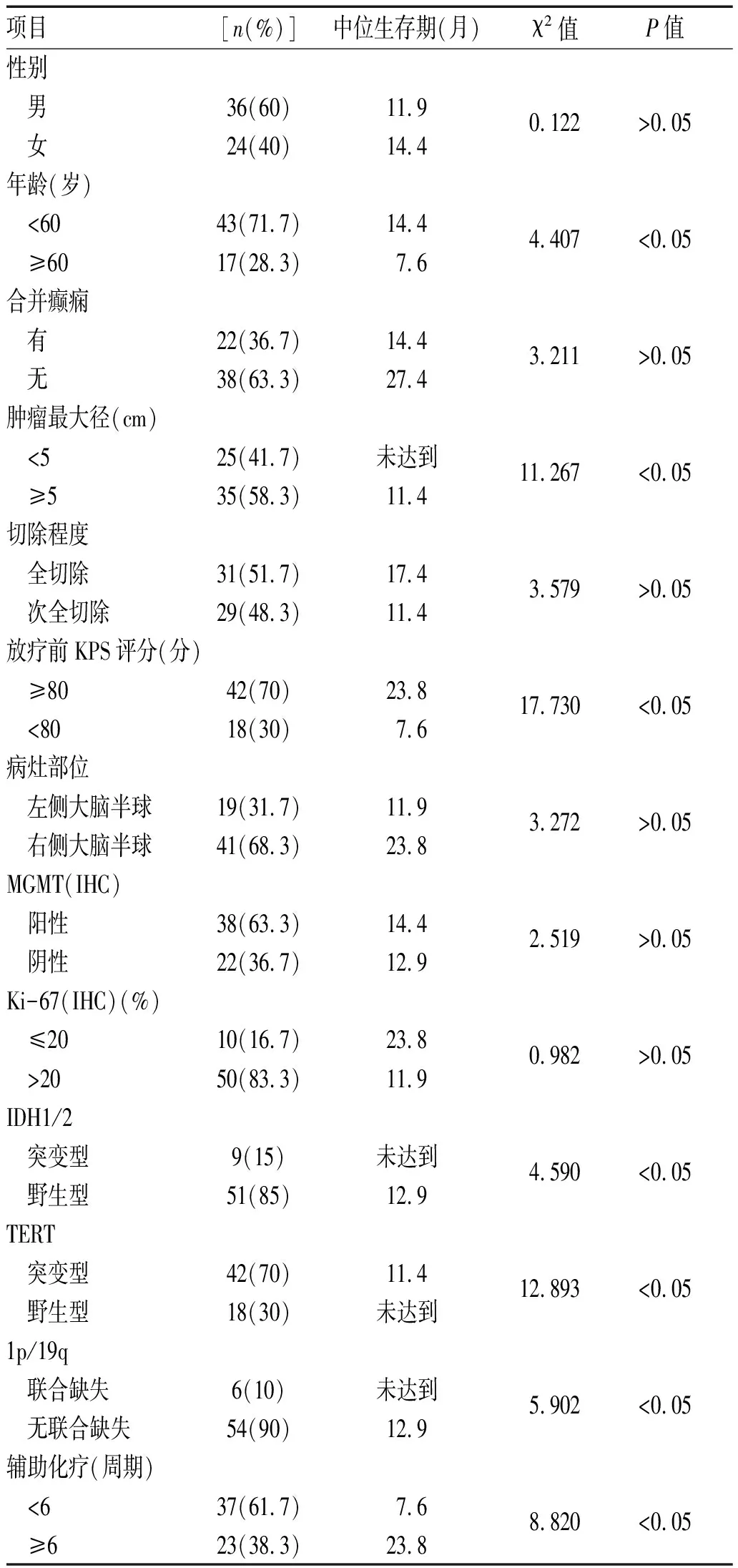
表1 60例GBM患者临床病理特征及单因素预后分析

表2 60例GBM患者Cox模型多因素分析
3 讨论
脑胶质瘤治疗以手术切除为主,提倡最大范围的安全切除,结合术后放疗、化疗等综合治疗方法。GBM术后放疗联合替莫唑胺同步并辅助化疗,已成为成人诊断GBM新的标准治疗方案,但尽管经过标准治疗,GBM预后仍然很差。文献报道GBM 1年生存率为54%~61.0%,2年生存率为8%~32%,3年生存率为4.4%~19.6%,中位生存时间为12.1~21.0个月。本研究结果显示,GBM中位生存期14.4个月,1、2、3年生存率分别为57.5%、34.2%、22.8%,与文献报道一致[5-6]。
手术是GBM最重要的治疗方式,多项研究表明手术切除程度是影响GBM预后的重要因素。Padwal J A等[7]回顾性研究21 962例GBM患者手术切除程度与生存期的关系,结果表明手术全切的GBM患者中位生存期长于部分切除(P<0.05)。本研究结果显示手术全切除中位生存期明显长于次全切除(17.4个月与11.4个月),但未能显示出统计学差异(P>0.05),可能与样本量较小有关。年龄是否为影响GBM患者预后的因素结论不一[6,8]。本研究单因素分析结果表明,年龄是影响GBM患者预后的因素(P<0.05),年龄<60岁的患者具有更长的生存期。多项研究表明KPS评分是影响GBM预后的因素,Chambless LB等[9]通过研究161例经手术治疗后GBM患者术前、术后KPS评分与其预后的关系,认为术后KPS评分能更好地预测患者预后(P<0.05)。本研究单因素分析结果表明,术后KPS评分是GBM患者预后的影响因素(P<0.05),术后KPS评分≥80分的患者具有更长的生存期。Ki67表达水平可反映肿瘤细胞的增殖速度和恶性程度,Ki67高表达表明肿瘤增殖快和侵袭性强,提示肿瘤易复发和恶变[10]。本研究结果显示Ki67低表达(≤20%)患者的中位生存期明显好于高表达(>20%)患者(23.8个月与11.9个月),但未能显示出统计学差异,可能与总样本量小且低水平表达患者数少有关,后续可增大样本量进一步研究证实。替莫唑胺辅助化疗是GBM主要治疗方法之一,同步放化疗后标准辅助化疗周期数为6周期[5];文献报道[11]替莫唑胺化疗小于6周期中位生存期12.7个月,完成6周期中位生存期25.2个月(RR=0.36,P<0.05)。本研究结果显示替莫唑胺化疗<6周期中位生存期7.6个月,完成6周期为23.8个月,2组比较差异有统计学意义(P<0.05),与文献报道基本一致[12-13]。目前对于超过6周期的长周期替莫唑胺辅助化疗的最佳周期数尚无定论。
近年来,分子指标的出现对胶质瘤进行了新的预后分层,其中IDH突变和1p/19q联合缺失在胶质瘤诊断、治疗及预后分层中有着很重要的地位。在GBM中,IDH突变型被认定为继发性GBM,预后相对较好,而IDH野生型则为原发性GBM,预后较差。1p/19q联合缺失与少突胶质细胞瘤的诊断密切相关,常提示好的预后,对烷化剂化疗敏感性好。TERT突变是GBM中最常见的突变,与不良预后相关[3,14]。Razis E等[15]对101例高级别胶质瘤(其中GBM占84.2%)进行基因测序结果显示,TERT突变率74.3%,本组病例TERT突变率70%,与文献报道一致。本研究结果显示,TERT突变与1p19q联合缺失相关,TERT突变型患者中无1p/19q联合缺失。文献报道[16]TERT突变主要发生于原发性GBM和少突胶质细胞瘤,TERT、ATRX(α-地中海贫血/X连锁智力低下综合征)基因突变均与端粒延长有关,但两种突变相互排斥,说明其作用于端粒延长的机制不同,可能与端粒延长替代机制(ALT)有关;1p/19q联合缺失是少突胶质细胞瘤诊断的必要条件,少突胶质细胞瘤中TERT突变率高但ATRX基因突变少见。多项研究表明胶质瘤各个分子改变之间相互影响,存在一定的相关性,但TERT突变与1p/19q联合缺失相关性的具体机制尚待进一步研究证实。Eckel-Passow J E等[17]对1 087例胶质瘤TERT突变、IDH突变和1p/19q联合缺失状态进行分析,将胶质瘤分为5个分子亚型:三阳性、TERT和IDH突变、仅IDH突变、三阴性、仅TERT突变,不同分组预后不同,仅IDH突变组预后最好,仅TERT突变组预后最差。本研究将GBM中TERT突变与IDH突变、1p/19q联合缺失进行分组分析,结果显示仅IDH突变组预后最好,仅TERT突变组占比最高(61.7%)、预后最差,说明分子分型对GBM预后判断具有一定的指导作用。
