H2TiO3新型锂离子筛研究进展
2021-01-11于成龙宁青菊金党波
于成龙, 宋 杰, 宁青菊, 金党波, 程 航
(1.陕西科技大学 材料科学与工程学院, 陕西 西安 710021; 2.陕西金灃科技有限公司, 陕西 西安 710000)
0 引言
锂是自然界中最轻的金属,被誉为“21世纪的能源金属”,在电池、玻璃陶瓷、润滑脂、空气处理、医药、核聚变和航空航天等领域广泛应用[1,2].锂主要来源于锂矿石和锂水资源.其中,锂水资源包括盐湖卤水和海水,超过60%的锂(约26.9 Mt)存在于盐湖卤水和海水中[3].目前,提取锂的方法主要有溶剂萃取法、蒸发结晶法、煅烧浸取法、盐析法、沉淀法、电渗析法、离子筛吸附剂法等[4-6].传统的溶剂萃取法、蒸发结晶法、煅烧浸取法、盐析法和沉淀法等方法不适用于我国高镁低锂型盐湖卤水中提锂.电渗析法的工艺复杂、成本高和能耗大.而离子筛吸附剂法的工艺简单、绿色高效、选择性高、饱和吸附容量大、回收利用率高、经济环保,特别适合我国高镁低锂型盐湖卤水中提锂[7-10].
锂离子筛的类型主要有锰氧化物、钛氧化物、铝酸盐、锑酸盐、复合金属氧化物等,其中,锰氧化物和钛氧化物是锂离子筛中的研究热点.锰氧化物锂离子筛主要有LiMn2O4、Li4Mn5O12和Li1.6Mn1.6O4.其中,尖晶石型LiMn2O4为典型的锰氧化物锂离子筛,其具有较高的吸附选择性和较高的交换容量.但是,由于在洗脱锂过程中存在Mn3+的歧化反应和Jahn-Teller效应,导致锰大量溶损[11,12].因此,随着循环次数增加,尖晶石型锂离子筛的吸附容量逐渐下降.铝酸盐锂离子筛具有高选择性的优点,能高效分离锂离子和共存的碱金属、碱土金属离子.但是,在吸附-洗脱过程中溶损率较高,结构稳定性下降,导致吸附容量减小.锑酸盐锂离子筛具有高选择性和高饱和吸附容量等优点,但是,由于锑酸盐锂离子筛的研究较少且锑具有一定的毒性,因此并未投入工业化生产.复合金属氧化物锂离子筛具有热稳定性高、抗辐射能力强、合成简单及选择性高等优点.但是,不可避免的增加了其它元素的溶损.
层状H2TiO3钛氧化物锂离子筛中的Ti4+具有高度稳定性,在洗脱锂过程中避免歧化反应和Jahn-Teller效应[13-16],结构稳定,具有优异的循环性能和饱和吸附容量,是一种绿色环保型锂离子筛.其锂的抽取率可大于98%,钛的溶损率可小于0.1%,与锰氧化物锂离子筛相比,溶损率大幅度降低,对于获得高纯的锂产品具有战略意义.
H2TiO3锂离子筛是由Li2TiO3经酸洗后制备的.目前,Li2TiO3的合成方法主要有固相反应法、燃烧合成法、溶胶-凝胶法、水热合成法等[17].各种方法制备的锂离子筛前驱体结构不同,酸洗后吸附性能也不同,有必要比较各种方法的工艺参数对结构和性能的影响.此外,还需要明确H2TiO3锂离子筛的吸附机理,以及满足特定功能的H2TiO3锂离子筛的掺杂和成形进行分析.
1 H2TiO3新型锂离子筛的结构
1.1 钛氧化物锂离子筛的类型
目前,钛氧化物锂离子筛类型主要有:层状结构H2TiO3锂离子筛和尖晶石结构H4Ti5O12锂离子筛.它们分别是由前驱体Li2TiO3和Li4Ti5O12经酸洗处理后得到的.关于尖晶石结构H4Ti5O12锂离子筛提锂的相关研究报道较少,而H2TiO3锂离子筛是钛氧化物锂离子筛中的研究热点.
1.2 H2TiO3的结构
首先需要明确前驱体Li2TiO3的结构.图1(a)为层状结构的Li2TiO3结构示意图;图1(b)为沿[100]方向的Li2TiO3晶体结构示意图;图1(c)为沿[001]方向的Li2TiO3的(LiTi2)层的阳离子排列示意图[18].Li2TiO3晶体结构可以表示为氧原子的立方紧密堆积,金属原子置于八面体空隙中,Li原子和Ti原子在结构中形成两种类型的层.如图1所示,在该结构中Ti原子和O原子形成[TiO6]八面体,Li原子位于相邻的两个[TiO6]八面体之间,纯(Li)层和(LiTi2)层交替排列.Li原子在Li2TiO3晶体结构中存在两种位置,分别为位于纯(Li)层的Li1、Li2原子和位于(LiTi2)层的Li3原子.在(LiTi2)层中,分别被1/3的Li3原子和2/3的Ti1、Ti2原子所占据.因此,Li2TiO3的分子式可以表示为Li[Li1/3Ti2/3]O2,能更好的表示其层状结构[19].在Li2TiO3晶体结构中位于两种位置的Li+的含量也不同,纯(Li)层中的Li+的含量占总含量的75%,剩余的25%的Li+位于(LiTi2)层[20].

(a)层状结构的Li2TiO3晶体结构示意图
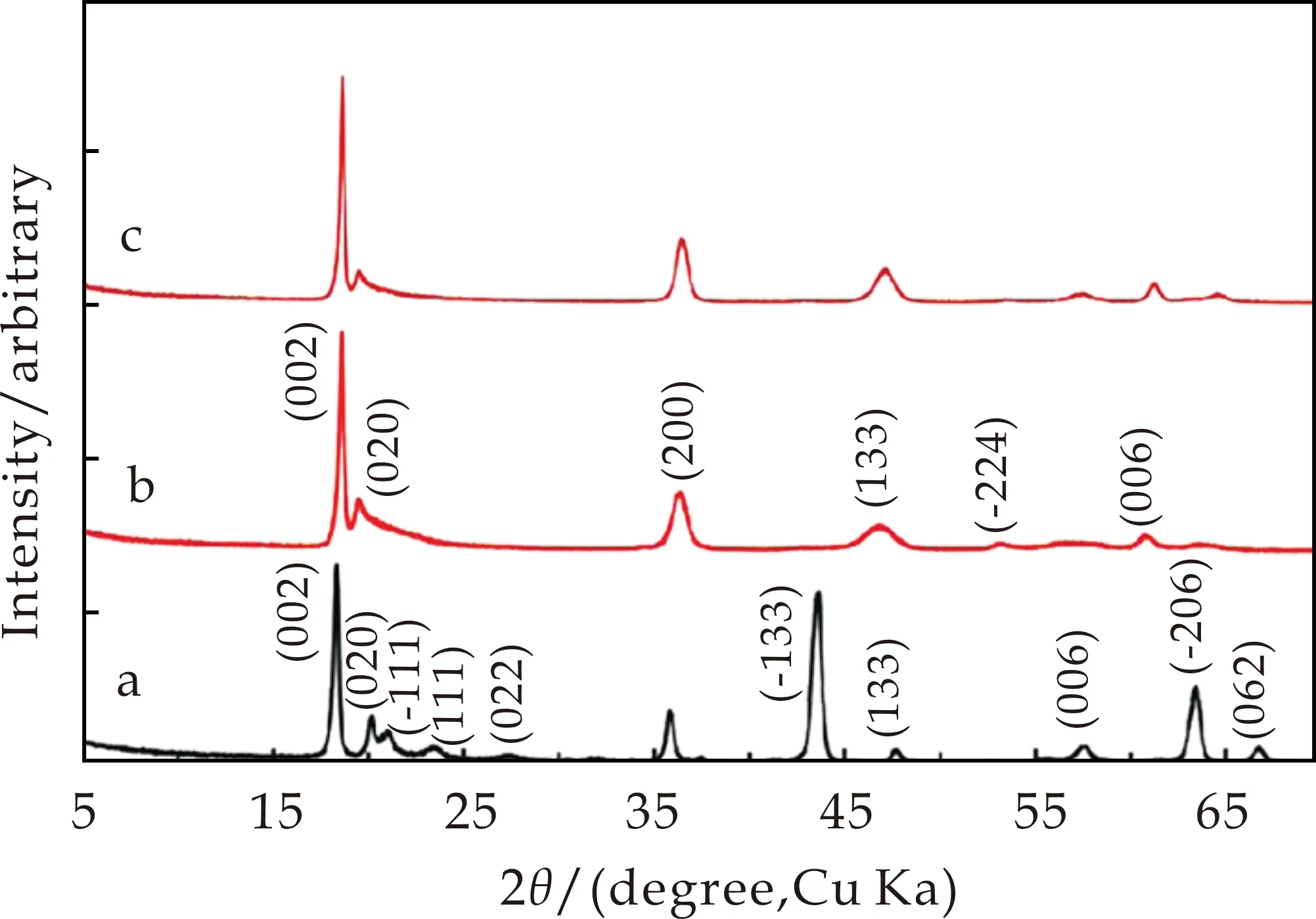
前驱体Li2TiO3经过酸洗处理后,H+和位于纯(Li)层和(LiTi2)层的所有Li+发生交换形成H2TiO3,并保留原来的层状晶体结构[14].但是,Yu等[21]分析了Li2TiO3和H2TiO3的XRD图谱,发现Li2TiO3经过酸洗处理后得到H2TiO3的XRD图谱中峰(-133)、(-206)和(062)消失(如图2的XRD图谱所示),表明Li2TiO3和H2TiO3的晶体结构并不相同.因此,提出了H2TiO3是具有3R1层序的层状双氢氧化物,可以被描述为电中性的金属氢氧化物的叠加[(OH)2OTi2O(OH)2].He等[15]认为在酸洗和吸附过程中,晶体中Li+结合状态发生了变化.Li+易与离子键结合,而H+一般形成共价化合物.因此,在酸洗过程中,随着Li+从晶格中抽出,H+同时进入,保持溶液的电中性.但是,H+是以静电吸引的方式存在,不像原来的Li+是以离子键形式存在.因此,Li2TiO3酸洗后晶体结构被破坏.
a:Li2TiO3;b :H2TiO3;c:吸附Li+ 后的H2TiO3
H2TiO3锂离子筛吸附Li+后,锂离子筛结构中的H+和Li+并不能完全交换.He等[15]认为位于层间的Li+具有一定的活性,导致Li+的无序排列,即破坏了原来Li2TiO3中原子的周期性排列.因此,H2TiO3锂离子筛的晶体结构在吸附前后保持不变,并与最初的Li2TiO3的晶体结构有所不同(如图2XRD图谱中b曲线和c曲线所示).
2 H2TiO3前驱体的制备方法对性能的影响及H2TiO3锂离子筛的掺杂和成形
H2TiO3是由前驱体Li2TiO3经酸洗处理后得到的,因此,H2TiO3锂离子筛的吸附容量取决于前驱体Li2TiO3的制备,不同的制备方法制备的Li2TiO3粉体的结构、晶粒尺寸和形貌各不相同,性能也不相同.目前,用于制备H2TiO3锂离子筛的前驱体Li2TiO3的方法主要有:固相反应法、溶胶-凝胶法和水热法.
2.1 固相反应法
目前,文献中报道的大多数H2TiO3锂离子筛前驱体Li2TiO3粉体的制备方法为固相反应法.表1为固相反应法制备的Li2TiO3晶粒尺寸、XRD图谱中I(-133)/I(002)和I(-206)/I(002)的相对强度及对应的锂离子筛的吸附容量.由表1可知,主要是以LiOH·H2O或Li2CO3为锂源和以TiO2为钛源,充分混合后在650 ℃~850 ℃下煅烧5~24 h.在反应过程中,不同的钛源、锂源、Li/Ti摩尔比、煅烧温度和煅烧时间制备的Li2TiO3结构、晶粒尺寸和所对应的离子筛吸附容量各不相同.特别是钛源类型、Li/Ti摩尔比和煅烧温度对I(-133)/I(002)和I(-206)/I(002)的相对强度的变化、Li2TiO3颗粒尺寸的大小和对锂离子筛吸附容量高低有着重要的影响.

表1 固相反应法制备的Li2TiO3晶粒尺寸、XRD图谱中I(-133)/I(002)和I(-206)/I(002)的相对强度及对应的锂离子筛的吸附容量
由表1可得,Zhang等[22]以LiOH·H2O和Anatase相TiO2按照Li/Ti摩尔比为2∶1充分混合后,750 ℃下煅烧5 h,得到了Li2TiO3粉体的I(-133)/I(002)和I(-206)/I(002)相对强度分别为1.05、0.90,晶粒尺寸为24.3 nm.经酸洗处理后,其所对应的锂离子筛的吸附容量为39.20 mg/g.He等[15]以LiOH·H2O和Anatase相TiO2按照Li/Ti摩尔比为2.2∶1充分混合后,650 ℃下煅烧5 h,得到Li2TiO3粉体的I(-133)/I(002)和I(-206)/I(002)相对强度分别为1.06、0.91,晶粒尺寸为20.5 nm.经酸洗处理后,其所对应的锂离子筛的吸附容量为57.80 mg/g.与Zhang等[22]制备的前驱体相比,He等[15]增大了Li/Ti摩尔比和降低煅烧温度(100 ℃),使制备的Li2TiO3粉体的晶粒尺寸减小(3.8 nm),其所对应的锂离子筛的吸附容量增大(18.60 mg/g).
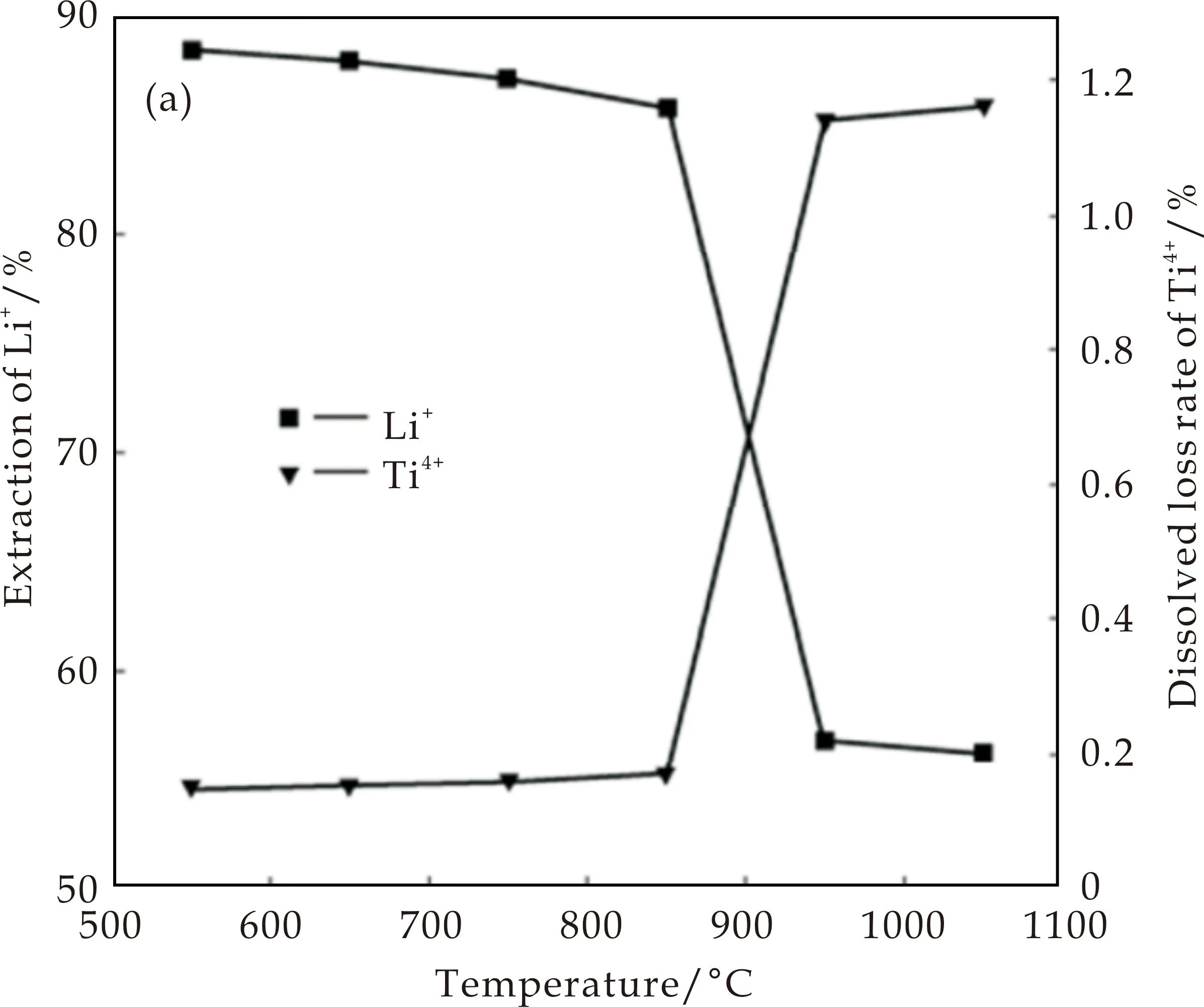
作为H2TiO3锂离子筛的前驱体Li2TiO3,在其完美的晶体结构中Li/Ti摩尔比为2∶1.当Li/Ti摩尔比比值小于2就会形成贫锂的Li2-xTi1+x/4O3,Li+不能完全占据[TiO6]八面体空隙,吸附能力急剧下降.而当Li/Ti摩尔比比值大于2.2时会形成富锂的Li2+xTi1-x/4O3,Li+会渗透到Ti-O-Ti内部的中间层中形成位错,结构发生变化,Li+难以被提取和嵌入,导致吸附能力下降.因此,Li/Ti摩尔比在2∶1~2.2∶1范围之内,Li/Ti摩尔比越高,其所对应的锂离子筛的吸附容量越大.由Shi等[13]的研究结果可知,随着Li/Ti摩尔比比值的增大,Li2TiO3粉体的结晶性越好.而造成Li2TiO3粉体酸洗过程中Li+提取率降低和Ti4+溶损率升高(如图3(a)所示),所对应的锂离子筛吸附容量降低(如图3(b)所示).但是,He等[15]增大了Li/Ti摩尔比和降低煅烧温度(100 ℃)后制备的Li2TiO3粉体晶粒尺寸减小,其所对应的锂离子筛的吸附容量升高,表明在前驱体的制备过程中煅烧温度对所对应的锂离子筛吸附容量影响更显著.

(a)Li/Ti摩尔比对Li2TiO3粉体酸洗过程中Li+提取率和Ti4+溶损率的影响
Shi等[13]进一步研究了前驱体制备过程中的煅烧温度对锂离子筛吸附容量的影响.当煅烧温度在550 ℃~850 ℃范围内,随着煅烧温度升高,Li2TiO3的衍射峰强度增强,Li2TiO3的晶体结构更加完整.但是,当煅烧温度高于850 ℃,Li2TiO3的衍射峰强度随着煅烧温度升高而降低,结构发生了变化.结合图4(a)、(b)可以得到,煅烧温度在550 ℃~850 ℃范围内,随着煅烧温度升高,Li+提取率、Ti4+溶损率、吸附容量几乎不变.当煅烧温度高于850 ℃,Li+提取率和吸附容量随煅烧温度升高急剧减小,而Ti4+溶损率随煅烧温度升高急剧增加.因此,煅烧温度在550 ℃~850 ℃范围内制备的前驱体Li2TiO3粉体所对应的锂离子筛吸附性能最好.
(a)煅烧温度对Li+提取率和Ti4+溶损率的影响
由表1可得,Lawagon等[16]和Chitrakar等[14]以Li2CO3和Anatase相TiO2按照Li/Ti摩尔比为2∶1充分混合后,700 ℃下煅烧24 h,得到的Li2TiO3粉体的I(-133)/I(002)和I(-206)/I(002)的相对强度分别为0.87、0.61和0.88、0.61,颗粒尺寸中值粒径为d1、d2=128、166 nm和颗粒尺寸为100~200 nm.经酸洗处理后,其所对应的锂离子筛的吸附容量分别为33.67 mg/g和32.60 mg/g.与Lawagon等[16]制备的前驱体相比,Chitrakar等[14]在相同的Li/Ti摩尔比、煅烧温度和煅烧时间条件下,制备的Li2TiO3粉体的I(-133)/I(002)和I(-206)/I(002)相对强度、颗粒尺寸基本相同,其所对应的锂离子筛的吸附容量基本不变.表明在相同的工艺参数下制备的Li2TiO3粉体,其所对应的锂离子筛的吸附容量相近.
由表1可得,Shi等[13]和Jang等[23]以Li2CO3和TiO2按照Li/Ti摩尔比为2∶1充分混合后,分别在850 ℃和700 ℃下煅烧24 h,得到了颗粒尺寸为1 000~2 000 nm和100~200 nm的Li2TiO3粉体,其I(-133)/I(002)和I(-206)/I(002)相对强度分别为0.91、0.75和0.90、0.79.经酸洗处理后,其所对应的锂离子筛的吸附容量分别为37.01 mg/g和17.91 mg/g.与Shi等[13]制备的前驱体相比,Jang等[23]在不同的煅烧温度下,制备的Li2TiO3粉体的I(-206)/I(002)相对强度增强了(0.04),颗粒尺寸减小10倍左右,其所对应的锂离子筛的吸附容量减小了(11.72 mg/g).即使Li2TiO3粉体颗粒尺寸显著减小,比表面积明显增大,而锂离子筛的吸附容量依然显著降低,表明制备的Li2TiO3粉体的I(-206)/I(002)相对强度对锂离子筛的吸附容量显著影响.
结合Shi等[13]、Chitrakar等[14]、Lawagon等[16]和Jang等[23]制备的Li2TiO3粉体的I(-206)/I(002)相对强度变化可以看出,随着I(-206)/I(002)相对强度增强,锂离子筛的吸附容量降低,表明采用固相法制备的前驱体的晶体结构,尤其是I(-206)/I(002)的相对强度,对锂离子筛的吸附容量有着显著影响.
需要说明的是,钛源也会对吸附性能有影响.与Zhang等[22]制备的前驱体相比,Tang等[24]改变了钛源类型和增大了Li/Ti摩尔比,使制备的Li2TiO3粉体的I(-133)/I(002)相对强度增强(0.12)和I(-206)/I(002)相对强度减弱(0.17),其所对应的锂离子筛的吸附容量减小了(11.40 mg/g).Zhang等[22]和He等[15]研究了Anatase和Rutile相TiO2对H2TiO3锂离子筛吸附容量的影响.Zhang等[22]认为,与Rutile相TiO2相比,Li2TiO3的[TiO6]八面体更接近于Anatase相TiO2的[TiO6]八面体,很容易实现Anatase相TiO2的[TiO6]八面体向Li2TiO3的[TiO6]八面体转变.因此,Anatase相TiO2作为钛源制备Li2TiO3所需的能垒比Rutile相TiO2小.He等[15]研究表明,煅烧温度越高,由于Anatase相TiO2的晶粒尺寸比Rutile相TiO2的晶粒尺寸更小.以Anatase相TiO2和LiOH·H2O为钛源制备的Li2TiO3粉体,与以Rutile相TiO2为钛源制备的Li2TiO3粉体相比,原料混合更加均匀,晶粒尺寸更小.晶粒尺寸越小,扩散距离越短,比表面积越大,界面反应位点越多,越有利于提高反应速率[25].因此,Anatase相TiO2作为钛源更适合用于制备H2TiO3锂离子筛,有利于锂离子筛的吸附.
2.2 溶胶-凝胶法
相对于用固相反应法,用溶胶-凝胶法制备H2TiO3锂离子筛的前驱体Li2TiO3的文献报道较少.表2为溶胶-凝胶法制备的Li2TiO3晶粒尺寸、XRD图谱中I(-133)/I(002)和I(-206)/I(002)的相对强度及对应的锂离子筛的吸附容量,由表2可知,通常,以CH3COOLi为锂源和以Ti(OC4H9)4为钛源,在500 ℃~800 ℃下煅烧2~8 h.
由表2可得,Zhang等[26]以CH3COOLi和Ti(OC4H9)4按照Li/Ti摩尔比为2∶1充分混合后,650 ℃下煅烧2 h,得到Li2TiO3粉体的I(-133)/I(002)和I(-206)/I(002)相对强度为1.18、0.95,颗粒尺寸为60~80 nm.经酸洗处理后,其所对应的锂离子筛的吸附容量为31.27 mg/g.

表2 溶胶-凝胶法制备的Li2TiO3晶粒尺寸、XRD图谱中I(-133)/I(002)和I(-206)/I(002)的相对强度及对应的锂离子筛的吸附容量
在反应过程中,煅烧温度和煅烧时间对Li2TiO3晶粒的尺寸和结构和其所对应的锂离子筛吸附容量有着重要的影响.随着煅烧温度升高,晶粒尺寸不断增大且形貌也发生了变化.在500 ℃下,Li2TiO3晶粒分布非常均匀,分散性好,呈球形,直径在20~30 nm之间(如图5(a)所示);升温至650 ℃,晶粒尺寸增大,分布较均匀,出现了部分团聚现象,呈球形,直径在60~80 nm之间(如图5(b)所示).当煅烧温度为800 ℃时,晶粒的尺寸和形貌发生显著变化,尺寸增大到400~500 nm,形貌由球形转变为卵石状(如图5(c)所示).众所周知,晶粒尺寸增大,比表面积下降.作为锂离子筛,晶粒尺寸增大,造成Li+和H+的交换位点减少,吸附速率和吸附量容下降.

(a)500 ℃ (b)650 ℃
表3为在不同煅烧温度和煅烧时间下制备的Li2TiO3的Li/Ti摩尔比和晶胞参数.由表3可知,随着煅烧温度的升高和煅烧时间的延长,Li2TiO3晶粒的结晶性越好,结构越稳定.但是,在高温煅烧过程中Li的升华,导致Li/Ti摩尔比降低;Li/Ti摩尔比也会随着煅烧时间的延长而逐渐降低.Kataoka等[18]研究表明,Li2TiO3为单斜结构,属于C2/c空间群,晶格参数为a=5.062 3 Å,b=8.787 6 Å,c=9.753 3 Å,β=100.212 °.结合表3可知,当温度升至650 ℃,晶胞参数明显增大.
由图6(a)可以看出,在650 ℃下Li2TiO3的衍射峰整体向左移,表明晶格发生膨胀,与晶胞参数变化一致.但是,当温度高于650 ℃,晶胞参数变小.650 ℃下,晶格膨胀导致键长变长,键能变弱,有利于Li2TiO3中Li+提取(如图6(b)所示).随着温度升高,Li2TiO3中Li+提取率先减小后略微增大,Ti4+溶损率逐渐增大.在高温煅烧过程中Li的升华造成晶体中存在Li的空位,导致Li2TiO3的结构稳定性下降,使Ti4+溶损率增大.煅烧温度较低时,Li2TiO3结晶性较差,酸洗过程中Ti4+溶损率较高;煅烧温度过高时,又会导致Li2TiO3结晶性高、晶粒尺寸大,不利于Li+提取.由图6(b)可知,在650 ℃下,Li2TiO3中Li+提取率和Ti4+溶损率分别为78.9%和0.07%,饱和吸附容量达到最大值.与固相反应法相比,用溶胶-凝胶法制备的Li2TiO3中Li+提取难度大,但是,在反应过程中Li和Ti混合更加均匀,晶粒更细,比表面积更大.

表3 在不同煅烧温度和煅烧时间下制备的Li2TiO3的Li/Ti摩尔比和晶胞参数[26]

(a)在不同煅烧温度和煅烧时间下制备的Li2TiO3的XRD图

(a)在不同浓度的HCl酸洗条件下,Li2TiO3中Li+提取率和Ti4+溶损率图
Xu等[27]以CH3COOLi和Ti[O(CH2)3CH3]4按照Li/Ti摩尔比为2∶1充分混合后,800 ℃下煅烧4 h,得到的Li2TiO3粉体的I(-133)/I(002)和I(-206)/I(002)相对强度分别为1.10、0.69.经酸洗处理后,其所对应的锂离子筛的吸附容量为44.80 mg/g.制备的前驱体Li2TiO3粉体的Li+提取率和Ti4+溶损率分别为99.9%和0.82%(如图7所示).
2.3 水热法
目前,用水热法制备H2TiO3锂离子筛的前驱体Li2TiO3的报道非常少.Marthi等[28]以钛渣为原料用水热法制备了H2TiO3锂离子筛,制备过程如图8所示.其制备的前驱体的I(-133)/I(002)和I(-206)/I(002)相对强度分别为1.05、0.87,吸附容量达到27.4 mg/g.Yu等[19]以Anatase相TiO2和LiOH·H2O为原料,用水热法制备了纳米β-Li2TiO3粉体.其颗粒尺寸为114 nm,经600 ℃煅烧后的颗粒尺寸没有明显增大,分布均匀,且分散性好.Wang等[29]用两步水热法制备了hT-H2TiO3锂离子筛.第一步,以Anatase相TiO2和LiOH·H2O为原料,在500 ℃下煅烧2 h得到c-Li2TiO3,其制备的前驱体的I(-133)/I(002)和I(-206)/I(002)相对强度分别为0.95、0.85,经0.5 mol/L的HCl酸洗处理24 h后得到c-H2TiO3;第二步,将c-H2TiO3、TBA和LiOH搅拌均匀置于内衬为聚四氟乙烯的高压釜中,在170 ℃下反应24 h得到hT-Li2TiO3(如图9(a)所示),经0.5 mol/L的HCl酸洗处理24 h后得到hT-H2TiO3,吸附容量达到76.7 mg/g.
Laumann等[30]以Anatase相TiO2和LiOH·H2O为原料,用水热法制备了α-Li2TiO3粉体.其颗粒尺寸分布范围为50~80 nm,颗粒分布均匀,分散性好.在800 ℃下经热处理后,α-Li2TiO3可以转变为β-Li2TiO3.但是,α-Li2TiO3粉体经水洗后,约有75%的Li+流失,再经热处理后产物为TiO2和Li4Ti5O12的混合物.而Wang 等[29]在TiO2纳米片的形成过程中加入TBA,由于TBA+可以吸附在带负电荷的Ti-O键上,能够有效地降低其表面能,实现α-Li2TiO3向β-Li2TiO3转变过程中避免晶粒的长大.加入TBA的水热法制备的hT-Li2TiO3中锂的含量明显和核磁共振图谱中Li位点的共振强度也明显高于c-Li2TiO3和h-Li2TiO3(如图9(b)所示),表明hT-Li2TiO3中存在更多的Li+位点可以被H+取代.hT-Li2TiO3粉体经酸洗处理后,与c-H2TiO3和h-H2TiO3相比,颗粒分布均匀、分散性好,颗粒表面更粗糙(如图10(a)、(b)和(c)所示).由图10(d)、(e)可以看出,hT-H2TiO3颗粒更细.
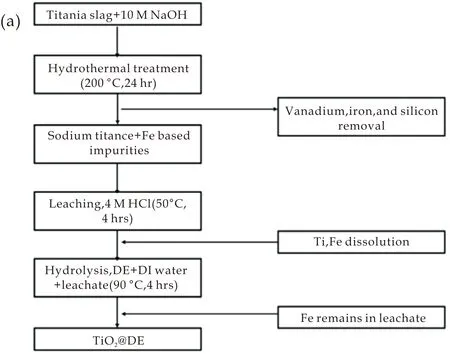
(a)以钛渣为原料制备TiO2@DE的流程图

(a)水热法制备富锂β-Li2TiO3的示意图

(a)c-H2TiO3的SEM图 (b)h-H2TiO3的SEM图
2.4 H2TiO3锂离子筛的掺杂和成形
通常,合成的H2TiO3粉体粒径小于100 nm(如图11(a)所示),具有优异的吸附性能.但是,在使用和转移中存在着流损大、流动性差、回收再利用困难,造成动态应用较差等问题,限制其在实际工业中的应用.因此,H2TiO3粉体需要固定在固体载体上,或者与其它具有分离性能的组分结合.
目前,掺杂和成形是解决H2TiO3粉体锂离子筛的流损大、流动性差、回收再利用困难等问题的两种有效途径.Wang等[31]将Fe掺杂入Li2TiO3晶格中制备了Fe/Ti-0.15锂离子筛(如图11(b)所示),与粉状锂离子筛相比,其分离效率高达94.8%,有效地解决了分离问题.Zhang等[32]用溶胶-凝胶法将Li2TiO3粉体负载在球形的基体材料陶瓷泡沫上(如图11(c)所示),经酸洗后得到了富有发达孔隙结构球状锂离子筛,有效的改善了回收利用的问题.Lawagon等[16]和Limjuco等[33]将H2TiO3粉体分别和PVA(聚乙烯醇)、PAN(聚丙烯腈)进行成形做成柱状泡沫型(如图11(d)所示)和纳米纤维状(如图11(e)所示)锂离子筛,有效的解决了粉体锂离子筛的流损大和回收再利用困难的问题.课题组前期研究,将H2TiO3粉体负载在C膜上制备了两种不同形貌的H2TiO3/C锂离子筛(如图11(f)、(g)所示),一种是以C膜为基体材料,负载或包覆着梭状的H2TiO3晶粒的块状锂离子筛;另一种是在C膜表面上负载着粒径较大的球状H2TiO3颗粒,在球状H2TiO3颗粒表面上又分布着粒径较小的H2TiO3晶粒.吸附实验结果表明,只需要静置5 min,H2TiO3/C锂离子筛和溶液就能达到很好的分离,表明其具有优异的回收再利用性能.

(a)H2TiO3的SEM图 (b)Fe/Ti-0.15的SEM图
3 H2TiO3锂离子筛吸附机理
图12为层状结构H2TiO3的锂吸附过程示意图[2].由图12可知,H2TiO3的吸附过程可以分为两个阶段:第一个阶段是锂离子筛的制备过程(如图11(a)到(b)所示),可以表示为:
Li[Li1/3Ti2/3]O2+4/3H+→H[H1/3Ti2/3]O2+
4/3Li+
(1)
由式(1)可知,溶液中的H+与位于Li2TiO3晶体结构中的纯(Li)层的Li1、Li2原子和位于(LiTi2)层的Li3原子完全发生交换形成H2TiO3锂离子筛.第二个阶段是锂离子筛吸附Li+的吸附过程(如图11(b)到(c)所示),可以表示为:
H[H1/3Ti2/3]O2+xLi+→H1-xLix[H1/3Ti2/3]O2+xH+
(2)
由式(2)可知,溶液中的Li+与位于H2TiO3锂离子筛结构中的纯(H)层H原子完全发生交换形成纯(Li)层.但是,位于 (HTi2)层的H原子不能和溶液中的Li+发生交换.Hosogi等[34]用300 ℃熔融状态的AgNO3处理Li2TiO3,发现Ag+不能在(LiTi2)层与Li+交换,但可以在纯(Li)层发生交换,形成层状结构的Ag[Li1/3Ti2/3]O2.位于(LiTi2)层的Li+活性低于位于纯(Li)层的Li+,在酸洗过程中,位于纯(Li)层中的Li+先与H+交换形成H[Li1/3Ti2/3]O2,然后位于(LiTi2)层中的Li+进一步与H+交换得到H[H1/3Ti2/3]O2.但是,He等[15]发现H[H1/3Ti2/3]O2的(HTi2)层中的H+不能和Li+再交换形成(LiTi2)层,H[H1/3Ti2/3]O2平衡时的吸附容量远远小于理论吸附容量.
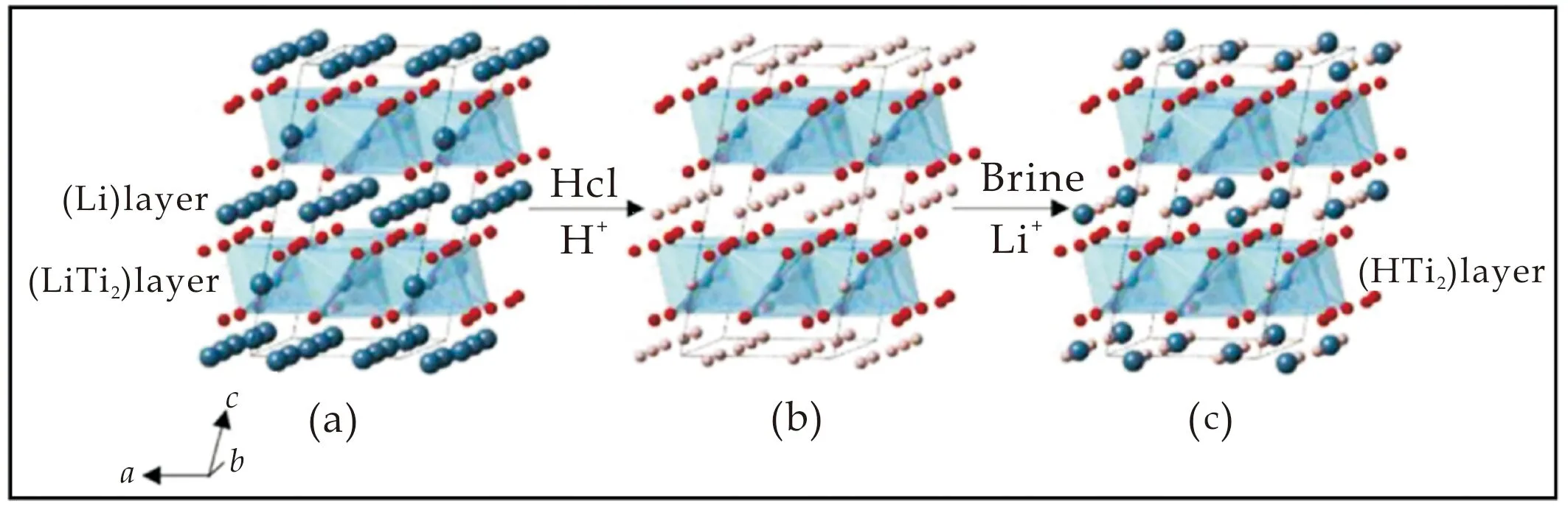
(a)层状Li2TiO3的晶体结构示意图 (b)层状H2TiO3的晶体结构示意图 (c)吸附Li+后的H2TiO3的晶体结构示意图

在酸洗前后和吸附后,Li2TiO3中的Li、Ti、O的环境发生了显著的变化.图13为在不同条件下(酸洗前、酸洗后和吸附后)Li2TiO3的XPS图谱[15].由图13(a)可以看出,Li 1s在酸洗前后和吸附后的三个过程中相对强度发生了由强到无再到弱的显著变化,并且吸附后的Li 1s向高结合能处移动.在Li2TiO3晶体中,Li+是以离子键的方式存在,在酸洗过程中化学键被破坏,H+进入晶体中以静电吸附的方式存在.在吸附过程中,溶液中的Li+与吸附的H+交换,被交换的Li+和被吸附的H+两者在晶体中结合状态相同,属于典型的静电吸附[15].

(a)Li 1s、Ti 3p
由图13(b)和(c)可以看出,Ti 2p3/2、Ti 2p1/2和O 1s相同的变化趋势表明,H2TiO3的化学结构与Li2TiO3的不同,但与吸附锂离子后的H2TiO3的化学结构相同.换句话说,第一次酸处理后,Ti和O的化学环境发生了不可逆的变化.H+(rH+= 0.001 2 nm)的离子半径远远小于Li+(rLi+=0.074 nm)的离子半径,在晶体中H+占据的空间要小于Li+,导致Li+和H+对Ti-O层的影响不同.因此,第一次酸处理后,Ti和O之间的相互作用减弱,Ti-O键延长,导致进一步的结构转变.由图13(d)可以看出,位于3 488 cm-1处为H2TiO3的H+/Li+交换相关的-OH伸缩振动峰,位于3 040 cm-1和1 625 cm-1处为H2TiO3吸附水的-OH基团的伸缩振动和弯曲振动峰.在吸附过程中,通常认为H2TiO3中容易暴露的H层活性强,易与溶液中的Li+发生交换.
锂离子在盐湖卤水中一般以LiCl的形式存在,Shi等[13]研究了H2TiO3锂离子筛在不同浓度的LiCl溶液中的吸附动力学.用伪一级和伪二级动力学模型研究H2TiO3锂离子筛吸附过程.伪二级动力学模型拟合得到的吸附容量更接近平衡时的吸附容量,相关性更高(如图14所示),更适合于H2TiO3锂离子筛吸附过程,属于化学吸附[13].

(a)伪一级动力学拟合图
为了进一步阐明H2TiO3锂离子筛吸附机理,Shi等[13]用Langmuir和Freundlich模型研究H2TiO3锂离子筛吸附过程.Langmuir模型拟合拟合得到的吸附容量更接近于平衡时的吸附容量,相关性更高(如图15所示),更适合于H2TiO3锂离子筛吸附过程,属于单层吸附[13].

(a)Langmuir
4 结论与展望
H2TiO3作为一种新型的锂离子筛,具有饱和吸附容量高、选择性好、循环使用性好、结构稳定、绿色环保等优点,非常适合我国高镁低锂型盐湖卤水中提锂,易获得高品质的锂产品.但是,由于H2TiO3锂离子筛研究起步较晚,还有许多问题需要深入研究.
(1)H2TiO3锂离子筛是由前驱体Li2TiO3经酸洗脱锂后得到的,其晶体结构尚未明确,需要进一步深入研究.He等[15]认为H2TiO3锂离子筛的晶体结构在吸附前后保持不变,并与最初的Li2TiO3的晶体结构有所不同其晶体结构不同于Li2TiO3的晶体结构.Yu等[14]提出了H2TiO3是具有3R1层序的层状双氢氧化物,可以被描述为电中性的金属氢氧化物的叠加[(OH)2OTi2O(OH)2],该结构还需要更多实验验证和深入研究.
(2)目前合成H2TiO3锂离子筛前驱体的方法主要有固相反应法、溶胶-凝胶法和水热法,不同的前驱体制备方法对锂离子筛的性能有着显著的影响.传统的固相反应法制备的Li2TiO3的晶粒尺寸过大和溶胶-凝胶法制备的Li2TiO3中Li+提取难度大,两者得到H2TiO3锂离子筛饱和吸附容量较低,而水热法制备的Li2TiO3晶粒尺寸小、结构稳定、Li+提取率高,得到的H2TiO3锂离子筛饱和吸附容量高.但是,由水热法制备纳米粉体H2TiO3锂离子筛在使用和转移中存在着流损大、流动性差、回收再利用困难,造成动态应用较差等问题,限制其在实际工业中的应用.可以从以下两个途径解决此问题:第一,在传统方法的基础上,研究新型锂离子筛合成技术;第二,将H2TiO3粉体固定在固体载体上,或者与其它具有分离性能的组分结合.
(3)H2TiO3锂离子筛的吸附机理尚未完善.例如,现有的从离子角度解释的离子交换机制、从动力学和键合关系角度解释的化学吸附、从Langmuir模型角度解释的单层吸附等,都只是从某一个角度解释,依然没有一整套全方面的、让人完全信服的提锂过程的机理解释,这需要进一步深入研究.
