博舒替尼抗食管癌细胞的磷酸化蛋白质组学研究
2021-01-09哈依努尔梁旭俊李茂玉邵美英陈主初
哈依努尔,梁旭俊,李茂玉,邵美英,付 莹*,陈 林,陈主初
(1.中南大学湘雅医院肿瘤科国家卫健委蛋白质组学重点实验室抗癌药物国家地方联合工程实验室国家老年医学临床研究中心,中国湖南 长沙 410008;2.新疆医科大学第一附属医院呼吸科,中国新疆乌鲁木齐 830000)
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是最常见的恶性肿瘤之一,发病率位居全球恶性肿瘤第8位,死亡率位居肿瘤相关死因第6位[1]。中国是食管癌高发国家,每年新发病例数约占全球新发病例的50%,是世界上食管癌新发病例数最多的国家[2]。目前早期食管癌以手术治疗为主,但是大部分患者在确诊时已进入中晚期,预后较差,其5年生存率仅为20%左右[3]。因此,寻找有效的分子靶向药物可为食管癌的治疗提供新的思路,具有重要的临床意义。
食管癌的分子靶向治疗已进行多个靶点的Ⅰ/Ⅱ期临床试验[4~6]。其中,非受体酪氨酸激酶Src在多种肿瘤细胞中高度活化或过表达,能持续激活Ras/MEK、PI3K/AKT、JAK/STAT 等下游信号传导通路,促进肿瘤细胞增殖和迁移,抑制其凋亡,是食管癌等肿瘤治疗的一个有效靶点[7]。临床试验证实,针对Src激酶的多种小分子抑制剂在多种肿瘤中取得了良好疗效,而且这些小分子抑制剂除了作用于Src外,一般还有其他有效靶点[8~9]。研究显示,Src/Abl双效抑制剂达沙替尼在肿瘤细胞中除了抑制Src和Bcr-Abl外,还能有效抑制c-KIT、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、表皮生长因子受体(epidermal growth factor receptor,EGFR)等激酶的活化[10]。博舒替尼(bosutinib,SKI-606)是一种新型的双重Src/Abl激酶抑制剂,2012年被美国食品药品监督管理局(Food and Drug Administration,FDA)批准,适用于慢性、加速或急变期慢性粒细胞性白血病(chronic myelocytic leukemia,CML)患者的治疗[11],研究证明它能同时阻止多种肿瘤细胞中Src和Abl激酶的磷酸化,具有高效的抗肿瘤细胞增殖活性[12~15],但是除了Src/Abl外,博舒替尼是否还有其他有效作用靶点尚不清楚。我们先前的研究证实博舒替尼显著抑制人食管癌细胞Eca-109和KYSE450的增殖,促进其凋亡,并且抑制Src、c-Abl及其下游信号通路的激活[16],因此本研究在此基础上采用磷酸化蛋白质组学方法,探究博舒替尼作用于食管癌细胞的潜在作用靶点及作用机制。
1 材料与方法
1.1 细胞株与药物
人食管癌细胞Eca-109购自中国科学院细胞库,用含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基培养;博舒替尼(纯度>99%)购自美国Selleck公司,实验前用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解配制成浓度为20 mmol/L的贮存液,避光保存于-20℃。
1.2 主要试剂与仪器
细胞培养所用RPMI-1640培养基、FBS及iTRAQ标签试剂、Bradford定量试剂盒、蛋白质上样缓冲液购自美国Thermo公司;尿素、硫脲、十二烷基硫酸钠(sodium dodecylsulfate,SDS)、甘氨酸、过硫酸铵、二硫苏糖醇(dithiothreitol,DTT)、TEAB(triethylammonium bicarbonate)和Tris购自美国GE Healthcare公司;蛋白酶抑制剂cocktail和磷酸酶抑制剂购自瑞士Roche公司;DMSO、碳酸氢铵、碘乙酰胺、胰蛋白酶、乙腈(acetonitrile,ACN)、异丙醇、三氟乙酸(trifluoroacetic acid,TFA)和甲酸(formic acid,FA)购自美国Sigma公司。UltiMate 3000 UHPLC、Q-Exactive HF X 质谱仪、High PH RP离心柱、C18色谱柱、Multiskcan FC酶标仪、二氧化碳培养箱均为美国Thermo公司产品;低温高速离心机(Eppendorf 5430R)为德国Eppendorf公司产品;数据分析软件Proteome Discoverer为美国Thermo公司产品。
1.3 主要方法
1.3.1 细胞处理
将对数生长期的Eca-109细胞分为两组,根据博舒替尼抑制食管癌细胞生长的前期实验结果[16],实验组加入终浓度为5 μmol/L的博舒替尼,对照组加入等体积的DMSO,置于CO2培养箱中处理4 h。
1.3.2 蛋白质提取与酶解
收集细胞于1.5 mL离心管,加入预冷的含有蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液,置于冰上5 min;加入终浓度为10 mmol/L的DTT,用超声破碎仪冰浴超声2 min,在4℃条件下25 000g离心15 min;取上清并加入终浓度为10 mmol/L的DTT,56℃水浴1 h,冷却至室温后加入终浓度为55 mmol/L的碘乙酰胺,避光放置45 min,最后在4℃条件下25 000g离心10 min,收集的上清即为总蛋白质。用Bradford方法对收集的蛋白质进行定量,取100 μg蛋白质按胰蛋白酶∶蛋白质=1∶20的比例加入胰酶,涡旋振荡后低速离心1 min,随后37℃水浴2 h,消化后的肽段进行除盐操作,然后将得到的肽段液冷冻抽干。
1.3.3 肽段标记、富集与分离
用0.5 mol/L TEAB溶解肽段样品,加入i-TRAQ标签试剂,室温静置2 h,用C18萃取柱脱盐并抽干;以样品∶TiO2=1∶4称取TiO2,加入1 mL蛋白质上样缓冲液,室温振荡10 min,然后加入抽干的肽段,于37℃条件下1 100 r/min振荡1 h;12 000g离心30 s后保留沉淀,加入1~2 mL上样缓冲液,室温圆盘翻转5 min,12 000g离心30 s后弃上清,然后加入洗涤液洗4次,最后加入洗脱液洗脱,收集上清并抽干。用300 μL 0.1%的TFA复溶抽干的肽段,采用High PH RP小柱进行组分分离,最后合并样品得到6个组分,冷冻抽干。
1.3.4 高效液相色谱分离及质谱检测
将抽干的肽段样品用流动相A(2%ACN,0.1%FA)复溶,20 000g离心10 min后,取上清进样。通过UltiMate 3000 UHPLC进行分离,样品首先进入trap柱富集并除盐,随后与自装C18柱(75 μm内径, 粒径>3 μm 柱料,25 μm 柱长)串联, 以300 nL/min流速通过如下有效梯度:0~5 min,5%流动相B(98%ACN,0.1%FA);5~45 min,流动相B从5%线性升至25%;45~50 min,流动相B从25%升至35%;50~52 min,流动相B从35%升至80%;52~54 min,80%流动相B;54~60 min,5%流动相B。纳升液相分离末端直接连接质谱仪。经液相分离的肽段通过nanoESI源离子化后进入到串联质谱仪Q-Exactive HF X进行DDA(data-dependent acquisition)模式检测。主要参数:离子源电压设置为1.9 kV;一级质谱扫描范围(m/z)为350~1 500,分辨率设置为60 000;二级质谱起始m/z固定为100,分辨率为15 000。二级碎裂的母离子筛选条件:电荷2+到6+,峰强度超过10 000的强度排在前20的母离子。离子碎裂模式为HCD,碎片离子在Orbitrap中进行检测。动态排除时间设定为30 s。AGC设置:一级为3.0E+06,二级为1.0E+05。
1.3.5 磷酸化蛋白质的鉴定与定量
利用Proteome Discoverer 1.4软件将质谱产生的原始图谱文件进行格式转换,并通过Mascot 2.3对质谱数据进行数据库搜索,数据库为人蛋白质序列数据库human UniProt(20356 sequence)。搜索参数设置如下:酶切方式为胰蛋白酶,最大允许两个漏切位点,固定修饰为半胱氨酸烷基化,可变修饰为甲硫氨酸的氧化、蛋白质N端的乙酰化、脱酰胺化以及丝氨酸、苏氨酸和酪氨酸的磷酸化,母离子容忍度为2.0E-05,碎片离子容忍度为0.05 Da。利用Percolator对Mascot搜索的结果进行再处理,以图谱的错误发现率(false discovery rate,FDR)≤0.05过滤得到可信的肽段。利用Proteome Discoverer整合的phosphoRS对鉴定到的磷酸化肽段进行磷酸化位点打分,以phosphoRS probability≥0.75[17]过滤得到可信的磷酸化位点。
1.3.6 磷酸化蛋白质组结果的生物信息学分析
用clusterProfile软件包[18]对差异磷酸化蛋白质进行GO(Gene Ontology)富集和KEGG(Kyoto Encyclopedia of Genes and Genomes)信号通路富集。在蛋白激酶的活性预测中,用KinSwingR软件包[19]从PhosphoSitePlus数据库[20]得到已知的355种蛋白激酶的磷酸化位点周围的氨基酸残基位置权重矩阵,之后使用位置权重矩阵在差异磷酸化蛋白质组数据中搜索能够显著匹配的磷酸化肽段,并根据与特定蛋白激酶的位置权重矩阵相匹配的磷酸化肽段的磷酸化升高或降低来定义蛋白激酶的KS score(KinSwingR Z-score),通过KS score预测蛋白激酶的活性。
在绘制博舒替尼作用的蛋白质网络中,首先,将差异磷酸化蛋白质和KinSwingR预测的活性显著变化的蛋白激酶作为输入因子,从STRING数据库得到这些蛋白质的相互作用网络[21];其次,使用Cytoscape软件中的ClusterOne插件识别蛋白质网络中的模块[22];最后,使用BiNGO插件对模块涉及的生物过程进行富集[23],用Cytoscape 3.2.1软件绘制相互作用网络图。
2 结果
2.1 磷酸化蛋白质组鉴定
采用iTRAQ定量磷酸化蛋白质组学方法分别对博舒替尼和DMSO处理的人食管癌细胞Eca-109中的磷酸化蛋白质组进行鉴定,结果如表1:在2 741个蛋白质上共鉴定到11 335条磷酸化肽段和 7 940个磷酸化位点,其中1 272个蛋白质只鉴定到1个磷酸化位点,534个蛋白质鉴定到两个磷酸化位点,305个蛋白质鉴定到6个及以上磷酸化位点(图1A);在鉴定到的7 940个磷酸化位点中,85.45%为丝氨酸(S),13.64%为苏氨酸(T),0.91%为酪氨酸(Y)(图1B)。
2.2 差异磷酸化蛋白质的定量分析
以博舒替尼处理的人食管癌细胞作为实验组,DMSO处理组作为对照组,取两组数据的比值进行差异磷酸化蛋白质的定量分析。差异磷酸化肽段的筛选标准为差异倍数(fold change)≥1.5或≤0.667,同时P-value≤0.05,结果共筛选到182个差异磷酸化肽段,其中上调55个,下调127个(图2)。

表1 磷酸化蛋白质组的鉴定结果统计Table 1 The statistics of phosphorylated proteome identification

图1 蛋白质磷酸化位点的鉴定结果(A)蛋白质的磷酸化位点数分布;(B)磷酸化修饰的氨基酸残基分布,S代表丝氨酸,T代表苏氨酸,Y代表酪氨酸。Fig.1 Identification results of protein phosphorylation sites(A)Distribution of phosphorylation sites on proteins;(B)Distribution of phosphorylated amino acid residues.S represents serine,T represents threonine,and Y represents tyrosine.

图2 磷酸化肽段定量的火山图紫色圆点代表下调的磷酸化肽段,橙色圆点代表上调的磷酸化肽段,灰色圆点代表无明显变化的磷酸化肽段。Fig.2 Volcano plot showing quantification of phosphorylated peptide segmentsPurple dots represent down-regulated phosphorylated peptide segments,orange dots represent up-regulated phosphorylated peptide segments,and gray dots represent phosphorylated peptide segments with no significant change.
2.3 差异磷酸化蛋白质的功能富集分析
采用clusterProfile软件包对差异磷酸化蛋白质涉及的生物过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)进行GO富集分析,结果显示:这些差异磷酸化蛋白质主要位于细胞连接、胞外空间和肌动蛋白骨架等位置,主要参与了mRNA代谢、细胞骨架组织、细胞内其他有机化合物的分解代谢等生物过程;其分子功能主要是结合RNA、细胞骨架蛋白、细胞黏附分子和锌离子转运体等(图3)。

图3 差异磷酸化蛋白质的GO富集分析(前15位)(A)差异磷酸化蛋白质参与的生物过程富集;(B)差异磷酸化蛋白质的生物功能富集;(C)差异磷酸化蛋白质的细胞定位富集。在每个富集结果中,条形的大小代表富集的基因数量,颜色代表显著性水平,蓝色表示显著性较低,红色表示显著性较高。Fig.3 GO enrichment analysis of the differentially phosphorylated proteins(top 15)(A)Biological processes involving differentially phosphorylated proteins;(B)Molecular functions of differentially phosphorylated proteins;(C)Cellular components of differentially phosphorylated proteins.For each term,the number of enriched genes is indicated by the bar size,while the P-value is represented by the color.Blue indicates a high P-value while red represents a low P-value.
2.4 博舒替尼对细胞增殖、凋亡和迁移相关蛋白质磷酸化水平的影响
对参与细胞增殖、凋亡和迁移相关过程的差异磷酸化蛋白质在博舒替尼处理组和对照组中的磷酸化水平进行比较分析,结果显示:在增殖相关的蛋白质中,博舒替尼能够显著抑制核仁蛋白NOP2、SFRS蛋白激酶 2(SFRS protein kinase 2,SRPK2)等的磷酸化,促进中心体蛋白131(centrosomal protein 131,CEP131)、JUN、核糖体蛋白 S6(ribosomal protein S6,RPS6)等的磷酸化;在凋亡相关的蛋白质中,博舒替尼显著抑制SRPK2、CD44等的磷酸化,促进JUN、RPS6的磷酸化;在迁移相关的蛋白质中,博舒替尼显著抑制CD44的磷酸化,促进丝切蛋白1(cofilin 1,CFL1)等的磷酸化(图 4)。
2.5 差异磷酸化蛋白质的信号通路富集分析
对差异磷酸化蛋白质参与的信号通路进行KEGG富集分析,结果如表2所示:富集的信号通路主要涉及转录、翻译、核糖体相关的信号通路、细胞凋亡相关的信号通路和锌离子转运信号通路。这一结果与生物过程的富集相似,且大部分核糖体相关蛋白质的磷酸化水平显著下调,提示博舒替尼可能通过影响转录和翻译过程进而发挥抑制肿瘤作用。

图4 博舒替尼对细胞功能相关蛋白质磷酸化水平的影响(A)博舒替尼对细胞增殖相关蛋白质磷酸化水平的影响;(B)博舒替尼对细胞凋亡相关蛋白质磷酸化水平的影响;(C)博舒替尼对细胞迁移相关蛋白质磷酸化水平的影响。图中颜色表示每个样本中蛋白质磷酸化水平的程度,红色表示磷酸化水平较高,蓝色表示磷酸化水平较低。Fig.4 Effect of bosutinib on phosphorylation levels of cell function-associated proteins(A)Effect of bosutinib on phosphorylation levels of cell proliferation-associated proteins;(B)Effect of bosutinib on phosphorylation levels of apoptosis-related proteins;(C)Effect of bosutinib on phosphorylation levels of cell migration-related proteins.The color indicates the level of protein phosphorylation in each sample,with red indicating higher levels of phosphorylation and blue indicating lower levels of phosphorylation.
2.6 博舒替尼对蛋白激酶活性影响的预测
采用KinSwingR软件包、差异磷酸化蛋白质数据以及已知的蛋白激酶和底物的关系对蛋白激酶的活性进行预测分析,结果如图5所示:cAMP依赖型蛋白激酶A催化亚基α(cAMP-dependent protein kinase catalytic subunit alpha,PRKACA)、极光激酶B(aurora kinase B,AURKB)等激酶的活性显著降低,而Polo样激酶1(Polo-like kinase 1,PLK1)的活性显著升高,提示这些激酶可能是博舒替尼在食管癌中的潜在作用靶点。

表2 差异磷酸化肽段的KEGG富集结果(前15位)Table 2 KEGG enrichment of differentially phosphorylated peptides(top 15)
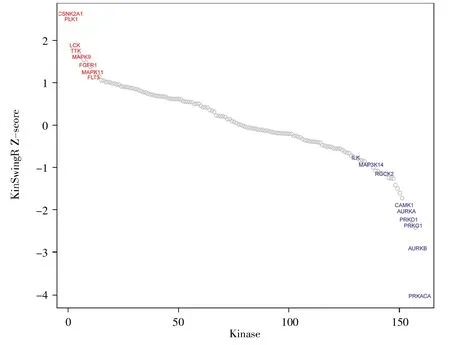
图5 KinSwingR预测蛋白激酶的活性红色圆点为活性升高的蛋白激酶,蓝色圆点代表活性降低的蛋白激酶(P<0.05)。Fig.5 The kinase activity predicted by KinSwingRRed dots are protein kinases with increased activity,and blue dots are protein kinases with decreased activity(P<0.05).
2.7 博舒替尼作用的蛋白质网络分析
为全面了解博舒替尼的作用靶点,我们构建了博舒替尼作用的蛋白质网络,结果如图6所示。博舒替尼作用的蛋白质网络大致可以分为4个功能模块,主要涉及细胞周期和分裂、细胞骨架组织、RNA转录和代谢、细胞凋亡和程序性死亡等生物过程,每个生物过程中包含的蛋白质列于表3。这些模块涉及的生物过程既有区别又相互联系,展示了博舒替尼可能的分子机制整体图景,其中GAPDH、RPS6和JUN在网络中有最高的连接度,而RPS6和JUN是磷酸化差异较显著的蛋白质,同时也与肿瘤细胞增殖和凋亡密切相关。

图6 博舒替尼作用的蛋白质网络根据网络中蛋白质涉及的生物学过程可以把该网络分为4个模块,分别用红色、紫色、黄色和绿色的底色表示,每个模块中包含的生物学过程列于旁侧。红色节点代表磷酸化水平上调的蛋白质,蓝色节点代表磷酸化水平下调的蛋白质,绿色节点代表KinSwingR预测的活性显著变化的蛋白激酶,灰色节点是STRING数据库中与上述蛋白质存在相互作用的蛋白质。其中,连接度最高的3个蛋白质GAPDH、RPS6和JUN用深红色突出表示。Fig.6 Protein network of bosutinib actionThe network can be divided into four modules based on the biological processes involved in the proteins,indicated by red,purple,yellow,and green background colors.The biological processes in each module listed beside it.Red nodes represent proteins with up-regulated phosphorylation levels,blue nodes represent proteins with down-regulated phosphorylation levels,green nodes represent protein kinases with significant changes in activity as predicted by KinSwingR,and gray nodes are proteins that have interactions with the above proteins in the STRING database.The three most highly connected proteins,GAPDH,RPS6,and JUN,are highlighted in dark red.

表3 博舒替尼作用的蛋白质网络中每个模块涉及的生物学过程及包含的蛋白质Table 3 The related biological processes and proteins in each module of protein network of bosutinib action
3 讨论
磷酸化是蛋白质翻译后修饰的主要形式之一,参与细胞增殖、分化、凋亡、信号传导、肿瘤发生等各种生理病理过程,而小分子激酶抑制剂一般是通过调节激酶的磷酸化调控相应的信号传导通路来发挥作用,因此通过蛋白质磷酸化寻找潜在的靶标及作用机制是小分子激酶抑制剂研究的重要策略之一。博舒替尼作为高选择性小分子Src/Abl双靶抑制剂,在前列腺癌中通过抑制AMP活化蛋白激酶(AMP-activated protein kinase,MAPK)、AKT的磷酸化及骨形态发生蛋白2(bone morphogeneticprotein 2,BMP2)、转化生长因子-β (transforming growth factor-β,TGF-β)的表达来抑制前列腺癌细胞的增殖、迁移和侵袭[24];在乳腺癌中通过促进细胞之间的黏附和β-连环蛋白(β-catenin)的膜转运,抑制AKT、黏着斑激酶(focal adhesion kinase,FAK)、富含脯氨酸的酪氨酸激酶2(prolinerich tyrosine kinase 2,Pyk2)的磷酸化,从而抑制乳腺癌细胞的迁移和侵袭[25]。我们先前的研究证明博舒替尼可显著抑制食管癌细胞的增殖,促进其凋亡[16],但其具体作用机制及靶点并不清楚。本研究对博舒替尼作用于食管癌细胞后磷酸化蛋白质组的变化进行检测和分析,发现除了抑制Src、Abl外,博舒替尼还显著影响 JUN、RPS6、CD44、SRPK2等蛋白质的磷酸化(图4),而这些差异磷酸化蛋白质主要参与mRNA代谢、细胞骨架组织、锌离子转运等重要生物学过程(图3),其中JUN、RPS6被鉴定到有多个位点的磷酸化发生变化。大量研究证明,JUN的磷酸化在肿瘤细胞的增殖和凋亡过程中扮演了重要的角色[26~27],一方面JUN的磷酸化影响了其DNA结合能力,另一方面影响了其转录激活能力[28];同时也有研究证明,JUN的磷酸化与Abl的激酶活性密切相关,它们之间存在互相激活的循环[29]。RPS6作为核糖体蛋白在正常生理过程中发挥重要作用,同时作为哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路下游重要分子,参与肿瘤细胞的增殖和凋亡过程[30]。在本研究中,博舒替尼作用引起食管癌细胞RPS6蛋白的S241、S244、S246位点的磷酸化水平发生显著变化,因此其可能是通过mTOR信号通路发挥作用,而且在博舒替尼作用的蛋白质网络中,JUN和RPS6也有较高的连接度(图6),这些结果都提示JUN和RPS6可能是博舒替尼的潜在作用靶点。
蛋白激酶的活性预测结果显示,PRKACA、PLK1、钙/钙调蛋白依赖性蛋白激酶1(calcium/calmodulin-dependent protein kinase type 1,CAMK1)、AURKA和AURKB等蛋白激酶的活性发生显著变化(图5)。文献报道,PRKACA能介导STAT3磷酸化,激活果蝇zeste基因增强子人类同源物2(enhancer of zeste homolog 2,EZH2)[31];PLK1可促进细胞的有丝分裂[32],这些激酶在肿瘤进展中都发挥着重要作用,由此推测这些激酶的活性改变可能是博舒替尼抑制食管癌细胞增殖的重要机制之一。
虽然博舒替尼在CML中显示出良好的治疗效果,但其在实体瘤中的应用及作用机制有待进一步拓展及研究。本文从磷酸化蛋白质组层面揭示了除Src/Abl外博舒替尼在食管癌中潜在的作用靶点及作用机制,为其在食管癌中的应用奠定了理论基础,同时也为其在其他肿瘤中的研究提供了一定的科学依据。
