肿瘤发生对小鼠胸腺发育及T细胞生成的影响
2021-01-09周祖平蒲仕明
刘 霖,汤 婧,邢 兵,李 鑫,陈 莹,周祖平,蒲仕明*
(1.广西师范大学a.生命科学学院;b.生物医学研究中心,中国广西 桂林 541004;2.广西高校干细胞与医药生物技术重点实验室,中国广西 桂林 541004)
在哺乳动物中,胸腺是T细胞发育、分化、成熟并向外周输出T细胞的场所。其能通过分泌各种胸腺激素,调节机体的免疫功能[1]。胸腺作为T细胞发育、分化的重要器官,在接收来自骨髓的原胸腺细胞(prothymocyte)后,相继分化为前胸腺细胞(prethymocyte)、CD4-CD8-T 细胞、CD4+CD8+T细胞,最后分化为成熟的细胞毒性T细胞(cytotoxic T lymphocyte,CTL;CD4-CD8+T细胞)或辅助性T细胞(T helper cell,Th cell;CD4+CD8-T 细胞)[2]。
成熟的T淋巴细胞负责细胞免疫,其直接消灭侵入机体的病原微生物,监视和清除体内出现的癌变细胞、衰老死亡的细胞等,具有促进免疫监视和免疫自稳的作用,因此胸腺在抗衰老、抗感染、抗肿瘤及自身免疫性疾病中起着重要作用[3]。一直以来,肿瘤对胸腺发育及T细胞功能影响的研究受到人们的关注。小鼠胶质瘤模型的研究表明,模型小鼠的胸腺质量减轻,组织学结构发生改变[4]。另有研究表明,小鼠纤维肉瘤在10 d内引起胸腺萎缩,这种胸腺萎缩的特征是细胞数量减少,成熟胸腺细胞百分比增加,组织学上胸腺皮质减小,未成熟胸腺细胞中增殖细胞百分比增加[5]。Sun等[6]提出,CD8+T细胞不能有效地独立消除H22肿瘤细胞,而CD4+T细胞被肿瘤抑制,这样机体只会增强胸腺中T细胞的分化和成熟,并将其释放到实体肿瘤中以增强抗肿瘤免疫能力,引起恶性循环,最终导致胸腺萎缩。研究表明,BALB/c小鼠在营养不良或感染的情况下,胸腺组织发生明显的萎缩[7];肿瘤的发生与免疫细胞生成的内部紊乱有关联[8],特别是髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)——一类大量积聚在肿瘤模型动物或癌症病人的骨髓、血液、脾脏以及癌组织中的未成熟髓系抑制细胞[9~10]。因此,本研究构建小鼠肺癌模型,采用HE染色分析小鼠胸腺形态学变化,并利用流式细胞术分析小鼠胸腺、外周血中T细胞亚群的丰度及外周血中MDSCs的含量,旨在探索肿瘤发生对胸腺发育的影响,为明确肿瘤调控机体免疫系统提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
实验所使用的C57BL/6小鼠(体重相近的8周龄雄鼠)购买于湖南斯莱克景达实验动物有限公司,饲养于广西师范大学实验动物中心。小鼠Lewis肺癌(Lewis lung carcinoma,LLC)细胞购买于中国科学院细胞库,产品号:KCB20781YJ。
1.1.2 实验试剂
Anti-mouse CD3-APC、anti-mouse CD4-PE、anti-mouse CD8-PE-Cy7、anti-mouse Gr-1-PE、anti-mouse CD11b-PE-cy7、anti-mouse CD3e functional grade purified、anti-mouse CD28 functional grade purified以及CFSE proliferation dye源自e-Bioscience公司(美国),胎牛血清和DMEM Basic(1×)培养基购自 Gibco公司(美国),20×磷酸缓冲盐溶液(phosphate buffer saline,PBS)、胶原酶Ⅱ、红细胞裂解液、苏木素染液、石蜡和伊红染液购自北京索莱宝科技有限公司。
1.1.3 实验仪器
流式细胞分选/分析仪(Becton Dickinson公司,美国);普通光学显微镜、荧光倒置显微镜(Nikon公司,日本);冷冻离心机、超纯净去离子水组合系统(Thermo Fisher Scientific公司,美国);石蜡切片机和石蜡包埋仪(上海徕卡显微系统有限公司)。
1.2 方法
1.2.1 小鼠肺癌模型的构建
培养LLC细胞生长至培养瓶底面积的80%左右,用胰蛋白酶将其消化成单个悬浮细胞,经PBS洗涤(300g)两次后稀释成密度为2.5×106mL-1的细胞悬液。将0.2 mL细胞悬液注射至小鼠左腋皮下(5×105个/只),对照组注射等量的PBS。小鼠饲养4周,选择肿瘤直径不小于1.5 cm的荷瘤小鼠用于后续实验。
1.2.2 小鼠胸腺指数的测定
称量小鼠体重(g)后将其颈椎脱臼处死,置于75%乙醇中5~10 s。用剪刀和镊子打开小鼠胸腔,取出胸腺放于PBS中清洗两次,随后将胸腺置于滤纸上吸干水分,并立即用电子天平进行称重(mg)。胸腺指数(mg/g)=胸腺质量(mg)/体重(g)。
1.2.3 小鼠胸腺石蜡切片的制作和HE染色
处死小鼠,取出胸腺置于波氏固定液中进行固定过夜。用流水冲洗胸腺组织过夜至表面固定液颜色(黄色)基本褪去。将固定好的胸腺依次置于梯度浓度的乙醇溶液(50%、60%、70%、80%、90%、95%、100%)中,各脱水20 min;再依次置于乙醇-二甲苯等体积混合液、二甲苯Ⅰ、二甲苯Ⅱ中,各渗透10 min;将完成渗透的胸腺组织置于60℃石蜡中渗透石蜡2~3 h;随后进行石蜡包埋、切片(蜡片厚度为 4~5 μm)、展片(38 ℃液面)、烤片(58 ℃处理4 h后37℃过夜)。将上述切片材料依次置于二甲苯Ⅰ、二甲苯Ⅱ、乙醇-二甲苯等体积混合液中,各脱蜡10 min;再置于逆浓度梯度乙醇(100%、95%、90%、80%、70%、60%、50%)中,各浸泡3 min;室温条件下用苏木素染液染色10~15 min,分化液浸洗3~5 s,再用伊红染液染色5 min;随后将切片依次置于95%乙醇、100%乙醇、乙醇-二甲苯等体积混合液中,各脱水2 min,紧接着二甲苯透明2 min,最后封片用于镜检。
1.2.4 小鼠胸腺细胞的制备及流式细胞术分析
取小鼠胸腺置于PBS中,经剪碎后用0.1%胶原酶Ⅱ于37℃消化15 min,随后用PBS洗涤两次(500g,下同)。过滤后用PBS重悬细胞,进行细胞计数。取约1.0×107个细胞于4℃避光条件下孵育anti-mouse CD4和anti-mouse CD8荧光偶联抗体30 min,经PBS清洗、重悬后进行流式细胞术分析。
1.2.5 骨髓单细胞悬液的制备及MDSCs的分选
颈椎脱臼处死小鼠后将其浸泡于75%乙醇中5~10 s,分离出小鼠胫骨与股骨并将其转移至超净工作台,用75%的乙醇浸泡胫骨与股骨15 s后,用无菌PBS浸洗两次。剪开胫骨与股骨两端,用吸有DMEM完全培养基的1 mL注射器将骨髓组织吹出。用移液器反复吹培养基至形成骨髓单细胞悬液。离心弃上清,对骨髓细胞用红细胞裂解液裂解2 min,随后用PBS清洗两次。将所得骨髓细胞用anti-mouse CD11b和anti-mouse Gr-1荧光偶联抗体孵育30 min,经PBS清洗、重悬后用于流式细胞术分选MDSCs。
1.2.6 小鼠外周血有核细胞的制备及流式细胞术分析
对小鼠进行眼眶取血,将血液滴入盛有3 mL 0.5%肝素钠溶液的离心管中,并迅速混合。离心弃上清后,用PBS洗涤两次。加入红细胞裂解液裂解5 min后,用PBS清洗两次。将所得外周血有核细胞分为两组,一组于4℃避光条件下孵育anti-mouse CD3、anti-mouse CD4 和 anti-mouse CD8荧光偶联抗体30 min,用于分析T细胞的丰度;另一组在同样条件下孵育anti-mouse CD11b和anti-mouse Gr-1荧光偶联抗体,用于分析MDSCs的丰度。
1.2.7 非特异性T细胞增殖抑制
将羟基荧光素二醋酸盐琥珀酰亚胺脂(5,6-carboxyfluorescein diacetate succinimide ester,CFSE)工作液加入到胸腺单细胞悬液并快速混匀(终浓度为5 μmol/L),室温下避光孵育10 min,用冰冷的DMEM完全培养基清洗细胞3次后进行细胞计数。将上述经CFSE染色的胸腺细胞(4×105个)接种于96孔板中,随后分别向每孔加入分选获取的肿瘤小鼠来源的MDSCs或正常小鼠来源的MDSCs(2×105个)共培养(胸腺细胞∶MDSCs=2∶1),空白组(Medium)加入等量的PBS(胸腺细胞∶MDSCs=2∶0)。此外,每孔加入 anti-mouse CD3e functional grade purified、anti-mouse CD28 functional grade purified抗体(终质量浓度为0.5 μg/mL)刺激T细胞增殖。混合均匀后在CO2培养箱中避光培养。72 h后收集细胞,经PBS清洗和重悬后分析CFSE的荧光强度,以确定T细胞的增殖情况。
1.2.8 数据处理
流式细胞术所得数据由FlowJo7流式分析软件分析;柱形图生成与数据统计采用GraphPad Prism软件,并进行独立样本t-test分析。数据结果以平均值±标准差(±s)表示,P<0.05表示统计学上有显著性差异(*P<0.05,**P<0.01,***P<0.001)。
2 结果
2.1 肿瘤状态下小鼠胸腺发生萎缩
利用LLC细胞构建小鼠肺癌模型(图1A),分别取出荷瘤小鼠(Tumor)与对照组小鼠(Normal)的胸腺称重,获取小鼠胸腺质量,并计算其胸腺指数。结果表明,与正常小鼠的胸腺相比,肿瘤状态下小鼠胸腺的体积和质量均明显减小(图1B,C),胸腺指数也显著降低(图1D),提示肿瘤发生中胸腺发育受阻,胸腺器官萎缩。
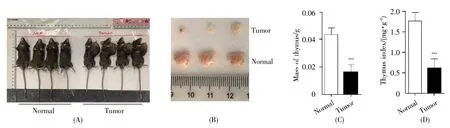
图1 小鼠胸腺质量及指数分析(A)小鼠肺癌模型图;(B)小鼠胸腺对比图;(C)小鼠胸腺质量分析;(D)小鼠胸腺指数分析。Fig.1 Analysis of mouse thymus mass and index(A)The mouse model of lung cancer;(B)Comparison of thymus samples;(C)Analysis of thymus mass of mice;(D)Analysis of thymus index of mice.
2.2 肿瘤发生中小鼠胸腺皮/髓质比下降
为分析肿瘤状态下小鼠胸腺的发育情况,分别对正常小鼠和荷瘤小鼠的胸腺进行病理切片分析(图2)。结果表明,正常小鼠胸腺皮质较厚,细胞排列紧密;荷瘤小鼠胸腺皮质变薄,细胞排列稀疏。此外,正常小鼠胸腺的皮质比例高于荷瘤小鼠胸腺的皮质比例。以上信息提示,肿瘤发生中未成熟T细胞生成可能受阻。

图2 正常小鼠和荷瘤小鼠胸腺组织的形态学比较1:小鼠胸腺的皮质区;2:小鼠胸腺的髓质区。Fig.2 Morphological comparison of thymus tissues in normal and tumor-bearing mice1:The cortical region of the mouse thymus;2:Medullary region.
2.3 肿瘤状态下胸腺T细胞亚群显著下降
为分析肿瘤发生中胸腺T细胞发育的变化,对正常小鼠和荷瘤小鼠的胸腺细胞进行流式细胞术分析(图3)。结果显示:与对照组相比,荷瘤小鼠胸腺中未成熟CD4+CD8+T细胞的丰度明显降低(Normal vs.Tumor:77.50%±1.761%vs.68.67%±2.136%)(图3C);成熟的CD4-CD8+T细胞(Normal vs.Tumor:2.09%±0.112%vs.4.25%±0.219%)和CD4+CD8-T细胞(Normal vs.Tumor:14.23%±1.497%vs.20.97%±1.481%)的丰度均显著升高(图 3D,E)。为充分讨论胸腺在肿瘤发生中的变化规律,本研究对胸腺分离的单个细胞进行了计数(图3F),计算了胸腺中各T细胞亚群的绝对数量(胸腺单细胞数×细胞丰度)。结果表明,胸腺中未成熟的CD4-CD8-T 细胞[Normal vs.Tumor:(39.51±3.702)×105vs.(8.99±2.446)×105]、CD4+CD8+T 细胞[Normal vs.Tumor:(60.01±3.568)×106vs.(12.16±4.012)×106]和成熟的CD4-CD8+T细胞[Normal vs.Tumor:(1.63±0.164)×106vs.(0.69±0.178)×106]、CD4+CD8-T 细胞[Normal vs.Tumor:(13.51±1.271)×106vs.(3.19±0.820)×106]的绝对数量在肿瘤状态下均明显减少(图3G~J),这提示肿瘤发生中胸腺产生的成熟T细胞(CD4+CD8-T细胞和CD4-CD8+T细胞)、未成熟T细胞的绝对数量均显著下降。上述结果揭示,肿瘤发生导致胸腺发育异常,T细胞分化与增殖受阻。
2.4 肿瘤发生中外周血T细胞含量明显下降
为评估肿瘤状态下小鼠的免疫功能,本研究检测了外周血有核细胞中T细胞的含量,结果如图4。肿瘤状态下CD4+T细胞(4.59%±0.118%)和CD8+T细胞(3.69%±0.402%)的含量较正常小鼠CD4+T细胞(17.85%±0.988%)和 CD8+T细胞(12.94%±0.694%)的含量显著降低,提示肿瘤发生中小鼠细胞免疫功能下降。
2.5 肿瘤发生中髓源性抑制细胞具有更强的免疫抑制作用
肿瘤发生中,MDSCs抑制T细胞的增殖与活化。为阐明肿瘤发生中胸腺萎缩和T细胞数量下降潜在的原因,本研究分析了小鼠外周血中MDSCs的产生情况和MDSCs在肿瘤状态下的免疫抑制作用。结果显示,在肿瘤状态下,小鼠外周血中MDSCs比例显著增加(Normal vs.Tumor:8.15%±0.646%vs.72.23%±1.789%)(图 5A,C)。在非特异性免疫抑制实验中,荷瘤小鼠和正常小鼠骨髓来源的MDSCs与胸腺细胞1∶2共培养时,T细胞的增殖指数分别为7.61%±0.871%和11.50%±0.608%,空白组中T细胞的增殖指数为27.34%±2.006%(图5B,D)。以上数据说明荷瘤小鼠中产生了更多的MDSCs,且肿瘤来源的MDSCs具有更强的免疫抑制能力。上述结果揭示,肿瘤进程中产生了更多具有更强免疫抑制能力的MDSCs,其严重抑制T细胞的增殖与活化,可能是胸腺萎缩以及T细胞发育受阻的重要原因。

图3 小鼠胸腺T细胞丰度及绝对细胞数量分析(A)小鼠胸腺代表性流式细胞术分析图;(B~E)小鼠胸腺CD4-CD8-、CD4+CD8+、CD8+、CD4+T细胞的丰度分析;(F)小鼠胸腺细胞的计数;(G~J)小鼠胸腺 CD4-CD8-、CD4+CD8+、CD8+、CD4+T 细胞的绝对数量。Fig.3 Abundance and absolute cell number of mouse thymus T cells(A)Representative flow cytometric analysis of mouse thymus;(B~E)Abundance analysis of CD4-CD8-,CD4+CD8+,CD8+,and CD4+T cells in mouse thymus;(F)Counting number of mouse thymus cells;(G~J)Absolute number of CD4-CD8-,CD4+CD8+,CD8+and CD4+T cells in mouse thymus.
3 讨论
在哺乳动物中,随着年龄的增长,胸腺组织会发生增龄性萎缩,这属于生理性萎缩。不论是生理性萎缩还是病理性萎缩,必然会对机体的免疫功能产生直接的影响。Sizova等[11]研究发现,恶性黑色素瘤细胞能潜藏在萎缩的胸腺中而免于抗癌药物的杀伤,而且萎缩的胸腺还能为肿瘤的复发和转移提供恶性储备。长期以来,衰老与萎缩胸腺的功能回复之间的关系备受关注,然而,人们对肿瘤状态下胸腺T细胞的发育机制知之甚少。因此,文中以LLC细胞诱导的小鼠肺癌模型为研究对象,对肿瘤状态下胸腺形态及其T细胞的丰度变化进行了分析,检测了外周血中部分终端分化的免疫细胞含量,并且还检测了MDSCs对T细胞的免疫抑制作用,旨在诠释肿瘤影响下胸腺T细胞的发育及肿瘤状态下机体免疫系统的变化规律。
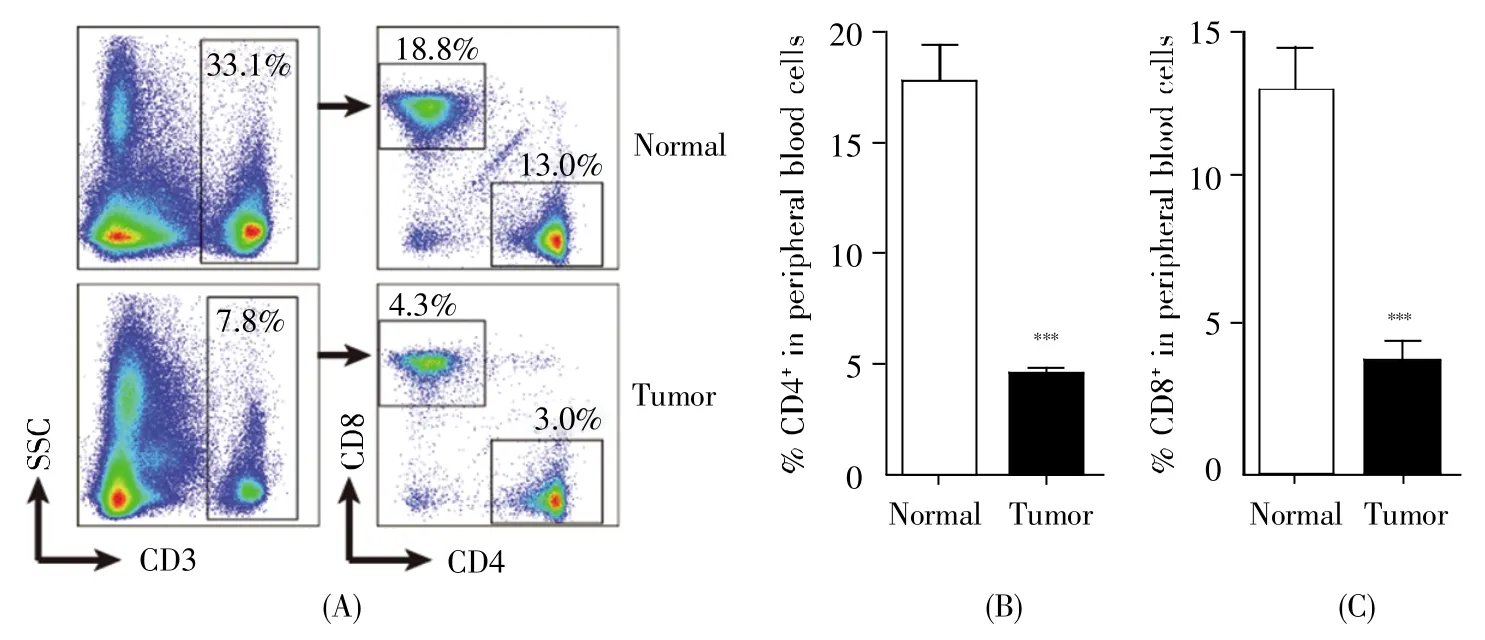
图4 小鼠外周血T淋巴细胞的丰度分析(A)小鼠外周血T细胞代表性流式细胞术分析图;(B)小鼠外周血CD4+T细胞丰度的统计分析;(C)小鼠外周血CD8+T细胞丰度的统计分析。Fig.4 T lymphocyte abundance analysis in mouse peripheral blood(A)Representative flow cytometry analysis of mouse peripheral blood T cells;(B)Statistical analysis of CD4+T cell abundance in peripheral blood of mice;(C)Statistical analysis of CD8+T cell abundance in peripheral blood of mice.

图5 MDSCs丰度及其免疫抑制分析(A)小鼠外周血MDSCs代表性流式细胞术散点图;(B)CFSE荧光衰减的流式细胞术分析;(C)小鼠外周血MDSCs丰度的统计分析;(D)MDSCs免疫抑制的统计分析。Fig.5 Abundance and immunosuppressive analysis of MDSCs(A)Representative flow cytometry scatter plots of MDSCs in mouse peripheral blood;(B)Flow cytometry analysis of CFSE fluorescence decay;(C)Statistical analysis of MDSC abundance in peripheral blood of mice;(D)Statistical analysis of immunosuppression of MDSCs.
本研究发现,肿瘤发生会导致胸腺萎缩(图1),其产生的T细胞发育异常,CD4+和CD8+T细胞在胸腺中的含量异常增加(图3D,E),这可能是胸腺中皮/髓质比在荷瘤小鼠中下降造成的(图2)。既往的研究表明,T细胞未成熟阶段在胸腺皮质内分化,而CD4+CD8-或CD4-CD8+T细胞在胸腺髓质中成熟[12]。尽管肿瘤状态下成熟T细胞的丰度显著增加,但是胸腺中总的细胞数量是减少的(图3F),继而向外周输出的T细胞减少(图4);另外,上游CD4-CD8-、CD4+CD8+T细胞数量下降显著(图3G,H),是导致胸腺、外周血中CD4+和CD8+T细胞减少的直接因素。肿瘤发生中,髓系细胞成熟受阻,致使未成熟髓系细胞(髓源性抑制细胞)积累。研究显示,积累的MDSCs对T细胞的活化与增殖有显著的抑制作用,是肿瘤发展和逃逸的关键[13~14]。本研究在荷瘤小鼠中检测出大量的MDSCs(图5C),这些积累的MDSCs可能是导致胸腺萎缩的主要原因。胸腺中T细胞减少的另一个主要原因可能是骨髓向胸腺输入的原胸腺细胞下降。课题组前期的研究表明,肿瘤发生中,骨髓共同淋巴祖细胞(common lymphoid progenitors,CLPs)的生成下降[15]。与之相对应,髓系干/祖细胞偏向髓系分化和增殖,致使MDSCs积累,从而抑制T细胞增殖与活化,促进肿瘤发展与逃逸[16]。
综上所述,在肿瘤状态下,胸腺发生明显萎缩,胸腺指数下降,胸腺皮/髓质比下降,T细胞生成能力显著减弱,其中未成熟的T细胞数量下降尤为显著;同时,外周血中T细胞含量显著下降,MDSCs显著增加,且肿瘤条件下MDSCs对T细胞增殖具有显著的抑制能力。这些结果揭示,在LLC细胞构建的肿瘤模型中,造血干/祖细胞偏向髓系细胞分化,并且髓系细胞具有更强的免疫抑制作用,抑制T细胞的增殖与活化,这可能是导致胸腺萎缩、T细胞增殖和活化受阻的主要原因。
