无鱼粉无鱼油饲料喂养下大黄鱼幼鱼个体间生长及相关基因表达差异
2021-01-07刘灵婕林晓煜王秋荣王志勇
刘灵婕,林晓煜,王秋荣,叶 坤,王志勇
(1.集美大学水产学院,福建 厦门 361021;2.农业农村部东海海水健康养殖重点实验室,福建 厦门 361021)
0 引言
鱼粉因其蛋白质含量高,氨基酸配比较为均衡,且具适口性好、易于消化吸收等优点,一直以来是鱼类饲料中的优质蛋白原料;鱼油则因富含其他油脂所缺乏的高度不饱和脂肪酸(HUFA),是海水养殖鱼类摄入必需脂肪酸的重要来源。二者在水产养殖产业发展中扮演着重要角色。近年来,随着水产养殖业的迅速发展,传统海水鱼类饲料中高比例鱼油和鱼粉的添加量使得饲料成本大幅提升,直接导致了养殖经济效益的缩减。为了应对鱼粉、鱼油短缺局面以及节约饲料成本,摆脱水产饲料对鱼油、鱼粉的过度依赖,国内外营养学者进行了大量有关鱼类饲料中鱼油鱼粉替代的研究[1-6]。
大黄鱼(Larimichthyscrocea)是我国当前育苗量和养殖量最大的海水经济鱼类,有我国“海水国鱼”之称,研究者也在大黄鱼养殖实验中做了诸多尝试。相关结果表明,利用豆粕、小麦蛋白粉等植物蛋白源,或肉骨粉、血粉等动物蛋白源均可以替代大黄鱼饲料中的部分鱼粉,但替代超过一定水平则会对大黄鱼的生长与健康状态造成较严重的不良影响[7-11]。在鱼粉含量不低于45%(基础饲料中鱼粉所占比)的情况下,使用植物油部分替代大黄鱼饲料中的鱼油对大黄鱼生长无显著影响,但会显著影响大黄鱼肌肉脂肪酸组成[12-13]。而目前已证实的鱼类HUFA生物合成关键酶主要有Δ6-Fad、Δ5-Fad、Elovl5、Elovl4、Elovl2等[14-15],推测上述关键酶活力低下或基因表达的缺失可能是造成鱼类自身合成HUFA能力不足的原因。为了解大黄鱼对低鱼粉低鱼油饲料的耐受性和适应程度,本研究利用无鱼油无鱼粉饲料(fish meal and fish oil free diet,FMFOFD)饲养大黄鱼幼鱼,观察和测定了不同个体间生长差异情况、体组织脂肪酸组成,生长差异个体中HUFA合成相关基因表达水平,以期为选育出饲料转化率高且节省饲料中鱼油鱼粉用量的大黄鱼品系提供依据和参考资料。
1 材料与方法
1.1 研究饲料的制备
本研究用的无鱼粉无鱼油饲料(配方见表1)是以酪蛋白为蛋白源(河南明瑞化工有限公司,纯度:92%~95%),以大豆油(益海嘉里(安徽)粮油工业有限公司)、亚麻籽油(内蒙古锡林郭勒盟红井源油脂有限责任公司)、猪油(精炼食用猪油,厦门禾昌晟生物科技有限公司)为脂质源配制而成的。所有饲料原料经粉碎后过60目筛,按原料量由少到多逐级混合均匀,待与油脂充分混合后再加水搅拌,使其充分浸透,然后用双螺杆挤条机制作成直径约为2 mm的颗粒饲料,经60 ℃烘箱烘干1 h,再待自然风干后封口保存于-20 ℃冰箱中备用。另外,对照组采用福建天马科技集团股份有限公司生产的健马牌大黄鱼配合饲料(commercial diet,CMD,粗蛋白质量分数为43.38%,粗脂肪为11.23%)饲养。
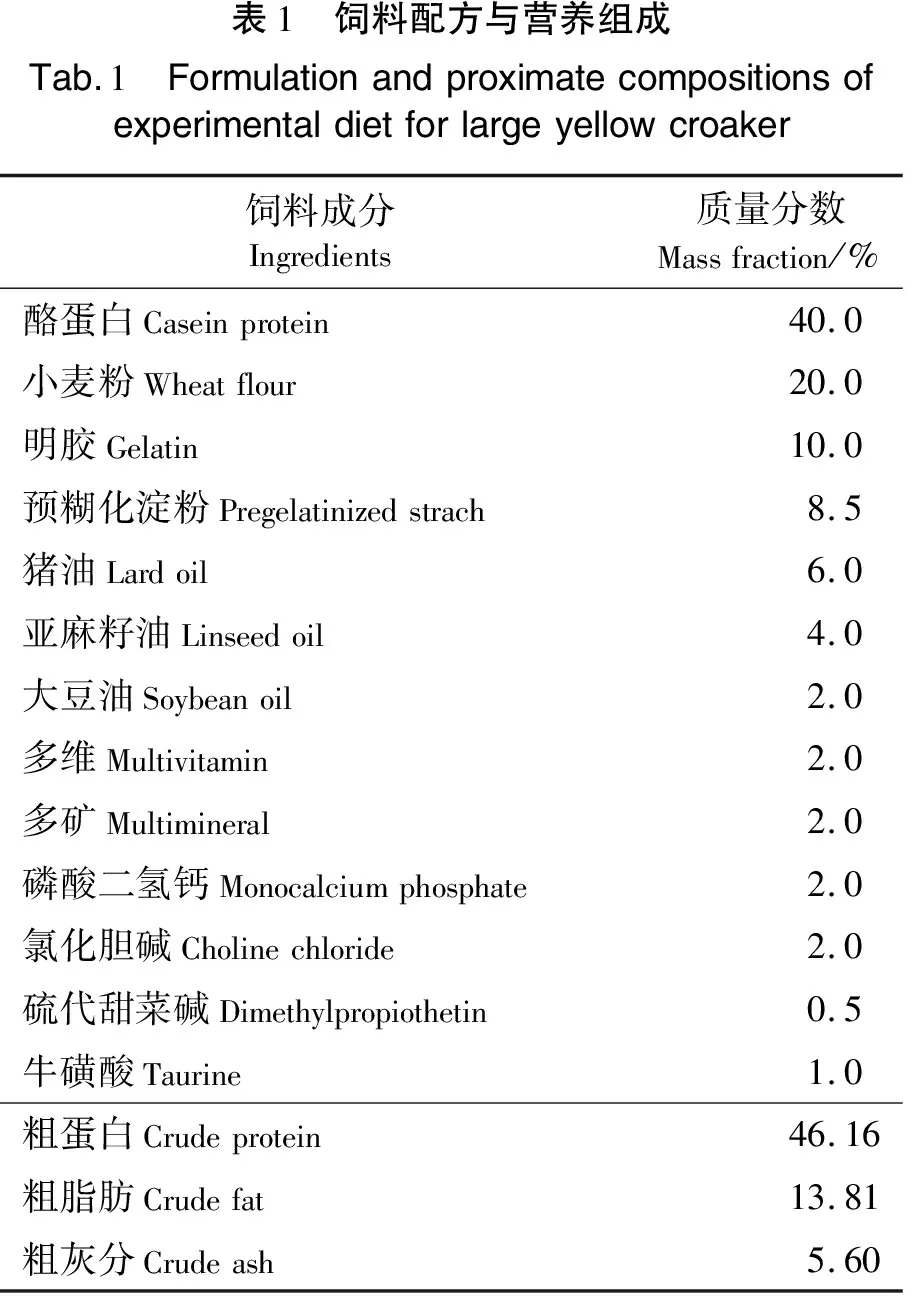
表1 饲料配方与营养组成Tab.1 Formulationandproximatecompositionsofexperimentaldietforlargeyellowcroaker饲料成分Ingredients质量分数Massfraction/%酪蛋白Caseinprotein40.0小麦粉Wheatflour20.0明胶Gelatin10.0预糊化淀粉Pregelatinizedstrach8.5猪油Lardoil6.0亚麻籽油Linseedoil4.0大豆油Soybeanoil2.0多维Multivitamin2.0多矿Multimineral2.0磷酸二氢钙Monocalciumphosphate2.0氯化胆碱Cholinechloride2.0硫代甜菜碱Dimethylpropiothetin0.5牛磺酸Taurine1.0粗蛋白Crudeprotein46.16粗脂肪Crudefat13.81粗灰分Crudeash5.60
1.2 实验鱼处理
实验用的大黄鱼幼鱼由宁德市金玲水产科技有限公司提供。实验开始前,先将大黄鱼幼鱼从海上网箱移入室内水泥池(3 m×3 m×1.5 m)中暂养1周,期间投喂健马牌大黄鱼配合饲料进行驯化,直至能完全摄食配合饲料。按体重大小将幼鱼分成6个不同的实验组后,移入2 m×1 m×1 m(水深0.8 m)的小池中进行无鱼粉无鱼油饲料饲养实验;余下(未作分选)的幼鱼作为对照组继续用商品饲料CMD喂养。
1.3 饲养管理和饲养条件
幼鱼暂养驯化和正式实验期间均每天投喂两次(8:30、15:30),饲料颗粒大小根据鱼体大小进行调整,投喂至幼鱼不再摄食则停止投饵。实验期间,海水的温度为(25±2)℃,盐度为30~35,溶解氧维持在5 mg/L以上,每天吸污(换水量为100%)。
1.4 样品采集和处理
饲养实验结束时,先对实验鱼饥饿处理24 h,再用丁香酚进行麻醉后才分别测量鱼体重和体长。剪取每尾大黄鱼的胸鳍,置于95%的酒精中,-20 ℃保存,用于DNA的提取;解剖鱼体取脑、肝脏、胃、肠和肌肉组织,置于RNA保护液中,-80 ℃保存,用于RNA 的提取;取内脏团、肌肉和肝脏组织,分别用锡箔纸包好后用自封袋封装,-20 ℃保存,用于日后营养成分分析。
1.5 样品测定及数据分析
样品的粗蛋白含量采用凯氏定氮法测定,粗脂肪采用Folch氯仿-甲醇法[16]测定。组织样品中脂肪酸含量的测定方法为:将提取的总脂肪,采用三氟化硼进行脂肪酸甲酯化,然后用安捷伦7850气相色谱仪对脂肪酸进行分析。仪器条件设置为:前进样口250 ℃;柱箱250 ℃;柱流量1.25 mL/min;进样量1 μL;分流比为50∶1。梯度升温程序为:50 ℃,2 min;再5 ℃/min,从50 ℃上升到270 ℃;270 ℃,2 min。采用面积归一法进行脂肪酸含量的定量分析。
1.6 荧光定量PCR
无鱼粉无鱼油饲料喂养的实验组生长快个体、生长慢个体和以普通饲料喂养的对照组大黄鱼各10尾,分别取其脑、肝、肌肉、胃、肠组织样品进行分析。
1)RNA的提取。RNA提取试剂盒购买自北京全式金生物技术有限公司。取50 mg左右组织进行总RNA的提取,1%琼脂糖凝胶电泳检测其完整性后用超微量分光光度计测定RNA最终浓度及纯度。
2)qRT-PCR反应。用DNase Ⅰ对提取的大黄鱼RNA样品进行处理后,用逆转录试剂盒GoScriptTM Reverse Transcription System(Promega,USA)进行下一步的处理。PCR反应程序为:25 ℃,5 min;42 ℃,90 min;70 ℃,15 min。反应结束后置于-80 ℃保存备用。
3)引物设计与合成。根据已经发表的大黄鱼基因序列,设计特异性引物,以β-actin为内参基因。所有引物(见表2)均由北京华大基因有限公司合成。
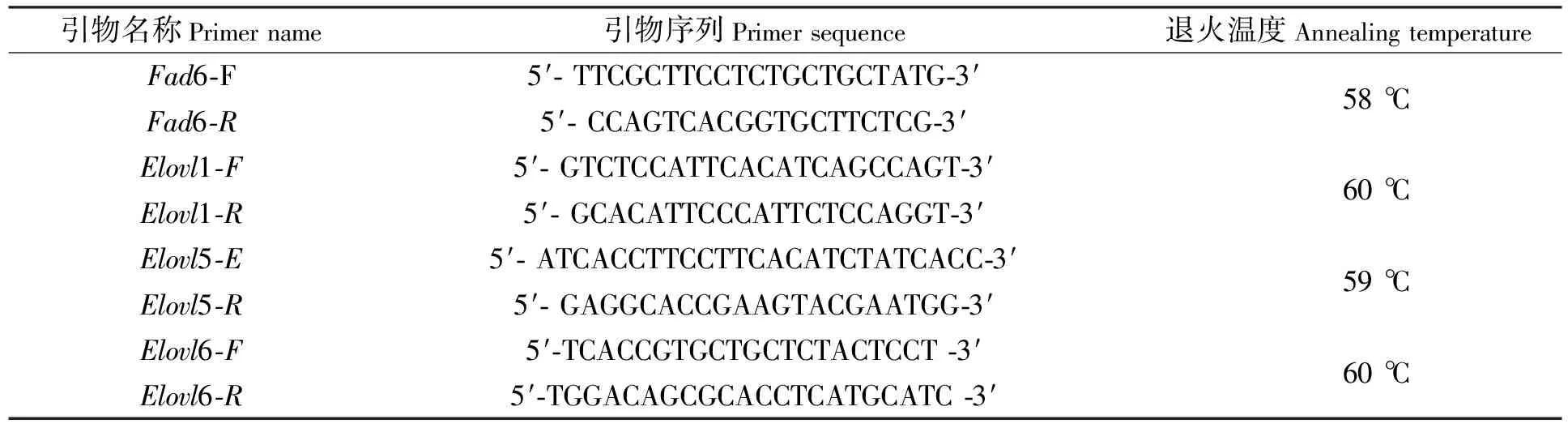
表2 本研究使用的qRT-PCR引物序列和退火温度
PCR反应体系共包含正向引物(10 μmol/L)0.5 μL,反向引物(10 μmol/L)0.5 μL,大黄鱼cDNA模板4 μL,SYBR Green Realtime PCR Master Mix Ⅰ Gene 10 μL,SYBR Green Realtime PCR Master Mix Ⅱ H20 Grade 5 μL。反应条件为:95 ℃ 10 min;95 ℃ 20 s,各基因退火温度20 s,72 ℃ 25 s(45个循环);81 ℃荧光采集5 s。熔解曲线的反应条件为:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。反应结束后,由罗氏定量PCR仪系统自带软件绘制基因的溶解曲线和计算扩增效率,分析获得各个样品的CP值,并采用2-ΔΔCT法以β-actin的表达量来对样品进行标准化数据处理。基因表达水平等于各组织表达平均值±各组织表达标准误差平均值(mean±mean of standard error,M±SEM)。
1.7 数据分析
数据采用SPSS 17.0进行统计处理,结果用平均值±标准差(Means±SD)表示。对数据进行单因素方差分析(one-way ANOVA),显著性水平为 0.05,若差异显著用LSD法进行多重比较。
2 结果
2.1 无鱼粉无鱼油饲料饲养的大黄鱼的生长与存活率
用无鱼粉无鱼油饲料喂养的大黄鱼的生长和存活情况见表3。其中第2组(初始体重为2.00~2.25 g)由于在实验期间受到病害感染,在实验开始的第40天出现大量死亡,至第42天全部死亡。由表3可见,用无鱼粉无鱼油饲料喂养的大黄鱼幼鱼仍有部分个体能够正常存活并以较快的速度生长。各组内幼鱼的初始体重差异不大,最大个体与最小个体体重差别不超过10%,但结束时则体重差异很大,当时间超过60 d后,各组最大个体体重均达到最小个体的3倍以上,其中1、3、6三组最大个体体重均达到最小个体的4.2倍以上(见表3)。
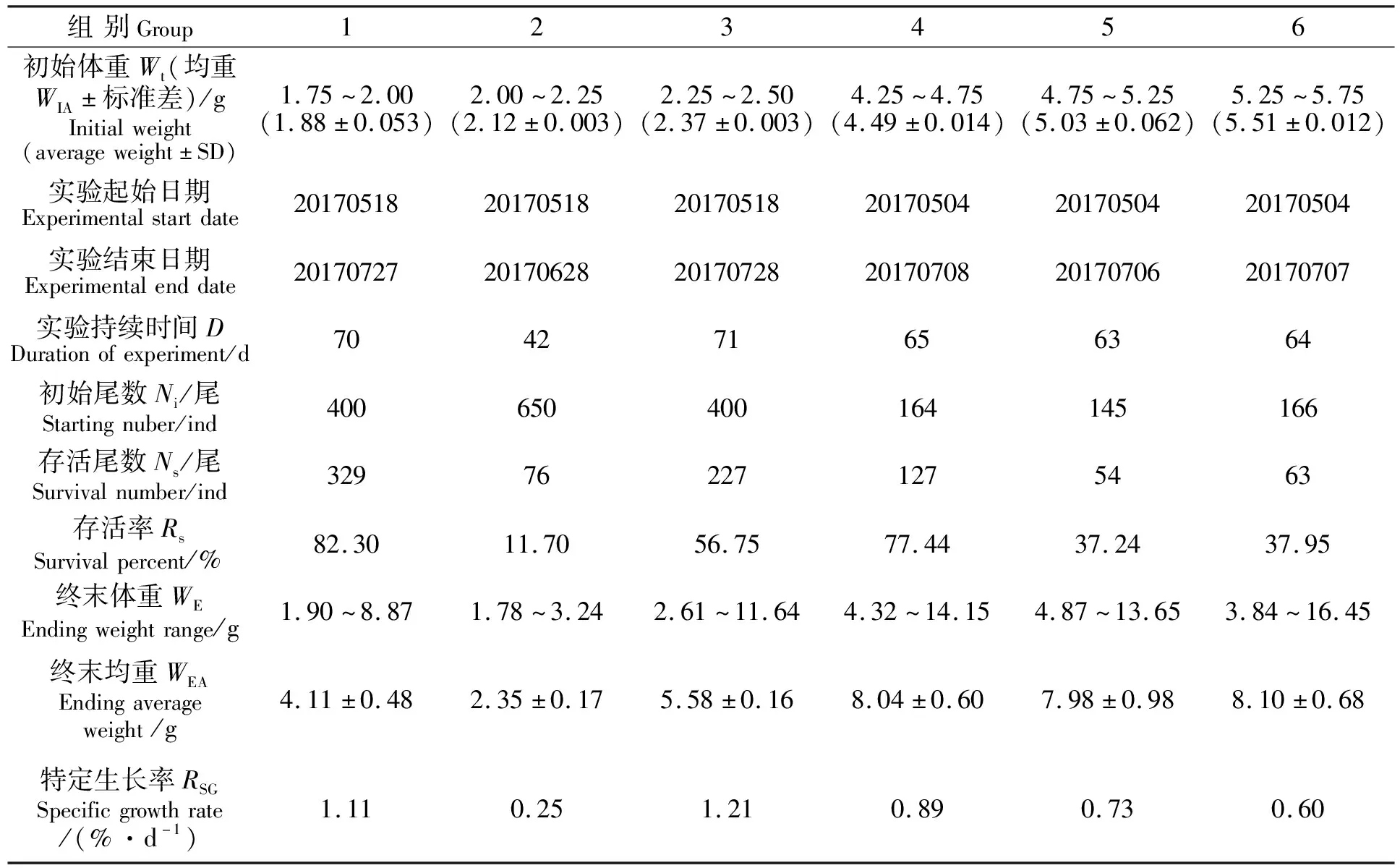
表3 大黄鱼幼鱼生长与存活结果
除实验组2之外的其他实验组均有观察到部分实验鱼因不能适应实验饲料而陆续死亡,这些死亡个体并未发现被病原体感染的症状,解剖可以观察到其肝脏与正常肝脏组织相比颜色较白且易碎。实验结束时对部分鱼进行解剖,发现生长快的个体外部形态与内部构造都正常,与用普通商品饲料喂养的个体无异,但生长最慢(尤其是第6组中最终体重比初始体重还小)的个体,尽管外部形态看不到明显异常,但其肝脏也出现明显的发白、易碎症状。
2.2 无鱼粉无鱼油饲料饲养的大黄鱼的肌肉脂肪酸组成
实验组4(初始体重4.25~4.75 g)中生长速度不同的3类个体的肌肉脂肪酸组成与含量见表4。从表4中可见,用商品饲料饲养的大黄鱼的肌肉中∑SFA和HUFA的含量显著高于用无鱼粉无鱼油饲料饲养的大黄鱼(P<0.05),而∑PUFA含量则显著低于无鱼粉无鱼油组(P<0.05)。用无鱼粉无鱼油饲料饲养的大黄鱼生长快个体肌肉中,∑MUFA、HUFA含量和DHA/EPA比例低于生长慢及中等个体;DHA含量显著低于生长慢及中等个体(P<0.05);而∑PUFA含量则较高,其中EPA含量显著高于生长慢个体(P<0.05)。
3) 由于港口费率的不同,各港口城市投资港口的产出效率有所差异。当竞争者的投资能力低下时,降低港口使费并不是好的策略。
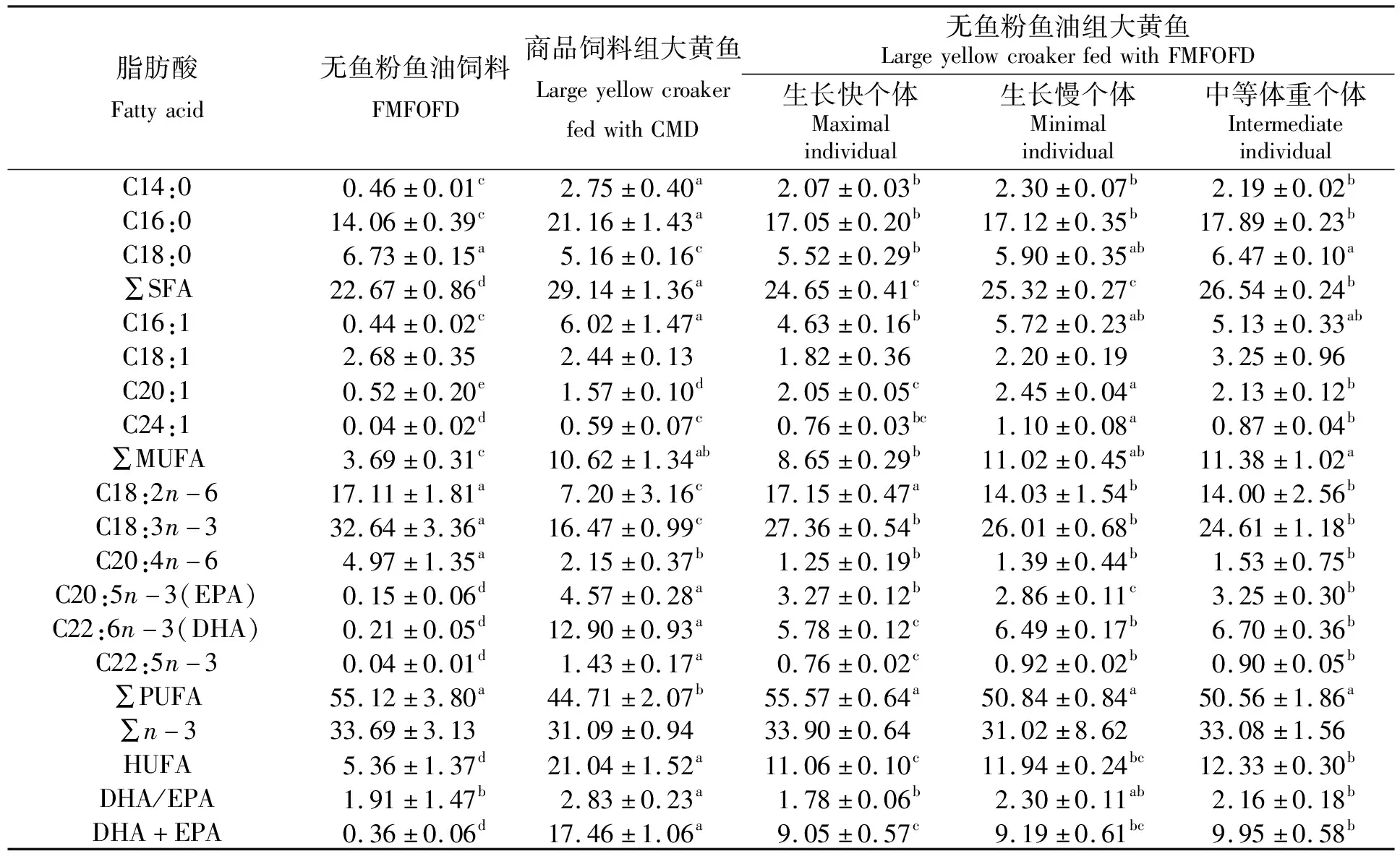
表4 大黄鱼肌肉脂肪酸组成
2.3 大黄鱼HUFA合成相关基因的表达水平
用实时荧光定量PCR技术检测了无鱼粉无鱼油饲料喂养的第4组(4.25~4.75 g)中极大(生长快)、极小(生长慢)个体和以普通饲料喂养的对照组大黄鱼脑、肝、肠、胃和肌肉中Δ-6Fad、Elovl1、Elovl5、Elovl6四个与HUFA合成相关基因的表达情况。
2.3.1 Δ6-Fad基因
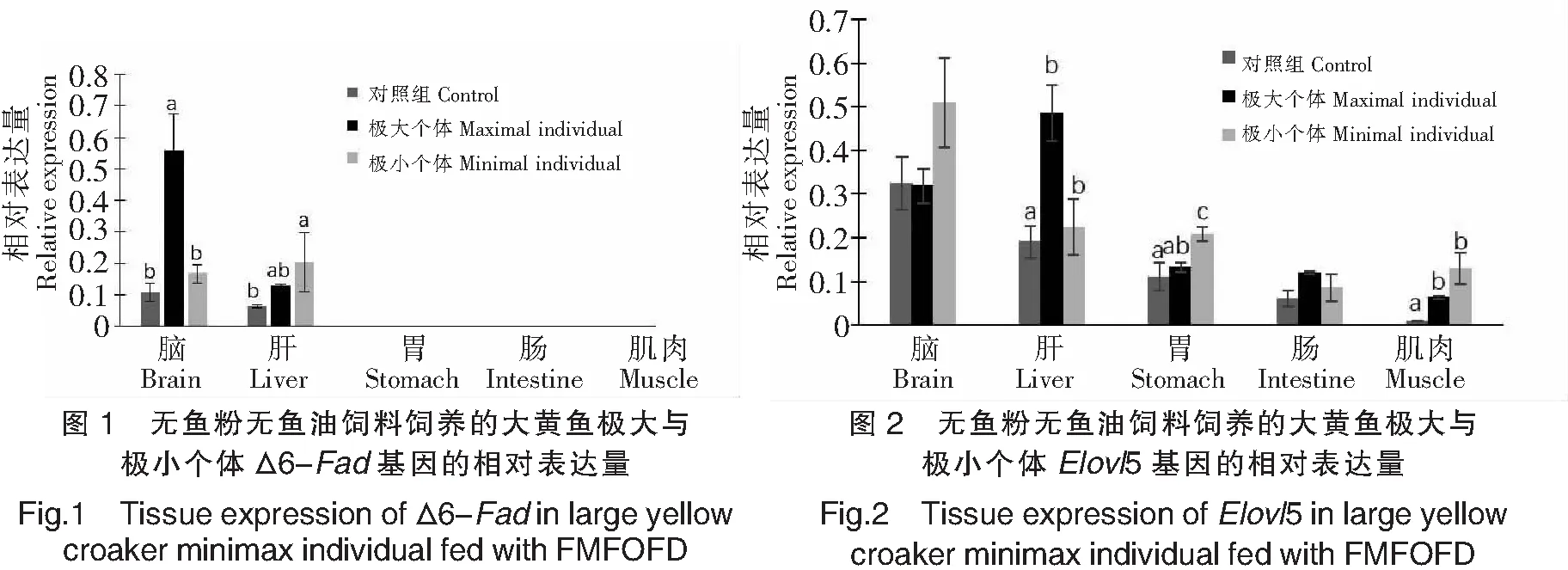
大黄鱼Δ6-Fad各组织表达结果如图1所示。其主要在脑和肝脏中表达,而以脑中表达量较多,在肠中也有痕量表达,在胃与肌肉中未检测到其表达。与商品饲料饲养的大黄鱼(对照组)相比,无鱼粉无鱼油饲料饲养的大黄鱼幼鱼,生长快个体的Δ6-Fad的表达量显著升高,尤其是在脑中表达量约为对照组的5.5倍(P<0.05),肝脏中Δ6-Fad的表达量约为对照组的1.8倍(P>0.05);生长慢的个体Δ6-Fad的表达量也比对照组高,但在脑和肠中的表达水平与对照组差异不显著(P>0.05),在肝脏中的表达水平与对照组差异显著(P<0.05)。无鱼粉无鱼油饲料饲养的大黄鱼幼鱼生长快与生长慢的个体相比,前者脑中Δ6-Fad的表达量约为后者的3.3倍,差异显著(P<0.05);在肝中的表达量生长快的则略低于生长慢的个体,但差异不显著(P>0.05)。
2.3.2Elovl5基因
大黄鱼各组织Elovl5的表达量如图2所示。其在脑、肝脏、胃、肠和肌肉中都有表达。商品饲料饲养的大黄鱼以脑中表达量较高,其次是肝、胃、肠,肌肉中表达量最少。与对照组大黄鱼相比,无鱼粉无鱼油饲料饲养的大黄鱼幼鱼,生长快的个体肝脏与肌肉中Elovl5的表达量都显著升高(提高到2倍以上,P<0.05),胃与肠中的表达量也有升高但差异不显著(P>0.05),脑中Elovl5的表达量则与对照组基本一致,其表达量大小顺序是:肝>脑>胃>肠>肌肉;而生长慢的个体检测的5个组织中Elovl5的表达量都高于对照组,其中以胃中升高最显著(P<0.01),肝和肌肉中升高的幅度也达到显著水平(P<0.01),脑和肠中的表达水平虽比对照组高但差异不显著(P>0.05),其表达量大小顺序是:脑>肝>胃>肌肉>肠。无鱼粉无鱼油饲料饲养的大黄鱼幼鱼生长快与生长慢的个体相比,前者以肝脏中表达量最高且两者之间差异显著(P<0.05),后者则是脑中的表达量最高。
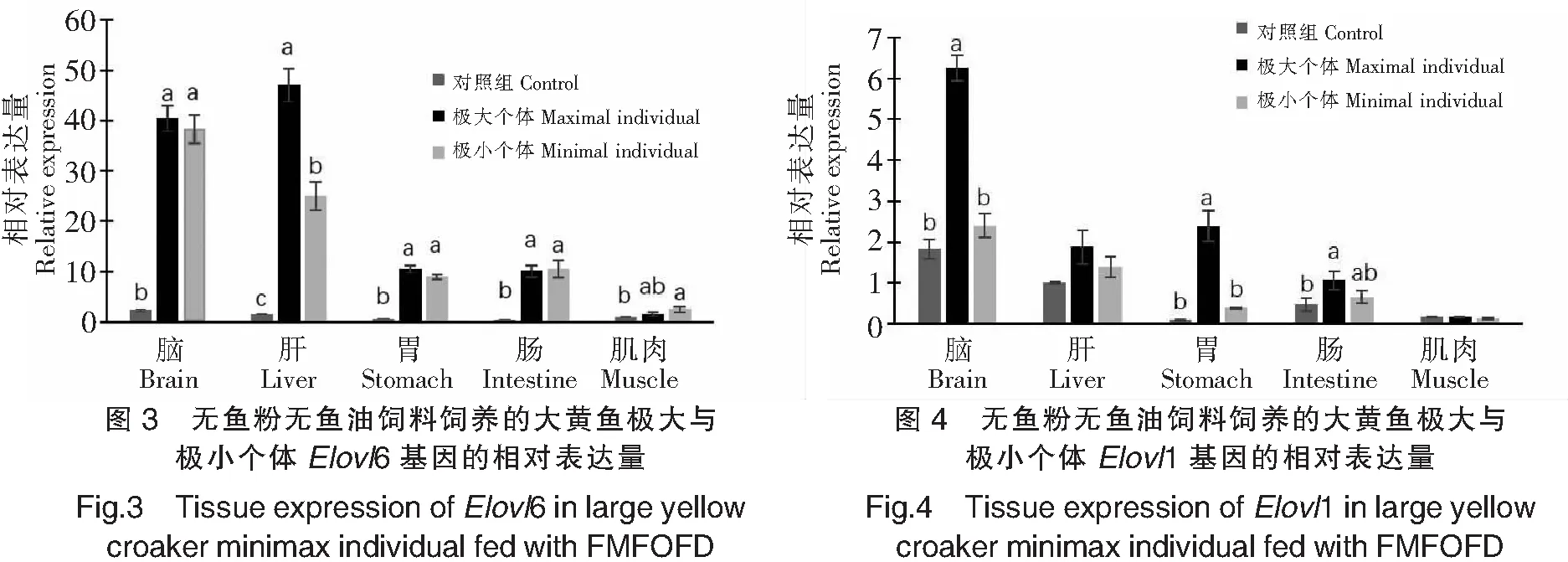
大黄鱼各组织Elovl6基因的表达量见图3。其在脑、肝脏、胃、肠和肌肉中都有表达,但表达量都很低。与对照组相比,无鱼粉无鱼油饲料饲养的大黄鱼幼鱼各组织中Elovl6基因的表达量均显著升高(P<0.05),除肌肉组织外,其他各组织中的升高幅度都达到20倍以上,特别是在脑和肝脏中的表达量很高。尤其是生长快的个体,肝脏与脑中Elovl6的表达量均高于生长慢个体,其中肝脏中两者之间的差异显著(P<0.05)。生长快个体Elovl6的表达量大小顺序是:肝>脑>胃≈肠>肌肉,以肝脏表达量最高;而生长慢的个体Elovl6表达量大小顺序则是:脑>肝>胃≈肠>肌肉,以脑中表达量最高。
2.3.4Elovl1基因
大黄鱼各组织Elovl1基因表达量如图4所示,其在脑、肝脏、胃、肠和肌肉中都有表达。对照组大黄鱼Elovl1基因以脑中表达量最高,其次是肝脏、肠、肌肉,胃中表达量最低。与对照组相比,无鱼粉无鱼油饲料饲养的大黄鱼幼鱼除了肌肉以外其余4种组织中Elovl1基因的表达量都有不同程度的升高:生长快的个体脑中Elovl1的表达量升高到3倍以上,胃中的表达量升高20倍以上,肠中表达量升高的幅度也达到显著性差异水平(P<0.05),肝脏的表达量也有明显升高但与对照组差异不显著;生长慢个体各组织(肌肉除外)Elovl1的表达量虽有升高,但与对照组比较差异都不显著(P>0.05)。
3 讨论
3.1 无鱼油无鱼粉饲料对不同大黄鱼幼鱼生长和存活的影响
本研究对体重介于1.75~5.75 g的1925尾大黄鱼幼鱼,进行了无鱼粉无鱼油饲料喂养实验,其中第2组(2.00~2.25 g)幼鱼在饲养至第6周时突然暴发严重的细菌性疾病而大量死亡,至第42天存活个体只剩下11.7%且活力明显不佳,因而提前中断该组实验。其余各组经过9~10周实验,都得到了相似的结果,即:各组都有部分幼鱼因为不能适应所用的饲料而死亡,死亡的个体肝脏普遍发生了明显的病变;各组存活的个体变得大小差异很大,各组最大个体体重是同组最小个体的2.8倍至4.6倍(见表3);有些个体几乎完全没有生长,甚至实验结束时体重比实验初始时还小,这些生长慢或没生长甚至负生长的个体肝脏也呈贫血状,色淡、易碎,产生了异常,而生长快的个体则肝脏形态和颜色都表现正常。即使是中途中断了实验的第2组,第42天时仍存活的个体之间大小也出现显著的差异,最大最小个体间体重差别(极差)已由实验起始时的0.25 g扩大为1.46 g,最大与最小个体间的体重比由1.125(2.25 g/2.00 g)上升为1.82(3.24 g/1.78 g)。
上述结果说明,同样的饲料对不同的个体饲养的效果是不一样的,大黄鱼不同个体之间对无鱼粉无鱼油饲料的适应性差异是非常大的。造成这种差异的原因,可能与不同个体间的营养感知[16]、对特定饲料的消化吸收能力(即饲料转化率),以及长链多不饱和脂肪酸和高不饱和脂肪酸的合成能力等因素有关,也与个体间的食物偏好性和营养需求差异有关[17]。鱼粉和鱼油是构成大黄鱼配合饲料成本的主要部分,随着养殖业发展,鱼粉和鱼油供应不足在未来可能成为制约肉食性海洋水产动物养殖规模进一步扩大的因素。从本研究的结果看,利用养殖对象个体之间的遗传差异,选育出对鱼粉鱼油需求量低,甚至完全不需要添加鱼粉鱼油的“耐粗饲”品系,从而降低养殖成本,减少对鱼油鱼粉的需求,这是完全可能的,并具有巨大的意义,值得引起充分重视。本研究也提示鱼类(及其他肉食性水产动物)营养与饲料研究者,在进行营养与饲料的相关研究时,需要充分考虑研究对象群体及个体之间的遗传差异。
3.2 无鱼粉无鱼油饲料对大黄鱼幼鱼肌肉脂肪酸组成的影响
与对照组大黄鱼脂肪酸组成相比较,可以发现摄食无鱼粉无鱼油饲料大黄鱼肌肉的ΣSFA、ΣHUFA、DHA、EPA、AA含量明显较低,ΣPUFA含量较高,但ΣMUFA含量变化不明显。这与李经奇等[12]用亚麻籽油和豆油替代鱼油对大黄鱼肌肉脂肪酸组成影响的研究结果一致。一般鱼体的脂肪酸组成与饲料的脂肪酸组成正相关,摄食无鱼粉无鱼油饲料大黄鱼幼鱼鱼体中PUFA含量高的原因与饲料中使用亚麻籽油和大豆油替代鱼油有关。亚麻籽油中含有丰富的LA、ARA、ALA,导致实验鱼体中的LA、ARA含量明显升高,这在大菱鲆[18]的亚麻籽油替代鱼油的实验中也得到证实。
在脊椎动物中HUFA的生物合成是通过脂肪酸去饱和酶(Fads)和延长酶(Elovl)催化完成的。经过连续的去饱和及延长反应,将LA和ALA合成为DHA和EPA等高度不饱和脂肪酸[19]。海水鱼类的高不饱和脂肪酸合成调控机制与大多数脊椎动物一致。但不同鱼类的HUFA合成能力差异明显,一般认为淡水鱼类和溯河洄游的鲑鳟鱼类能够依靠自身的作用将LA和ALA转化为HUFA,而在对海水鱼类如真鲷、大菱鲆等HUFA合成机制的研究中发现,由于关键性的去饱和酶活性较低或极低,使其将LA和ALA转化为HUFA的效率极低而不能满足自身需要[20-21]。另外,海水鱼的天然食物中富含HUFA,不需要自身额外合成,导致相关HUFA合成基因的表达量降低、功能退化甚至消失[22-23],推测这是导致摄食无鱼粉无鱼油饲料大黄鱼鱼体EPA、DHA等HUFA明显低于对照组的原因。同时对4.25~4.75 g组内大黄鱼体重极端大和极端小的个体脂肪酸含量的相互比较也可以发现,大黄鱼生长较快的个体中ALA、ARA和PUFA含量均明显高于生长较慢个体,提示脂肪酸的吸收利用效率与大黄鱼的生长密切相关,但饲料中缺乏HUFA的情况是否在一定程度上激发了大黄鱼自身的HUFA合成能力,还需要结合大黄鱼HUFA合成相关基因的表达情况作进一步探讨。
3.3 无鱼粉无鱼油饲料对生长差异大黄鱼幼鱼HUFA合成相关基因表达的影响
本研究采用荧光定量PCR方法,对摄食无鱼粉无鱼油饲料生长快和生长慢的大黄鱼,以及摄食商品饲料大黄鱼组织中的4种脂肪酸合成酶基因表达情况进行了比较分析,结果显示4个基因在摄食无鱼粉无鱼油饲料大黄鱼幼鱼特定组织中的表达量都有不同程度的提高,特别是生长快的个体其Δ6-Fad和Elovl5表达水平的升高较显著,这与李经奇等[12]的研究结果一致。在有关海水鱼类Δ6-Fad的营养调控研究[24]中发现,金头鲷(Sparusaurata)Δ6-Fad的两种转录本都被富含HUFA的饲料所抑制;相反,用菜籽油和豆油完全替代鱼油饲喂金头鲷幼鱼,不仅显著提高了鱼体的18:2n-9和18:3n-6含量,而且Δ6-FadmRNA的表达量也提高了6倍。在对大西洋鲑(Salmosalar)的研究[25]中发现,大豆油组鱼肝细胞Δ5-Fad和Δ6-Fad基因的相对表达量均显著高于鱼油组[31],Δ6-Fad是鱼类HUFA生物合成的第一限速酶[26],提示富含十八碳脂肪酸的植物油可能比富含DHA和EPA的鱼油更能促进鱼体对特定脂肪酸如HUFA的去饱和过程。
Elovl5碳链延长酶基因在海水鱼类中广泛存在,在从C18至C20 PUFA合成中碳链的延长酶发挥重要作用,且一般认为海水鱼中Elovl5的活性较高。有研究[27]表明n-3HUFA对大黄鱼Elovl5和Elovl4基因的表达有抑制作用。本研究的商品饲料中由于添加了大量鱼粉和鱼油,含有充足的HUFA可供直接吸收利用,不需要鱼类自身合成,因此对照组中这些基因的表达量较低,而实验组中HUFA合成相关基因的表达量上升也证实了大黄鱼自身具有一定的HUFA合成能力,且相关基因受外界营养条件的影响和调控。
此外,本研究的结果显示摄食无鱼粉无鱼油饲料大黄鱼幼鱼组织中Elovl1和Elovl6的表达量也显著上升。目前海水鱼类研究较多的是Elovl5、Elovl2等延长酶基因,关于Elovl1和Elovl6的报道甚少。Elovl1主要催化形成C12:0、C14:0、C16:0[28],Elovl6在C18:0和C18:1的催化生成中起重要作用[29]。本研究在无鱼粉无鱼油饲料中延长酶的作用底物充足,因此Elovl1和Elovl6基因表达量显著增加,进一步证实了营养条件会影响HUFA合成基因的表达,相关基因的表达又促进了鱼类对特定脂肪酸的吸收利用。上述基因表达模式的差异可能与实验鱼个体出现的生长差异密切相关,但是否是引起鱼体生长差异的主要原因以及其作用机理如何,后续需要利用基因组学结合分子生物学手段加以深入研究。
4 结论
本研究以混合油脂(m(大豆油)∶m(亚麻籽油)∶m(猪油)=2∶1∶1)替代鱼油,明胶和酪蛋白替代鱼粉制成的无鱼粉无鱼油配合饲料,对大黄鱼幼鱼进行为期70 d的养殖。结果表明:摄食无鱼粉无鱼油饲料的大黄鱼幼鱼能够正常存活,但不同个体之间的生长差异显著;ΣHUFA、DHA、EPA、AA含量明显较低,ΣPUFA含量较高;生长快与生长慢个体的Δ6-Fad、Elovl5、Elovl6和Elovl1的表达模式即组织表达谱均存在明显的差异,生长快个体脑中Δ6-Fad和Elovl1、肝中Elovl5和Elovl6的表达量显著高于生长慢个体。这说明大黄鱼幼鱼早期营养调控可以有效调节鱼体HUFA合成能力以及对饲料中营养物质的利用率。本研究结果为今后改善大黄鱼幼鱼饲料配方,降低饲料成本,提高养殖效益具有重要的意义。
