急性温度胁迫对花鳅抗氧化酶活性及丙二醛含量的影响
2021-01-06丁小赵云龙李艳娇乔淑芬许梦瑶苗婷婷
丁小 赵云龙 李艳娇 乔淑芬 许梦瑶 苗婷婷
摘要:为探索花鳅对温度的急性应激反应,采用8℃、12℃、16℃和20℃胁迫长期养殖于12±2℃的温度条件下的花鳅12小时、24小时和48小时,观察行为、成活率,超氧化物歧化酶、过氧化氢酶和丙二醛指标。结果显示,4个温度梯度下,成活率均为100%,行为发生变化,温度越高活动性越强,20℃开始出现在水体中上层频繁游动现象。同一温度处理,除12℃处理组,超氧化物歧化酶、过氧化氢酶活性和丙二醛含量均随时间延长呈先上升后下降的趋势,不同时间存在显著差异;同一检测时间,三者均随温度升高呈先下降后上升的趋势,除48小时的不同温度超氧化物歧化酶活性之间无显著差异,其余不同温度均存在显著差异。水温发生急剧变化,影响鱼体行为,产生氧化应激反应。在实际养殖生产中,应密切关注养殖水温的变化,减少温度应激,增加花鳅免疫力,提高抗病能力。
关键词:花鳅;温度;超氧化物歧化酶;过氧化氢酶;丙二醛
中图分类号:Q955 文献标识码:A
花鳅(Cobitis taenia)属鳅科动物,是多年生小型经济冷水鱼,也是一味中药材,长白山区冷水域有分布,对水体环境要求极高,生活在清澈的砂石底溪水或河流中[1],明显不同于常见泥鳅。鱼类在进化过程中对外界剌激形成了应激反应。如果刺激超出了鱼类正常的调控范围,则会对健康产生危害。受养殖环境约束,当鱼无法逃避又不能克服这些有害刺激时,对鱼的危害就更加突出。因为应激能力会使鱼类重新分配体内能量,以应对眼前危机,进而将不可避免地削弱生长、繁殖和免疫等方面的机能,即为应激付出一定的生物学代价[2]。本文从温度刺激方面入手,探究花鳅应激反应,并寻找缓解其应激的措施,以期为花鳅及其他长白山区冷水鱼的人工驯养和繁殖等活动提供理论依据和实践基础,同时丰富鱼类应激生物学。
1 材料与方法
1.1 试验材料与饲养管理
试验在通化师范学院长白山区冷水鱼类分子进化与健康养殖试验室进行,材料于2020年06月初取自通化育华农林科技发展有限责任公司。共计450条外观无异常、健康、初始重量为8.71±0.50 g、体长为101.74±1.70 mm的花鳅作为研究对象,置于养殖水族箱(聚乙烯塑料,长宽高分别为1.5 m、1.0 m、0.8 m),饲养条件为水温12±1℃,pH值7.0~7.5,溶解氧含量大于5.0 mg/L,氨氮含量小于0.01 mg/L,硫化物小于0.05 mg/L,稳定饲养2周后,开始试验。试验期间,每天准确称取一定量的饲料,依据每日残饵量调整次日投喂量,投喂后1小时,将残饵用虹吸管吸出。投喂时间分别为每天早、晚6:00。养殖用水先经曝气,每周换水1次。
1.2 试验方法与操作步骤
试验设置4个温度处理组(8℃、12℃、16℃和20℃),每个温度设置3个重复组,采用自动控温设备控制温度。试验开始随机取30尾放入设定温度的水族箱中,在0小时、12小时、24小时和48小时取样,每个时间点每箱随机取样5尾鱼,试验期间不饲喂。
1.3 样品采集及测定
取5尾鱼后解剖取肝胰脏,用吸水纸将肝胰脏擦干,精准称取组织,冰浴条件下,按体积(mL)∶质量(g)=9∶1的比例加入生理盐水,使用玻璃研磨器磨碎后装进离心管,2500 r/min,4℃条件下,离心10 min取上清液检测。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒,购自南京建成生物研究所,操作按照说明书执行。
1.4 数据处理
试验所得数据均用SPSS 25.0统计软件进行单因素方差分析(One-way ANOVA),采用Duncan法进行多重比较。数据均以平均数±标准差进行表示。
2 结果与分析
2.1 急性温度胁迫对花鳅生存和行为影响
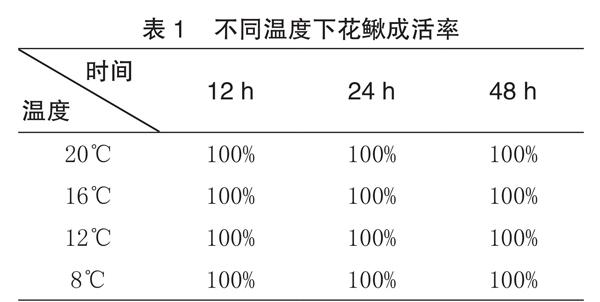
如表1所示,所选择的4个温度3个时间点,花鳅成活率均为100%,无死亡,行为发生了变化,虽都会在底层聚集,但温度越低活动性减弱,温度越高活动性加强,20℃开始出现在中上层频繁游动现象。
2.2 急性温度胁迫对花鳅肝胰脏SOD和CAT活性的影响
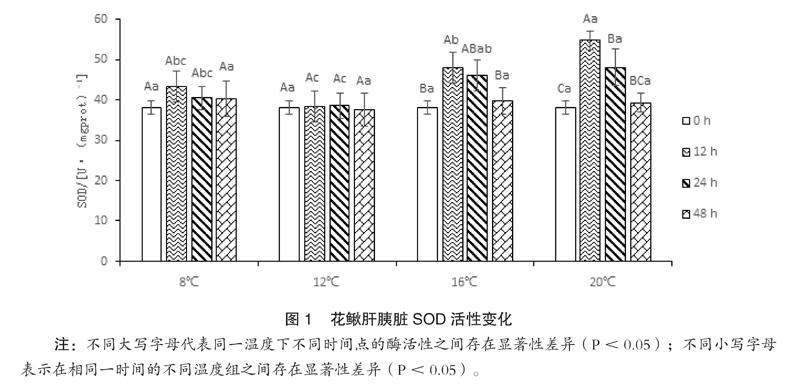
如图1所示,同一温度处理,SOD活性随时间延长呈先上升后下降的趋势,除12℃,不同时间SOD活性之间存在显著差异(P<0.05);同一检测时间,除起始0小时,SOD活性随温度升高呈先下降后上升的趋势,12小时和24小时的不同温度SOD活性之间存在显著差异(P<0.05),48小时的不同温度SOD活性之间无显著差异。
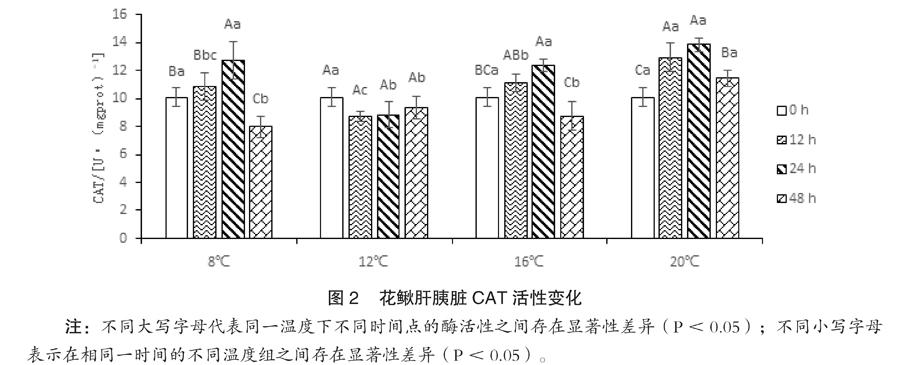
如图2所示,同一温度处理,CAT活性随时间延长呈先上升后下降的趋势,除12℃,不同时间CAT活性之间存在显著差异(P<0.05);同一检测时间,除起始0小时,CAT活性随温度升高呈先下降后上升的趋势,不同温度CAT活性之间存在显著差异(P<0.05)。
2.3 急性温度胁迫对花鳅肝胰脏MDA含量的影响
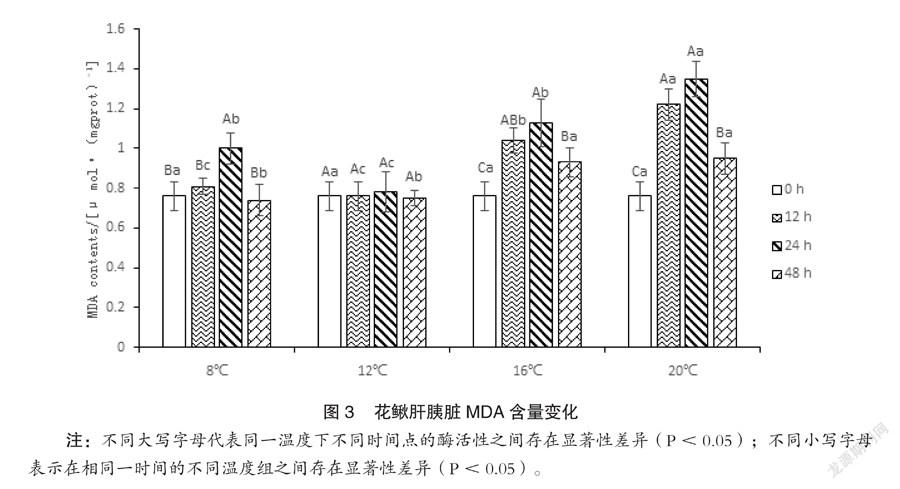
如图3所示,同一温度处理,除12℃,MDA含量均随时间延长呈现先上升后下降的趋势,不同时间MDA含量之间存在显著差异(P<0.05);同一检测时间,除起始0小时,MDA含量均随温度升高呈现先下降后上升的趋势,不同温度MDA含量之间存在显著差异(P<0.05)。
3 讨论
温度是影响动物生长发育最重要的因素之一。急性溫度变化是鱼类在养殖生产、商品运输甚至自然生活过程中可能遭遇到的最常见胁迫,可造成机体代谢紊乱,使体内自由基大量积累,进而损害细胞和组织正常的生理机能和免疫防御能力[3]。鱼类会通过调节代谢、离子平衡以应对温度变化,保持相对稳定的平衡状态,减少自身受到伤害。鱼类具有认知或感知能力[4],行为变化是遭受刺激后最直接、快速的反应[5]。与生理指标的检测方法相比,具有简易、便捷、实用等优势。由试验可知,在急性温度胁迫下,成活率虽均为100%(表1),但20℃开始出现中上层频繁游动现象。由此可见,相对高温急性胁迫,花鳅对于低温胁迫适应能力要更强一些,这也进一步证实了花鳅属于典型的冷水鱼。
水温急剧变化,鱼类会通过连续的生化反应和内分泌系统调节自身的代谢水平来适应。细胞水平上最常见是氧化应激反应,以酶抗氧化系统[6](如SOD、CAT等)和过氧化脂质及其产物MDA[7,8]等作为量化指标。温度胁迫花鳅时,氧化还原产生活性氧自由基,导致体内活性氧代谢失衡,不及时清理,就会造成机体活性氧伤害[9]。SOD和CAT是生物体内2种相互关联的抗氧化酶,可联合清除活性氧自由基,免受氧化伤害,体内SOD和CAT的酶活力下降,标志着机体清除自由基的能力下降。检测SOD和CAT的动态变化,可以准确地反映机体内自由基的代谢及组织的氧化损伤情况,对判断健康状况及免疫防御能力具有重要的参考价值[10]。本研究中,花鳅遇到温度胁迫后,SOD酶活性迅速升高,用于清除体内的活性氧自由基等。虽然CAT活性变化的幅度与SOD相差不大,但CAT活性的变化有明显的滞后性,直至24小时时才达到最大值,而此时SOD已呈下降趋势,说明花鳅的SOD酶活性较CAT更易受环境因子的影响。
MDA是细胞膜脂过氧化作用的产物,产生会加剧膜的损伤。在机体衰老生理和抗性生理研究中,MDA含量是一个常用指标[11]。MDA产生量的多少能够代表膜脂过氧化的程度,也可间接反映组织的抗氧化能力的强弱。一般来说,MDA含量越高,生物体所受的压力越大。半滑舌鳎在低温胁迫6小时后,MDA就会明显的升高[12]。本研究中,MDA含量从胁迫12小时开始就有升高的现象,至24小时达到最高值,48小时后即出现了下降的趋势。这一变化规律与温度胁迫凡纳滨对虾[13]和福寿螺[14]的MDA含量变化结果类似。表明温度刺激后,鱼体代谢加快,脂质过氧化程度增强,通过一段时间调节体内抗氧化酶活性,可以使体内脂质过氧化程度降低,适应温度变化。
取样期正好是花鳅的繁殖季节,水温可能发生急剧变化,影响机体细胞和组织正常的生理机能和免疫能力。由于机体各层次的代谢水平和生理状况都发生了相应变化,不同因子间是相互贯通、相互依存、不可分割,共同维护机体内环境的相对稳定,进而会对处于繁殖期的亲鱼产生影响,影响种群的补充。在实际养殖生产中,对于进入生殖期的雌鱼,更应密切关注养殖水温的变化,减少温度应激,增加鱼体免疫力,提高抗病能力。
参考文献
[1]富国栋,高文由. 长白山西南坡野生经济动物志[M]. 吉林:通化地区农业区划委员会办公室,1985,39.
[2]Moberg G, Mench J. The Biology of Animal Stress: Basic Principles and Implications for Animal Welfare[M]. New York: CABI,2000,1-377.
[3]Orbea A, Ortiz-Zarragoitia M, Solé M et al. Antioxidant enzymes and peroxisome proliferation in relation to contaminant body burdens of PAHs and PCBs in bivalve molluscs, crabs and fish from the Urdaibai and Plentzia estuaries (Bay of Biscay)[J]. Aquatic Toxicology,2002,58(1):75-98.
[4]Volpato G. Challenges in assessing fish welfare[J]. ILAR J,2009,50(4):329-337.
[5]Brown C, Laland K, Krause J. Fish Cognition and Behavior[M]. 2011,1-450.
[6]Pandey S, Parvez S, Sayeed I, et al. Biomarkers of oxidative stress: a comparative study of river Yamuna fish Wallago attu (Bl. & Schn.)[J]. The Science of the Total Environment,2003,309(1-3):105-115.
[7]Morales AE, Pérez-Jiménez A, Hidalgo MC et al. Oxidative stress and antioxidant defenses after prolonged starvation in Dentex dentex liver[J]. Comparative Biochemistry and Physiology Part C Toxicology & Pharmacology,2004,139(1-3):153-161.
[8]Prieto AI, Pichardo S, Jos Á et al. Time-dependent oxidative stress responses after acute exposure to toxic cyanobacterial cells containing microcystins in tilapia fish (Oreochromis niloticus) under laboratory conditions[J]. Aquatic Toxicology,2007,84(3):337-345.
[9]王伟,姜志强,孟凡平,等. 急性温度胁迫对太平洋鳕仔稚鱼成活率、生理生化指标的影响[J]. 水产科学,2012,31(8):463-466.
[10]洪美玲,陈立侨,顾顺樟,等. 不同温度胁迫方式对中华绒螯蟹免疫化学指标的影响[J].应用与环境生物学报,2007,13(6):818-822.
[11]Lepage G, Munoz G, Champagne J, et al. Preparative steps necessary for the accurate measurement of malondialdehyde by high-performance liquid chromatography. Analytical Biochemistry,1991,197(2):277-283.
[12]孙学亮,邢克智,陈成勋,等.急性温度胁迫对半滑舌鳎血液指标的影响[J]. 水产科学,2010,29(7):387-392.
[13]Xu Z, Regenstein J M, Xie D, et al. The oxidative stress and antioxidant responses of Litopenaeus vannamei to low temperature and air exposure. Fish & Shellfish Immunology,2018,72:564–571.
[14]陳炼,邬婷,陈燏,等. 温度对福寿螺抗氧化酶活性和丙二醛含量的影响[J]. 动物学杂志,2019,54(5):727-735.
基金项目:吉林省科技发展计划项目(20190301050NY);通化师范学院校级项目(CS2020092)。
作者简介:丁小(2001-),女,山东莒县人,本科,生物科学专业。
通信作者:赵云龙(1983-),男,北京人,博士研究生,研究方向:动物资源研究与利用。E-mail:252268020@qq.com
