沿阶草体细胞胚诱导及快繁技术研究
2021-01-05梁慧敏杜雪玲夏阳施昌倩
梁慧敏 杜雪玲 夏阳 施昌倩


摘要 [目的]探究沿阶草体细胞胚诱导及快繁技术。[方法]以3份沿阶草种质Nanus、Arabicus和Wild为试验材料,研究不同外植体、不同光照条件、不同植物激素配比对愈伤组织诱导、体细胞胚发生和体细胞胚成熟的影响。[结果]3份沿阶草种质中,幼茎和叶基为外植体时,愈伤组织诱导率均为最高;以沿阶草叶基为外植体,黑暗条件下的愈伤组织诱导率最高;2,4-D是沿阶草愈伤组织诱导与初生体细胞胚的发生关键激素,而NAA和6-BA与次生体细胞胚形成、体细胞胚成熟相关,其中将初生体细胞胚置于添加0.5 mg/L NAA和2.0 mg/L 6-BA的MS固体培养基培养25 d,可获得8~13倍的次生体细胞胚;将成熟的体细胞胚转入MS0培养基培养30 d可获得具有根和叶的完整植株。[结论]该研究可为沿阶草规模化繁殖和推广提供技术支撑。
关键词 沿阶草;愈伤组织;体胚发生;再生;快繁
中图分类号 S688.4 文献标识码 A 文章编号 0517-6611(2021)24-0136-05
doi:10.3969/j.issn.0517-6611.2021.24.032
A Rapid Propagation Protocol of Ophiopogon japonicus via Somatic Embryo Culture in vitro
LIANG Hui-min1,DU Xue-ling2,XIA Yang3 et al (1.Jiangsu Polytechnic College of Agriculture and Forestry, Jurong, Jiangsu 212400;2.College of Life Sciences, Huaibei Normal University, Huaibei, Anhui 235000;3.Shandong Academy of Forestry Sciences,Jinan,Shandong 250014)
Abstract [Objective]To study rapid propagation protocol of Ophiopogon japonicus via Somatic Embryo culture in vitro. [Method]Taking O. japonicus germplasms Nanus, Arabicus and Wild were used as experiment materials, effects of different explants, different light conditions, and different phytohormone ratios on callus induction, somatic embryogenesis, and somatic embryo maturation were investigated. [Result]The results showed that leaf base and young stem as explants produced significantly higher calli induction rate in all three cultivars. The highest calli induction rate from young stem was obtained under dark condition. 2,4-Dichlorophenoxyacetic acid (2,4-D) was essential for calli induction and somatic embryogenesis of O. japonicus. Both NAA and 6-BA synergistically promoted secondary embryos development and maturation. We can produce a lot of plantlets of O. japonicus through secondary embryos culture in vitro on Murashige and Skoog (MS) medium supplemented with 0.5 mg/L NAA and 2.0 mg/L 6-BA, reaching to 8-13-fold per 25 days. Finally, the complete plantlets with leaves and roots were produced by transferring maturation somatic embryos into MS0 medium for 30 days. [Conclusion] The results can provide a technical support for large-scale propagation and popularization of O. japonicus.
Key words Ophiopogon japonicus;Callus;Somatic embryogenesis;Regeneration;Rapid propagation
基金项目 江苏农林职业技术学院重点科技创新类项目(2017kj09);安徽省重点研究与开发计划项目(202004a06020046);江苏省草坪草种质资源库。
作者简介 梁慧敏(1962—),女,宁夏银川人,教授,博士,从事草坪分子遗传育种研究。
收稿日期 2021-04-01
沿阶草(Ophiopogon japonicus)又名麦冬,属于百合科(Liliaceae)沿阶草属(Ophiopogon)多年生草本单子叶植物,因其具有株型低矮、常绿、耐热、耐寒、耐旱、耐阴和耐贫瘠等特性,常被作为地被和边缘景观营造中的绿地材料[1-2]。药理研究显示,沿阶草富含皂苷、黄酮类、氨基酸、多糖和維生素等物质,对咳嗽、糖尿病、胃炎、癌症等疾病有一定治疗作用[3-5],可见沿阶草是重要的观赏兼药用的经济植物。但是,沿阶草主要依靠分离母株根状茎萌发的幼苗进行繁殖[6],这种方式繁殖效率较低,难以满足国内外绿化产业和药用产业市场扩大的种植需求。同时,分株繁殖还普遍存在病害侵染、生长缓慢等问题[7],严重影响沿阶草的成苗和品质。利用植物组织培养和基因工程技术[8-9],不仅可以显著提高沿阶草繁殖系数,还可以增强其抗逆性和抗病虫害能力,进而提升其产苗量和品质。体细胞胚发生途径是微繁殖和基因遗传转化受体体系建立的途径之一[10]。近年来,体细胞胚发生途径的微繁殖体系建立已成功应用于百合[11]、马尾松[12]、白刺花[13] 和枣[14]等园艺植物上。目前国内外有关沿阶草的微繁殖研究多以愈伤组织和不定芽诱导的器官发生途径获得再生苗[8,15-17],但以体细胞胚发生途径的研究鲜有报道[7]。
该研究分别从不同沿阶草种质、不同外植体材料(叶片、幼茎和根)、不同光照条件以及不同植物激素配比等影响因子方面,探讨筛选诱导沿阶草胚性愈伤组织和体细胞胚的最适培养基配方和培养条件,以期建立沿阶草离体培养高频植株再生体系,为沿阶草离体快繁的工厂化生产模式建立及其种质改良与创新奠定基础。
1 材料与方法
1.1 试验材料
以江苏省草坪草种质资源圃收集保存的2份引进矮生沿阶草(Ophiopogon japonicus cv.Nanus,Nanus)、黑沿阶草(Ophiopogon planiscapus cv.Arabicus,Arabicus)及1份野生细叶沿阶草(Ophiopogon spp,Wild)种质为试验材料。
1.2 无菌外植体的获取
挑选生长健壮、无病斑的植株,流水冲洗数遍后,剪去基部的根和老茎段,去除老叶,然后分别将幼嫩的幼茎、叶片和根,用洗涤剂浸泡10 min,无菌水冲洗5次,再用2%次氯酸钠(NaClO)溶液消毒15 min,在消毒过程中将消毒瓶置于电磁搅拌器上进行搅拌,以去除外植体上的气泡,提高灭菌效果。最后,消毒材料经无菌水冲洗5次后,移至超净工作台中,用70%乙醇处理20 s,0.1%氯化汞表面灭菌8 min,无菌水冲洗5次后,再用無菌滤纸吸干水分,备用。
1.3 筛选愈伤组织诱导的最佳外植体
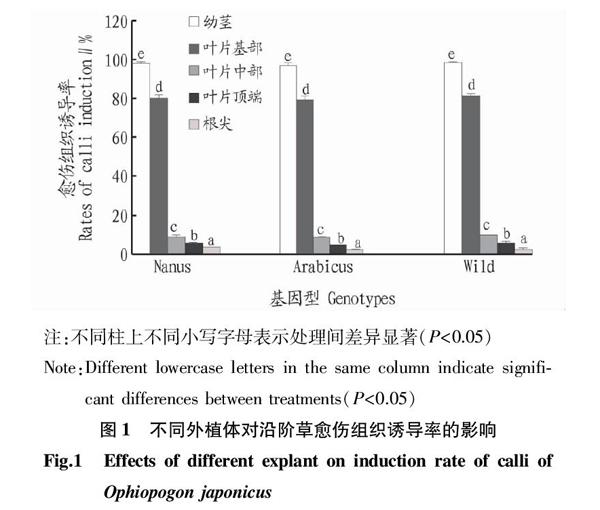
参考 Karamian 等[18]和Karalija等[11]报道的体细胞胚诱导配方,将消毒后的叶片横切成2 mm × 4 mm条状的顶端叶片、中间叶片和基部叶片,并将幼茎和根尖切成2~3 mm的小段,然后分别接种于愈伤组织诱导培养基MS + 0.5 mg/L 2,4-D + 0.5 mg/L NAA + 0.1 mg/L 6-BA + 30 g/L蔗糖+7 g/L 琼脂上(pH=5.8),温度(25±1) ℃,光周期为14 h,光照强度为500 lx。培养30 d后,统计愈伤组织诱导率。每个处理每个种质60个外植体,重复3次。
1.4 筛选愈伤组织诱导的最适光照强度
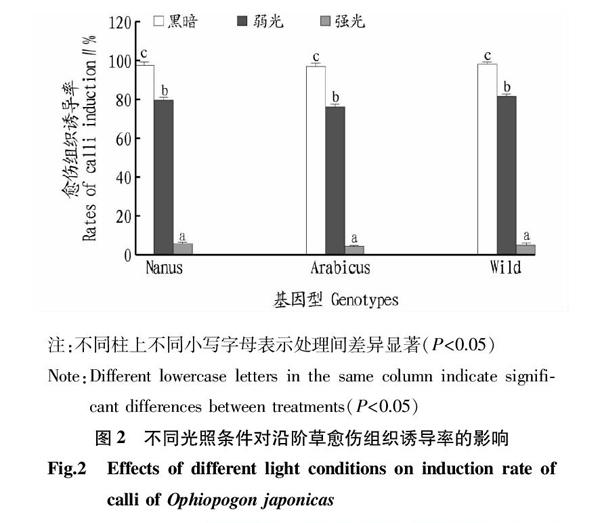
以不同沿阶草种质的叶片基部为外植体,接种于愈伤组织诱导培养基MS + 0.5 mg/L 2,4-D + 0.5 mg/L NAA + 0.1 mg/L 6-BA + 30 g/L蔗糖+7 g/L 琼脂(pH=5.8),然后分别置于不同光照强度下培养:黑暗(无光)、弱光(500~800 lx)、强光(1 000~1 500 lx),温度(25±1) ℃,培养30 d后,统计愈伤组织诱导率。每个处理每个种质60个外植体,重复3次。
1.5 不同激素浓度配比对愈伤组织诱导和初生体细胞胚发生的影响
以叶片基部为外植体,接种于愈伤组织诱导培养基MS1上,温度(25±1) ℃,光周期14 h,光照强度为500 lx。MS1由MS基本培养基附加不同浓度的2,4-D、NAA和 6-BA、蔗糖 30 g/L和琼脂7 g/L(pH=5.8)组成(表1)。培养30 d后,统计愈伤组织诱导率。此外,诱导的愈伤组织继续用MS1培养基继代一次,培养60 d后,胚性愈伤组织上会产生初生体细胞胚,并统计初生体细胞胚发生率。根据细胞结构和萌发培养基MS0 25 d培养结果,发现浅黄色、质地松软、内有致密较硬颗粒的胚性愈伤组织为初生体细胞胚。MS0由MS基本培养基添加蔗糖30 g/L和琼脂7 g/L(pH=5.8)组成。每个处理50个外植体,重复3次。
1.6 不同激素浓度配比对次生体细胞胚发生的影响
为了增加沿阶草的繁殖系数,以叶片基部为外植体,将诱导的初生体细胞胚转接到次生胚诱导培养基MS2中培养,温度(25±1) ℃,光周期14 h,光照强度为500 lx。MS2由MS基本培养基附加不同浓度NAA和6-BA、蔗糖 30 g/L和琼脂7 g/L(pH=5.8)组成(表2),培养30 d后,统计次生体细胞胚增殖系数。每个处理50个外植体,重复3次。
1.7 体细胞胚成熟和植株再生
将诱导的次生体细胞胚转接至继代培养基上,由MS基本培养基附加NAA 0.5 mg/L、6-BA 2.0 mg/L、蔗糖 30 g/L和琼脂7 g/L组成,温度(25±1)℃、光周期为14 h,500 lx,培养25 d后,发现胚性愈伤上产生大量的初代、次代和成熟的体细胞胚(成熟体细胞胚即新的次生体细胞胚不再形成)。然后,将成熟的体细胞胚切成直径大小为0.5~1.0 mm团块,接种到萌发培养基MS0上,培养温度(25±3) ℃,光周期为14 h,光强1 000 lx,培养30 d后,观察成熟体细胞胚的生长状况。
1.8 驯化移栽
挑选上述MS0培养基中生长健壮、根细长、叶片伸展的沿阶草小植株,移至温室中打开瓶盖,炼苗2~3 d,然后用自来水小心冲洗培养基,移栽至泥炭、蛭石及园土为3∶4∶3的混合基质中,控制室温在(25±3) ℃,每天喷水保湿,30 d后成活率为100%。
1.9 组织结构观察
选取不同时期新鲜的愈伤组织颗粒,进行固定、包埋、修边、切片、染色,然后置于Olympus光学显微镜(BX51,日本)下进行照相、观察、记录[19]。
1.10 数据统计分析
采用Excel、SPSS 25.0(Armonk,美国)等软件进行数据处理分析。采用最小显著差数法(the least significant difference,LSD)进行显著性检测(P < 0.05)。
愈伤组织诱导率=诱导的愈伤组织外植体数/接种的外植体数×100%
体细胞胚发生率=诱导的初生体细胞胚数/接种的外植体数×100%
次生体细胞胚增殖系数=增殖次生体细胞胚数/接种的初生胚状体数
2 结果与分析
2.1 外植体和光照强度对愈伤组织诱导的影响
从图1可知,经过30 d的培养,不同外植体在不同沿阶草种质间愈伤组织诱导率无显著差异,但是同一种质不同外植体之间愈伤组织诱导率存在显著差异。其中,各沿阶草种质中幼茎的愈伤组织诱导率最高,接近100%,其次是叶片基部,其愈伤组织诱导率约80%,最小的为根尖,愈伤组织诱导率约3%。
从图2可知,不同光照强度下不同沿阶草种质间叶片基部的愈伤组织诱导率也无显著差异,但是同一种质不同光照强度之间愈伤组织诱导率存在显著差异。愈伤组织诱导率从高到低依次为黑暗、弱光、强光条件。
2.2 不同激素浓度配比对愈伤组织诱导和初生体细胞胚发生的影响
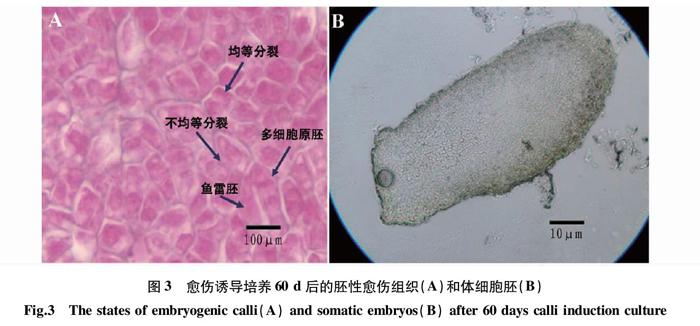
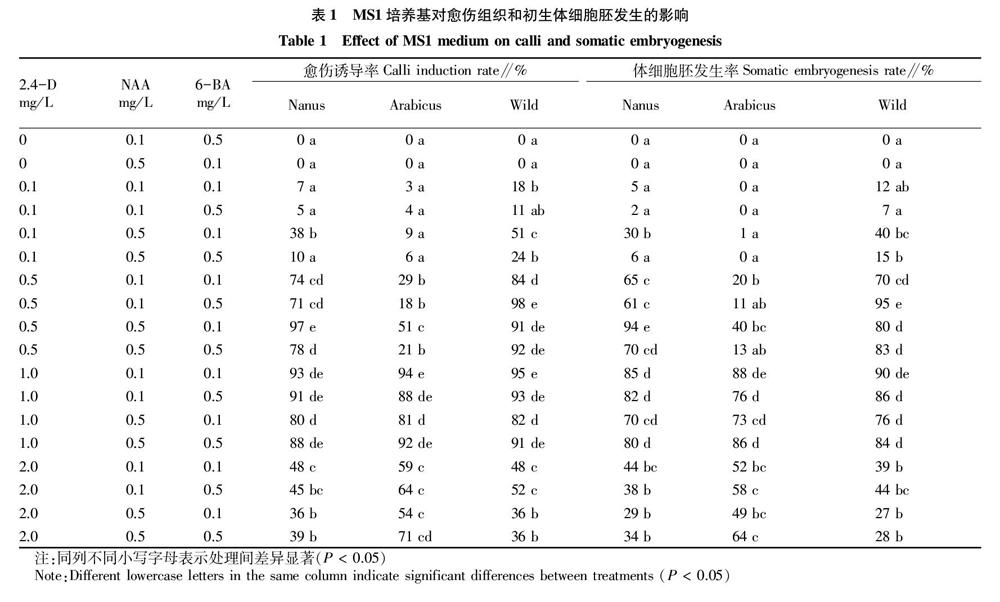
由表1可知,当2,4-D浓度为0 mg/L时,各种质均未诱导出愈伤组织;2,4-D浓度为0.1 mg/L时,各种质的愈伤组织诱导率与初生体细胞胚发生率均很低。当2,4-D浓度≥0.5 mg/L时,各组合均能诱导出胚性愈伤组织。通过光学显微镜发现,胚性愈伤组织上有少量的分生细胞团,表现为细胞质浓,细胞核大,细胞排列紧密(图3A),此时观察到少量的体细胞胚(图3B)。随着单个胚性细胞进入分化期,胚性细胞的极性表现明显,顶细胞分裂形成多细
胞原胚(图3A),类似于合子胚发育形成的球形胚、鱼雷胚(图4A),球形胚繼续发育形成棒状胚(子叶胚)(图4B),该
类胚状体在MS0培养基上继续培养,可形成再生植株。
由表1可知,3个沿阶草种质中,不同激素配比对叶片基部愈伤组织诱导和体细胞胚发生存在显著差异。Nanus中,愈伤组织诱导和体细胞胚发生的最佳组合为0.5 mg/L 2,4-D、0.5 mg/L NAA、0.1 mg/L 6-BA,其愈伤组织诱导率和体细胞胚发生率分别为97%和94%;Arabicus的最佳组合为1.0 mg/L 2,4-D、0.1 mg/L NAA、0.1 mg/L 6-BA,其愈伤组织诱导率和体细胞胚发生率分别为94%和88%;而Wild最佳愈伤组织诱导和体细胞胚发生组合为0.5 mg/L 2,4-D、0.1 mg/L NAA、0.5 mg/L 6-BA,愈伤组织诱导率和体细胞胚发生率分别为98%和95%。
2.3 不同激素浓度配比对次生体细胞胚发生的影响
不同NAA和6-BA浓度7个组合获得的次生体细胞胚增殖试验结果见表2和图4C。观察到各种质初生体细胞胚中产生了许多次生胚状体,增殖系数最高达13.68,且不同种质不同组合对次生体细胞胚增殖系数存在显著差异。其中以0.5 mg/L NAA和2.0 mg/L 6-BA的组合效果最好,Nanus、Arabicus和Wild的增殖系数分别为11.60、13.68和8.16。
2.4 体细胞胚成熟和植株再生
将次生体细胞胚转接到以MS为基本培养基附加NAA 0.5 mg/L和6-BA 2.0 mg/L的培养基上培养25 d后,观察到大部分胚性愈伤组织表面上可直接发育成完整植株,但幼根不像正常根那样细长发绿,而是细而短、发白(图 4D)。此外,观察到一部分胚性愈伤组织上会继续产生次生体胚,还有一部分长0.5~1.0 mm的子叶胚,继代培养时次生体胚不再形成,视为成熟胚(图4D)。然后,将成熟胚转移到不添加植物激素的MS0培养基上,培养30 d后,发现有带叶和根的完整植株产生(图4E)。
2.5 再生苗的驯化
当再生苗在MS0培养基上生长3~4 cm 时,移去瓶盖。在离培养基表面3 mm用自来水浇灌再生植株,以适应环境。将驯化2~3 d的试管苗从培养基中冲洗干净,移栽到混合基质泥炭∶蛭石∶园土(3∶4∶3)中。将花盆移入温室进行生长(图4F)。共获得1 421株再生植株。
3 结论与讨论
沿阶草是重要的观赏兼药用经济植物,但其制种结实率低,传统的分离母株根状茎萌发繁殖方式效率低,需建立高效的沿阶草植株再生体系。体细胞胚只有生理上成熟才有萌发成再生植株的潜力[20],一般体细胞胚发生受植物的品种、外植体类型、植物激素、培养条件等诸多因素的影响[12-13,21-22]。该研究种质间比较发现,不同种质的沿阶草在不同条件下,愈伤组织诱导率和体细胞胚发生率存在显著差异,这与Wu等[23- 24]报道的结果一致。观察发现不同激素组合中,Wild的愈伤组织诱导率和体细胞胚发生率最高,最高分别为98%和95%,Arabicus最低,愈伤组织诱导率和体细胞胚发生率最高分别为94%和88%;相反,不同激素组合中,Arabicus次生体细胞胚增殖系数明显高于Wild,Arabicus增殖系数最高为13.68,而Wild增殖系数最高为8.16。
外植体是决定愈伤组织诱导、胚发生和植株再生的另一个重要因素。据报道,植物的叶、根、茎、下胚轴和花蕾等外植体具有形成愈伤组织、产生体细胞胚和再生植株的能力[24-26]。百合科百合以分生组织为外植体进行离体培养,并通过器官发生途径获得再生植株[7,11]。该研究发现,叶顶端、叶中部、根尖对植物激素诱导愈伤组织不敏感,而叶基部和幼茎可以形成愈伤组织,且愈伤组织诱导率最高。同时,诱导的愈伤组织能够通过体细胞胚发生再生植株。因此,叶基部和幼茎是沿阶草理想的植株再生和遗传转化的外植体材料。
植物激素在愈伤组织诱导、体细胞胚发生和植株再生中起着重要作用。植物激素的类型、水平和组合是影响愈伤组织形成、胚胎发生和植株再生的关键因素[11,13,21,24]。该研究结果表明,2,4-D具备决定沿阶草愈伤组织诱导、体细胞胚发生和次生胚形成的能力。此外,体细胞胚成熟只需要NAA和6-BA 2种植物激素,如果在培养基中添加2,4-D,发现很少有体细胞胚能够成熟和萌发。因此,笔者认为2,4-D是沿阶草愈伤组织的诱导与初生体细胞胚发生的关键因素。其次,胚的成熟和植株再生以及次生体细胞胚的形成与激素NAA和6-BA相关。该研究中,0.5 mg/L NAA+2.0 mg/L 6-BA的MS2培养基培养初生体细胞胚可获得8~13倍的次生体细胞胚。因此,利用以上方法可快速繁殖沿阶草种苗,从而满足市场需求。
此外,该研究还发现外植体在黑暗或昏暗的光照下均能形成愈伤组织,而在强光下难以形成。因此,笔者认为,沿阶草细胞、组织和器官的离体培养中,遮阴(弱光)条件是胚性愈伤组织形成的最佳光照条件。
该研究建立了高效的沿阶草体细胞胚发生再生体系,将为沿阶草离体快繁的工厂化种苗生产、种质资源保存、遗传转化和基因編辑研究奠定了基础。
参考文献
[1] 王冠明.麦冬种质资源与遗传多样性研究[D].北京:北京林业大学,2010.
[2] FANTZ P R.Names and species of ophiopogon cultivated in the southeastern United States[J].Horttechnology,2009,19(2):385-394.
[3] ZHANG Y Y,ZHAO Y Z,WU Y,et al.Ophiopogon saponin C1 inhibits lung tumors by stabilizing endothelium permeability via inhibition of pkcδ[J].International journal of biological sciences,2020,16(3):396-407.
[4] 王炳章.百合科植物的医疗保健功能[J].北方园艺,1998(1):56-58.
[5] WANG Y,ZHU Y Y,RUAN K F,et al.MDG-1,a polysaccharide from Ophiopogon japonicus,prevents high fat diet-induced obesity and increases energy expenditure in mice[J].Carbohydrate polymers,2014,114:183-189.
[6] BAILEY L H.The standard encyclopedia of horticulture:Vol 2[M].2nd ed.New York:The Macmillan Co,1942.
[7] STRANDBERG J O.Meristem culture of Ophiopogon japonicus and production of embryo-like structures[J].Plant cell,tissue and organ culture,1993,32(3):277-282.
[8] 丁久玲,郑凯.矮生沿阶草茎尖离体培养及其植株再生[J].江苏农业科学,2017,45(20):173-175.
[9] KUMAR S,TRIPATHI D,OKUBARA P A,et al.Purinoceptor P2K1/DORN1 enhances plant resistance against a soilborne fungal pathogen,Rhizoctonia solani[J].Frontiers in plant science,2020,11:1-10.
[10] 习洋,孙宇涵,李云.刺槐体细胞胚发生的同步化调控[J].河北大学学报(自然科学版),2020,40(3):283-290.
[11] KARALIJA E,TRBOJEVIC' S,PARIC A.Somatic embryogenesis and in vitro plantlet regeneration of Lilium martagon L.var.cattaniae Vis.[J].Biologica nyssana,2010,1(1/2):57-60.
[12] YAO R L,WANG Y.An advanced protocol for the establishment of plantlets originating from somatic embryos in Pinus massoniana[J].3 Biotech,2020,10(9):1-10.
[13] 吴丽芳,魏晓梅.不同因素对白刺花体细胞胚发育、成熟及萌发促进[J].分子植物育种,2020,18(12):4045-4052.
[14] 任海燕,杜学梅,李登科,等.枣幼胚体细胞胚的发生及植株再生[J].西北农业学报,2017,26(9):1349-1354.
[15] 李晶,孙吉雄,梁慧敏.日本矮生沿阶草愈伤组织的诱导及其分化[J].草业科学,2009,26(4):150-153.
[16] BAE K H,YOON E S.Callus induction and plant regeneration from Ophiopogon japonicus(L.f.)Ker Gawl in ornamental species[J].Korean journal of nature conservation,2013,7(1):35-41.
[17] 王化东,吴发明.麦冬花药离体培养与再生植株的获得[J].湖北农业科学,2012,51(12):2602-2603.
[18] KARAMIAN R,SHARIFZADEH A,RANJBAR M.Evidence of somatic embryogenesis for plantlet regeneration in Muscari neglectum Guss[J].African journal of agricultural research,2011,6(14):3247-3251.
[19] 廉玉姬,林光哲,赵小梅.朝鲜白头翁分生结节的诱导与组织解剖学观察[J].植物学报,2013,48(5):540-549.
[20] 李玲,桂明春,管艷,等.激素对橡胶树次生体细胞胚成熟培养的影响[J].中国农学通报,2015,31(31):30-35.
[21] 常英英,张启香,宋晓波,等.早实核桃体细胞胚发生和植株再生的影响因素研究[J].林业科学研究,2019,32(3):34-39.
[22] 岳建华,张梦帅,董艳,等.低温预处理对百子莲体细胞胚胎诱导的影响及生理机制研究[J].河南农业科学,2020,49(8):116-123.
[23] WU J H,ZHANG X L,NIE Y C,et al.Factors affecting somatic embryogenesis and plant regeneration from a range of recalcitrant genotypes of Chinese cottons(Gossypium hirsutum L.)[J].In vitro cellular & development biology plant,2004,40(4):371-375.
[24] DE SOUSA P C A,SOUZA S S S E,MEIRA F S,et al.Somatic embryogenesis and plant regeneration in Piper aduncum L[J].In vitro cellular & developmental biology plant,2020,56(5):618-633.
[25] 于波,黄丽丽,朱玉,等.朱顶红幼嫩花梗胚性愈伤组织诱导和高效植株再生[J].园艺学报,2020,47(5):907-915.
[26] WU G Y,WEI X L,WANG X,et al.Induction of somatic embryogenesis in different explants from Ormosia henryi Prain[J].Plant cell,tissue and organ culture,2020,142(2):229-240.
