颅眶联合入路切除海绵窦⁃眼眶沟通三叉神经鞘瘤
2021-01-04孙思康军赵尚峰邱锷李永史继桐马建民
孙思 康军 赵尚峰 邱锷 李永 史继桐 马建民
三叉神经鞘瘤在颅内肿瘤中较为少见,仅占颅内神经鞘瘤的0.07%~0.36%[1⁃2],其中起源于三叉神经第一支、经眶上裂与眼眶沟通的海绵窦神经鞘瘤是三叉神经鞘瘤的特殊类型,临床罕见,手术切除为主要治疗方法。首都医科大学附属北京同仁医院近6 年共收治23 例海绵窦⁃眼眶沟通三叉神经鞘瘤患者,均采用改良Dolenc 入路联合眶上入路即颅眶联合入路手术切除,本文对23 例患者的诊断与治疗经过进行回顾,并归纳总结海绵窦⁃眼眶沟通三叉神经鞘瘤的临床表现、组织病理特征、手术方法和功能结局,以为临床提供参考。
对象与方法
一、病例选择
1.诊断标准 (1)表现为眼球突出和(或)眼动障碍,伴视力下降,面部麻木。(2)影像学检查颅底三维CT 和MRI 显示肿瘤源自三叉神经第一支并累及眼眶⁃眶上裂⁃海绵窦,CT 呈等或低密度,边界清晰,呈“哑铃”形,骨窗可见眶上裂骨性结构被肿瘤颈部压迫吸收,呈扩大表现;MRI 呈T1WI 等或低混杂信号、T2WI 高信号,增强扫描病灶呈强化征象。
2.纳入与排除标准 (1)临床表现与影像学特征符合海绵窦⁃眼眶沟通三叉神经鞘瘤诊断标准。(2)均为单侧发病。(3)行颅眶联合入路手术,术后组织病理证实诊断。(4)排除神经纤维瘤病;肿瘤仅位于眼眶、累及颅后窝或未累及眼眶的神经鞘瘤;术后病理证实非神经鞘瘤。
3.一般资料 选择2013 年1 月至2019 年1 月在我院神经外科住院治疗的海绵窦⁃眼眶沟通三叉神经鞘瘤患者共23 例,男性10 例,女性13 例;年龄为13 ~ 69 岁,平均44.78 岁;病程1 ~ 240 个月,平均42.56 个月;均为单侧病变,病变位于左侧13 例(56.52%)、右侧10 例(43.48%)。临床主要表现为眼部症状,单侧视功能减退(视力下降)13 例(56.52%),其中有4 例视力低于眼前手动;单侧眼球突出19 例(82.61%);单侧眼动障碍和(或)上睑下垂5 例(21.74%);单侧面部疼痛2 例(8.70%)。颅底三维CT 和MRI 检查显示肿瘤源自三叉神经第一支,位于视神经内上方15 例(65.22%)、视神经外上方8 例(34.78%),均位于眼外肌肌锥内,并通过眶上裂与海绵窦外侧沟通。
二、治疗方法
1.经颅眶联合入路行眼眶⁃海绵窦沟通三叉神经鞘瘤切除术 患者仰卧头颈过伸位,头部向对侧旋转30°,气管插管全身麻醉,于发际内做弧形切口,切口内侧位于中线或向对侧延长2 cm、外侧达颧弓上缘(图1a),分离颞肌拉向下方,铣刀铣下额颞骨瓣,显露额颞部硬脑膜,咬骨钳和磨钻去除部分颞部和蝶骨翼骨质。谨慎分离硬脑膜与前颅底后部,高速磨钻磨开眶顶部至眶外侧壁骨质,铣刀铣下眉弓(额骨内侧至额骨颧突)骨瓣,若眶内肿瘤位于内上象限,则将眉弓骨瓣向内延伸至额骨鼻突,此时需磨开眶上孔以保护眶上神经血管束(图1b)。显微咬骨钳咬除眶顶和眶外侧骨质,充分显露眶上裂,向下显露至眶下裂和圆孔,向后磨开视神经管上壁骨质,显露视神经鞘,显微磨钻小心磨除并显微剥离子剥除前床突骨质。术中可见眶上裂和海绵窦前端硬脑膜隆起,缓慢释放脑脊液,待硬脑膜压力下降于眶上裂和眼眶骨膜交界处切开眶颞硬膜返折部浅层,向后牵拉颞部硬脑膜,充分分离眶尖与颞部硬脑膜,显露海绵窦前端,分开海绵窦外层与内层硬脑膜之间的潜在间隙,侵犯三叉神经第一支的肿瘤通常位于此间隙内,自海绵窦前端充分显露肿瘤,先分块囊内切除,待肿瘤体积缩小后再分离肿瘤与海绵窦神经和颈内动脉的包膜,向前探查至眶尖区域(图1c)。术中可见肿瘤眶内部分呈单一椭球状或分叶状,主要累及肌锥外间隙和肌锥内间隙,肌锥外肿瘤累及滑车上神经和额神经,切开眶骨膜即可见位于眶上象限的肿瘤,分离和切除肿瘤时注意保护滑车上神经和额神经、提上睑肌和上直肌;切除眶尖肿瘤时需注意保护滑车神经;肌锥内肿瘤主要源于鼻睫神经,切开眶骨膜后,分离上直肌⁃外直肌或上直肌⁃内直肌间隙,再切除肿瘤。术中除注意保护上述肌锥外神经和肌肉,还应根据肿瘤部位和大小,保护外侧泪腺神经和眼上静脉。牵拉上直肌、内直肌和外直肌向深部分离时,易损伤位于肿瘤表面的动眼神经上支,导致上睑下垂和眼球上视障碍;肿瘤深部包膜与视神经、眼动脉及分支粘连紧密,特别是肿瘤体积较大时,易损伤上述神经和血管,导致视力下降甚至失明;切除体积较大肿瘤时,易损伤外展神经、动眼神经下支和眶下静脉,造成眼动障碍。多发分叶状肿瘤由于眶内解剖结构复杂,更应注意每一层次眶内结构的保护。眶内肿瘤通常可完整摘除,但眶尖肿瘤直视下切除较困难,需借助显微镜分块切除(图2)。
2.疗效评价 (1)手术疗效评价:术后记录肿瘤切除率,包括全切除和近全切除,后者以肿瘤切除体积>95%计算。术后随访时观察临床症状改善情况,视力等级分为无光感、光感、眼前手动、眼前数指和眼前1 m 数指,并根据标准对数视力表检测视力;眼球突出程度采用眼球突出计进行测量,左右眼差值较术前改善程度≥1 mm 为好转;眼动、面部感觉等则根据术后体格检查判断是否较术前改善。(2)安全性评价:记录术后上睑下垂和眼动障碍、视力下降甚至失明、脑脊液漏,以及颅内血肿和颅内感染发生率。(3)随访:随访至术后1 年,复查眼眶三维CT 和MRI,观察有无肿瘤复发。

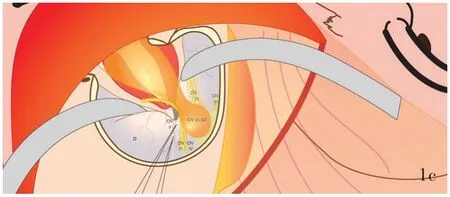
图1 经颅眶联合入路眼眶⁃海绵窦沟通三叉神经鞘瘤切除术示意图 1a 皮肤切口 1b 骨瓣移除范围 1c 显露肿瘤后所见肿瘤与脑组织、脑神经和眼外肌间关系Figure 1 Diagram of orbital⁃cranial approach surgery Skin incision (Panel 1a). Removal area of bone flap (Panel 1b). The exposed tumor and the relationship between the tumor and the brain, cranial nerves and extraocular muscles (Panel 1c).
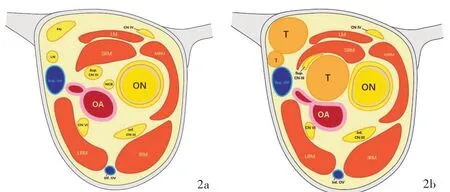
图2 眶尖区域冠状位剖面示意图 2a 正常眶尖区域 2b 眶尖区域三叉神经鞘瘤位于三叉神经第一支分支Figure 2 Diagram of the coronal section of the orbital apex area Normal orbital apex area (Panel 2a). Trigeminal neurinoma in the orbital apex area is located in the first branch of the trigeminal nerve (Panel 2b).
结 果
本组23 例患者中,肿瘤全切除20 例;近全切除3 例,均为海绵窦内粘连紧密残留;术后经组织病理证实为神经鞘瘤,其中6 例局部增生活跃(Ki⁃67 抗原标记指数为20%~40%)。(1)视力:术前单侧视功能减退(视力下降)者共13 例占56.52%,4 例视力低于眼前手动者,2 例术后恢复至眼前1 m 数指、2 例视力进一步下降(1 例无光感、1 例仅残留光感);其余9 例中有4 例视力改善、5 例视力进一步下降(3 例无光感、2 例仅残留光感);术后视力改善率为6/13。(2)眼球突出:19 例(82.61%)患者术后症状均明显改善。(3)眼动障碍或眼睑下垂:5 例(21.74%)术前眼动障碍和(或)上睑下垂患者中2 例术后恢复正常、3 例虽有所改善但仍残留眼动障碍。(4)面部疼痛:2 例(8.70%)单侧面部疼痛患者术后症状均有所好转。(5)并发症:本组患者术后均遗留三叉神经第一支和第二支分布区部分麻木感,经营养神经对症治疗后18 例明显好转、5 例无变化;有11 例术后新发眼动障碍但外展功能正常,经眼球运动锻炼,术后3 个月随访时6 例眼动恢复正常、5 例虽有所改善但仍残留眼动障碍。本组无一例发生脑脊液漏、颅内血肿和颅内感染,无死亡病例。随访1 年,随访期间颅底三维CT 和MRI 检查均未见肿瘤复发征象。
典型病例
例1女性患者,36 岁。因右侧眼球突出6 月余,于2018 年7 月6 日入院。患者入院前6 个月无明显诱因出现右侧眼球突出,无明显视力下降、眼动障碍和上睑下垂,无眼球肿胀感,无头皮麻木感,无头晕头痛、恶心呕吐,病程中眼球突出呈进行性加重。入院后体格检查:双侧瞳孔等大、等圆,直径约3 mm,对光反应灵敏,粗测视力正常,眼动正常,右侧眼球突出,无上睑下垂;面纹对称,听力正常;四肢肌力5 级、肌张力正常。影像学检查:眼眶CT显示,右侧眼眶⁃海绵窦沟通占位性病变,呈等密度,眶上裂扩大,海绵窦增宽。眼眶MRI 检查可见右侧眼眶与海绵窦旁沟通占位性病变,呈结节状长T1、长T2信号,信号欠均匀,边界清晰,约49 mm×16 mm×18 mm,右侧视神经受压移位,右侧眼球稍向前突(图3)。临床诊断:右侧三叉神经鞘瘤,遂于2018 年7 月9 日行右侧颅眶联合入路海绵窦⁃眼眶沟通占位性病变切除术,术后病理诊断为神经鞘瘤(图4)。术后予甘露醇250 ml/次(2 次/d)、甲泼尼龙80 mg/d(×3 天),共住院13 天。术后3 个月随访时眼眶CT和MRI 检查均未见肿瘤复发(图5)。继续随访至术后6 个月,仍无肿瘤复发。
例2女性患者,35 岁。因左侧眼球突出2 年,于2016 年10 月19 日入院。患者入院前2 年无明显诱因出现左侧眼球突出,无明显视力、眼动障碍和上睑下垂,无眼球肿胀感、头皮麻木感,无头晕头痛、恶心呕吐,眼球突出呈进行性加重。入院后体格检查:双侧瞳孔等大、等圆,直径约3 mm,对光反应灵敏,粗测视力正常,眼动正常,左侧眼球突出,无上睑下垂;面纹对称,听力正常;四肢肌力5 级、肌张力正常。影像学检查:眼眶MRI 检查可见左侧眼眶⁃海绵窦沟通占位性病变(图6)。临床诊断:左侧三叉神经鞘瘤,2016 年11 月7 日行左侧颅眶联合入路海绵窦⁃眼眶沟通占位性病变切除术,术后病理诊断:神经鞘瘤(图7)。予甘露醇250 ml/次(2 次/d)、甲泼尼龙80 mg/d(×3 天),住院30 天出院。于术后3 个月随访时眼眶MRI 检查未见肿瘤复发(图8)。
讨 论
三叉神经鞘瘤是起源于三叉神经根、半月结和三叉神经分支的良性肿瘤,分类方法有多种。其中以1999 年Yoshida 和Kawase[3]的六分类系统最为详细:M 型,包括起源于半月神经节或其海绵窦外侧壁分支的中颅底肿瘤;P 型,包括起源于三叉神经根的颅后窝肿瘤;E 型,包括起源于三叉神经颅外段分支的肿瘤;MP 型,包括颅中窝⁃颅后窝沟通“哑铃”形肿瘤;ME 型,包括颅中窝和颅外区域(眼眶、翼腭窝或颞下窝)的“哑铃”形肿瘤;MPE 型,包括跨颅后窝、颅中窝和颅外区域(眼眶、翼腭窝或颞下窝)的肿瘤。本组23 例均为源自三叉神经第一支的ME 型三叉神经鞘瘤,典型症状为单侧眼球突出和视力下降,患者常首诊于眼科。据文献报道,眼科良性肿瘤中神经鞘瘤发生率居第4 位[4]。三叉神经鞘瘤的诊断主要依靠影像学检查,特别是T2WI 和增强T1WI所显示的特征性影像,是公认的确诊方法[5]。手术完整切除肿瘤灶是治愈和防止复发的最佳方法,然而由于肿瘤位于颅底⁃海绵窦区域,解剖结构复杂、血管神经丰富,唯有根据肿瘤部位及其与邻近解剖结构的关系选择适宜的手术入路,才能实现全切除和术中对正常解剖结构的保护。
ME 型三叉神经鞘瘤多呈“哑铃”形,可累及眼眶⁃眶尖⁃海绵窦,需神经外科和眼科医师联合手术。传统手术入路为经眶⁃颞极入路,可较好地显露眶内肿瘤和海绵窦旁区,但该入路所显露的术野不能满足手术操作要求,使手术风险、并发症发生率和肿瘤残留率增加。随着神经内镜技术的发展,逐渐有眶外上侧入路联合内镜技术治疗颅眶沟通肿瘤的文献报道[6⁃8],特别是Dolenc[9]提出的经额颞硬膜外入路切除三叉神经鞘瘤的方式,骨质切除广泛、显露充分、可安全切除肿瘤而为临床普遍采用,海绵窦⁃眼眶沟通三叉神经鞘瘤患者则无需这种广泛性术野显露操作。早在2002 年,余新光等[10]即采用Dolenc 入路处理海绵窦区病变,去除前床突以切除眼眶⁃海绵窦沟通脑膜瘤。三叉神经第一支经眶上裂走行于海绵窦外侧壁两层硬脑膜之间,外层为脑膜层、内层为骨膜层[11],第Ⅲ对和第Ⅳ对脑神经走行于两层之间,且与颈内动脉关系密切,这种解剖结构是颅眶联合入路手术的解剖学基础[12]。本研究采用的颅眶联合入路切口为传统额颞切口,取出额颞和眉弓骨瓣后,显露眼眶上部和额颞部硬脑膜,采取去除前床突的硬膜外入路,这样可以扩大动眼神经⁃颈动脉三角范围,使视神经显露长度增加2 倍,从而极大地增加了手术操作过程中神经的柔韧性和耐受度,从而获得更好的神经保护和海绵窦前端的良好术野显露,特别是三叉神经第一支入眶尖区域[13],而且该入路未直接打开硬脑膜,可避免损伤颅内结构和颈内动脉[14],安全性更高。本组病例术中无一例发生颞部医原性损伤、脑脊液漏和颈内动脉损伤。此外,肿瘤经眶上裂进入眼眶后,走行于眶骨膜内,与肌锥内眶尖段视神经和眼动脉关系密切,采取额颞入路可自上方显露眼眶外上方区域,也为眼科医师提供了极为宽广的上方术野和手术操作空间,对眶内肿瘤的切除和眶内结构的保护具有重要意义。值得强调的是:颅眶联合入路需神经外科与眼科配合,神经外科医师应掌握Dolenc 入路的解剖学知识和熟练的显微操作技术;而这种自上方切除眼眶肿瘤的方式较少在眼科疾病的外科手术中应用,对眼科医师是一种挑战,尤其是切除眶上裂交界区肿瘤时,需二者默契配合。此外,该术式的开颅手术切口隐蔽,从而避免眶外侧入路造成面部皮肤切口和术后瘢痕形成的缺陷[15]。
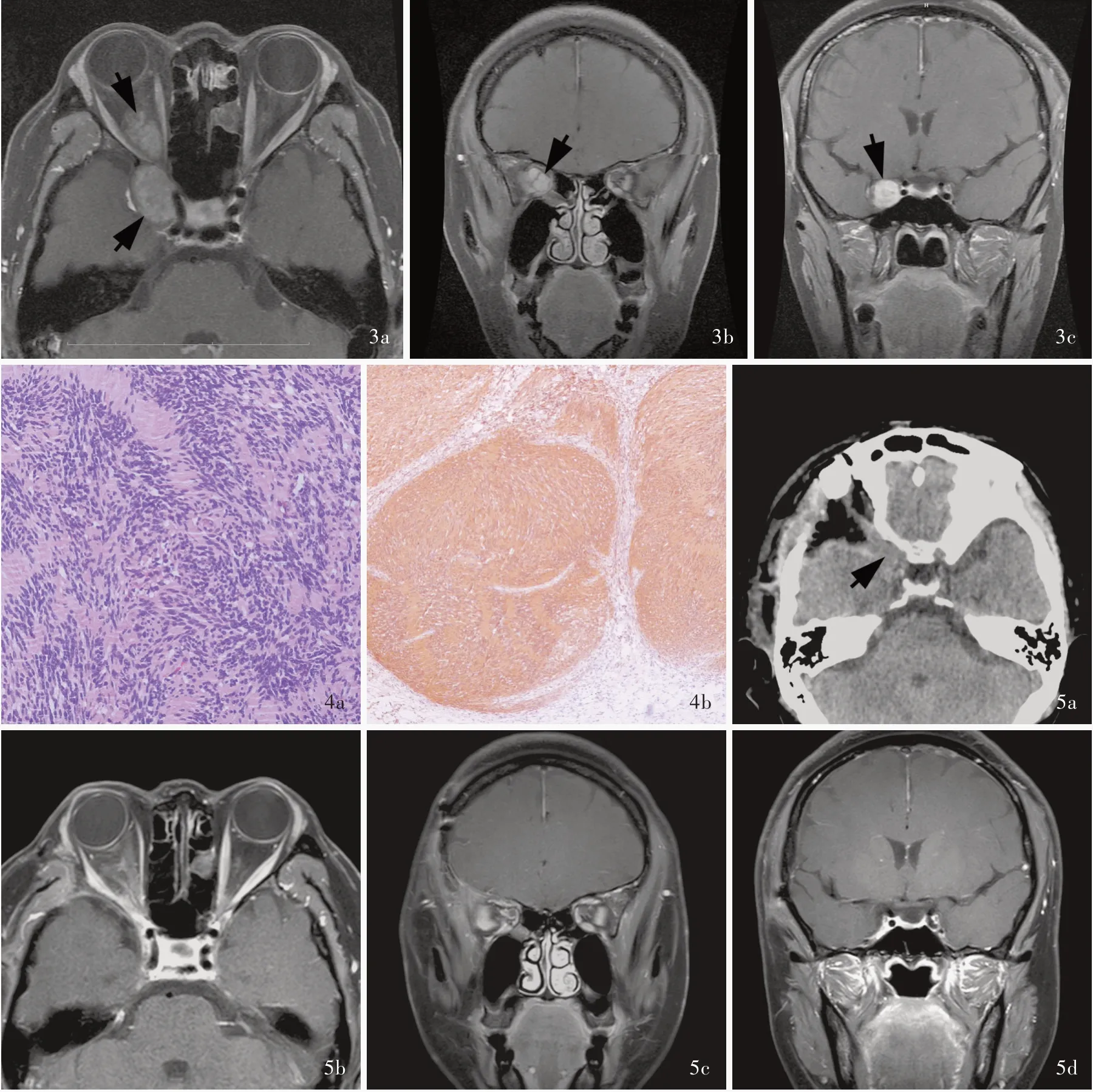
图3 术前眼眶MRI 检查所见 3a 横断面增强T1WI 显示,肿瘤位于右侧眶尖⁃海绵窦区域(箭头所示),经眶上裂沟通3b 冠状位增强T1WI 显示肿瘤充满眶尖内(箭头所示) 3c 冠状位增强T1WI 显示肿瘤位于右侧海绵窦外侧壁(箭头所示) 图4 术后组织病理检查所见 ×100 4a 肿瘤细胞组织学形态呈梭形,“栅栏”状排列 HE 染色 4b 肿瘤细胞强阳性表达S⁃100 蛋白 免疫组化染色(EnVision 二步法) 图5 术后3 个月眼眶部影像学检查所见 5a 横断面CT 显示前床突切除(箭头所示) 5b 横断面增强T1WI 显示眶尖⁃海绵窦区病灶消失,眶尖正常结构恢复 5c 冠状位增强T1WI 显示,眶尖内肿瘤完全切除,眶尖正常结构已恢复 5d 冠状位增强T1WI 显示海绵窦肿瘤完全切除Figure 3 Preoperative orbital MRI findings Axial enhanced T1WI showed the tumor was located in the right orbital apex⁃cavernous sinus region (arrows indicate) and communicated through the superior orbital fissure (Panel 3a). Coronal enhanced T1WI showed the orbital apex was full of tumors (arrow indicates, Panel 3b). Coronal enhanced T1WI showed the tumors were located on the lateral wall of the right cavernous sinus (arrow indicates, Panel 3c). Figure 4 Postoperative pathological examination findings ×100 The histological morphology showed that the tumor cells were fusiform shaped and arranged in a palisade arrangement (Panel 4a). HE staining Tumor cells strongly positively expressed S ⁃ 100 protein (Panel 4b).Immunohistochemical staining (EnVision) Figure 5 Orbital CT and MRI findings at 3 months after operation Axial CT showed the anterior clinoid was removed (arrow indicates, Panel 5a). Axial enhanced T1WI showed the lesions in the primary orbital apex⁃cavernous sinus area disappeared and the normal structure of the orbital apex was restored (Panel 5b). Coronal enhanced T1WI showed the orbital apex tumor was completely removed and the normal structure of the orbital apex was restored (Panel 5c). Coronal enhanced T1WI showed complete resection of cavernous sinus tumor (Panel 5d).

图6 术前眼眶MRI 检查所见 6a 冠状位增强T1WI 显示,肿瘤位于左侧眶尖外上区域,压迫眶尖结构,呈不均匀强化(箭头所示) 6b 冠状位增强T1WI 显示,病变累及左侧海绵窦,呈均匀强化(箭头所示) 6c 横断面增强T1WI 显示肿瘤位于左侧眼眶⁃海绵窦区域,经扩大的眶上裂沟通(箭头所示)Figure 6 Preoperative orbital MRI findings Coronal enhanced T1WI showed the tumor was located in the upper and outer quadrant of the left orbital apex which was full of tumors compressing tissue of orbital apex with heterogeneous enhancement(arrow indicates, Panel 6a). Coronal enhanced T1WI showed the lesion involved left cavernous sinus, with regularly enhancement (arrow indicates, Panel 6b). Axial enhanced T1WI showed the tumor was located in left orbit⁃cavernous sinus region and communicated through the enlarged superior orbital fissure (arrow indicates, Panel 6c).
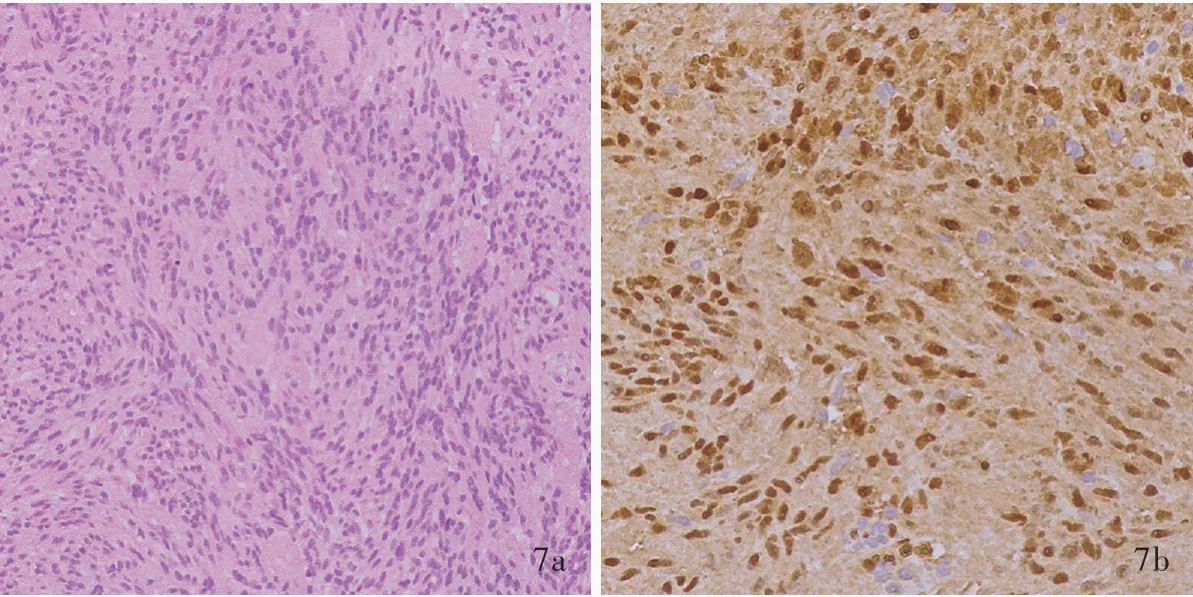
图7 术后组织病理检查所见 × 100 7a 肿瘤细胞组织学形态呈梭形,“栅栏”状排列,局灶性细胞增生活跃 HE染色 7b 肿瘤细胞表达S⁃100 蛋白免疫组化染色(EnVision 二步法)Figure 7 Postoperative pathological examination findings × 100 The histological morphology showed that the tumor cells were fusiform shaped and arranged in a palisade arrangement, and focal cell proliferation activity was seen(Panel 7a). HE staining Tumor cells positively expressed S⁃100 protein (Panel 7b). Immunohistochemical staining(EnVision)
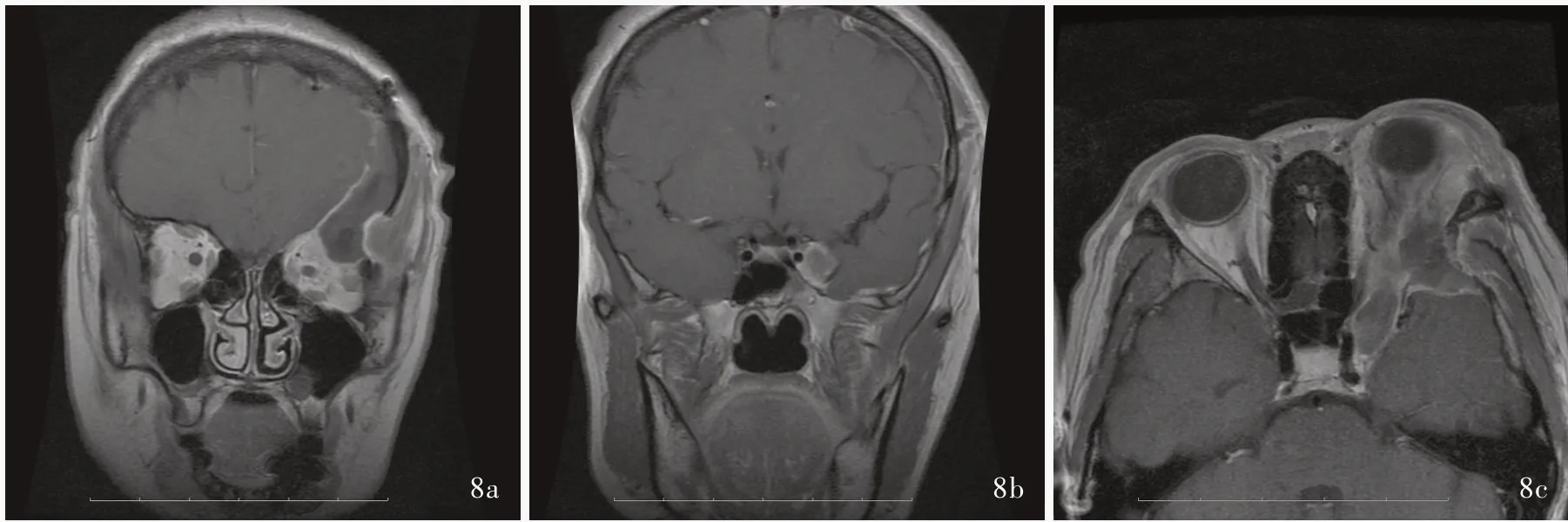
图8 术后3 个月眼眶MRI 检查所见 8a 冠状位增强T1WI 显示,眶尖区病变全切除 8b 冠状位增强T1WI 显示,海绵窦区病变全切除 8c 横断面增强T1WI 显示左侧眼眶⁃海绵窦区域病变全切除Figure 8 Orbital MRI findings at 3 months after operation Coronal enhanced T1WI showed the orbital apex lesion was completely removed (Panel 8a). Coronal enhanced T1WI showed complete resection of cavernous sinus lesion (Panel 8b).Axial enhanced T1WI showed the left orbital⁃cavernous sinus lesion had been removed (Panel 8c).
经颅眶联合入路行三叉神经鞘瘤切除术,由于眼部并发症常与颅内并发症叠加,故其术后并发症发生率与传统的经眶⁃颞极入路并无差异。本组患者术后面部疼痛感均有所改善,但仍遗留面部麻木感,与文献报道相似[16]。Wanibuchi 等[17]认为,若术中保留正常神经纤维,有可能降低面部麻木发生率和不适感。对于体积较大的眶内三叉神经鞘瘤,由于肿瘤包膜与眶尖神经、血管粘连紧密,易造成肿瘤残留而致视力下降或眼动障碍等后遗症。本组有13 例术前即存在视力下降患者,7 例术后视力进一步下降,发生率达7/13,术前眼眶影像学检查可见眶内肿瘤体积较大,位于肌锥内,与视神经关系密切,术中可见肿瘤包膜与眼动脉和视神经粘连,提示术前即存在视功能损害的患者术后视力进一步下降甚至失明的风险较大。5 例术前即存在眼动障碍和(或)上睑下垂的患者,2 例术后恢复正常、3 例虽有改善但仍残留眼动障碍;23 例中11 例术后新发眼动障碍,术前眼眶影像学检查和术中所见均证实肿瘤与动眼神经粘连紧密,6 例为术中牵拉眼外肌致短暂性眼动障碍、5 例为手术相关性眼动障碍恢复欠佳,主要是由于肿瘤与滑车神经和动眼神经伴行较长且肿瘤与眼外肌粘连紧密,极易损伤,此与文献报道的眶内神经鞘瘤切除术后出现类似并发症的原因一致[15]。颅眶联合入路一次手术即可切除眶内和海绵窦肿瘤,全切除率较高,但体积较大者仅可近全切除,如果残留肿瘤出现生长趋势,可采取放疗联合同步化疗[18]。
综上所述,海绵窦⁃眼眶沟通三叉神经鞘瘤发生率较低,神经外科与眼科合作施行手术切除尚无文献报道,若进行两次手术,难免造成叠加的手术并发症和额外的手术切口,以及肿瘤残留。本研究采用经颅眶联合入路手术切除海绵窦⁃眼眶沟通三叉神经鞘瘤具有术野开阔、手术创伤小、切除彻底、不增加手术并发症等优点,有利于保护动眼神经、外展神经、滑车神经和颈内动脉,值得临床推广应用。
利益冲突无
