蛋白激酶N1 对脑胶质瘤生物学行为的影响
2021-01-04郝玉冰张安玲王虎王广秀高照贾志凡
郝玉冰 张安玲 王虎 王广秀 高照 贾志凡
脑胶质瘤是一种由多基因、多因素诱发的原发性中枢神经系统肿瘤,在遗传学、组织学和临床特征方面存在异质性。胶质母细胞瘤(GBM)是原发性恶性胶质瘤中最为常见的类型,具有较强的侵袭性和增殖能力,患者预后差、病死率高[1⁃3]。胶质瘤的侵袭特性和某些基因如O6⁃甲基鸟嘌呤⁃DNA 甲基转移酶(MGMT)引起的耐药性使现有治疗方法难以达到临床治愈效果[4],因此从基因水平寻找新的治疗靶点是当前研究的重点。蛋白激酶N1(PKN1)是一种丝氨酸/苏氨酸激酶(AKT),与乳腺癌、前列腺癌、胰腺癌、膀胱癌等多种肿瘤的发生与发展密切相关[5⁃7],PKN1 基 因 可 在 雄 激 素 的 参 与 下 调 节 前 列腺癌细胞增殖、细胞集落形成[7⁃8],并参与宫颈癌细胞肌动蛋白骨架形成和肿瘤细胞增殖[9]。动物实验显示,PKN1 蛋白广泛表达于大鼠脑组织,对多巴胺能、5⁃羟色胺能和胆碱能神经元的生物学行为有一定影响[10],同时,PKN1 基因还在小脑平行纤维形成、轴突生长与突触分化平衡的调节过程中发挥重要作用[11]。然而,目前关于PKN1 在中枢神经系统肿瘤中的作用较少受到关注,本研究采用GEPIA 数据库检索PKN1 基因在正常脑组织和胶质瘤组织中的表达情况,通过干扰RNA 敲低胶质瘤细胞系A172 细胞株PKN1 基因表达观察肿瘤细胞生物学行为的改变,以期为胶质瘤基因治疗提供理论依据。
材料与方法
一、实验材料
1. PKN1 基因数据来源 登录GEPIA 数据库(http://gepia.cancer-pku.cn/)检索PKN1 基 因,获 得PKN1 基因在正常脑组织和胶质瘤组织中的表达分布图并可直接使用,在“Expression DIY”功能区选择“Boxplot”,自动生成正常脑组织和胶质瘤PKN1 基因表达箱式图。
2.细胞系来源 胶质瘤细胞系LN229、U87 和A172 细胞株由天津医科大学总医院神经病学研究所神经肿瘤实验室提供;PKN1 小干扰RNA(siRNA)载体为腺病毒,购于中国上海吉玛制药技术有限公司。上述胶质瘤细胞株和腺病毒均置于⁃80 ℃冰箱保存备用。
3. 试剂与仪器 (1)主要试剂:RIPA 工作液[RIPA 与苯甲基磺酰氟(PMSF)体积比为100 ∶1]和Western blotting 检测试剂盒购自上海索莱宝生物技术公司;DMEM 高糖培养基和胎牛血清(FBS)由美国Gibco 公司提供;细胞培养箱为德国Heraeus 公司产品;转染剂Entranster⁃R4000 购自中国Engreen 公司。PKN1 siRNA 由上海吉玛制药技术公司提供,包 括 无 意 义 siRNA (siRNA ⁃ NC: 5’ ⁃UUCUCCGAACGUGUCACGUTT⁃3’)和siRNA⁃PKN1(5’⁃AAGGGCACGGGAACTGGAGTT⁃3’)。Ⅰ抗工作液(PKN1 与质量分数为5%脱脂牛奶体积之比为1 ∶1000)和Ⅱ抗 工 作 液[甘 油 醛⁃3⁃磷 酸 脱 氢 酶(GAPDH)与磷酸盐缓冲液(PBS)的体积之比为1 ∶10 000]为美国Santa Cruz 公司产品;增强型化学发光液购自美国Millipore 公司;CCK⁃8 检测试剂盒为日本同仁公司产品;Annexin V⁃异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡检测试剂盒由上海爱必信生物科技公司提供;胰酶细胞消化液、焦碳酸二乙酯处理(DEPC)管、DEPC 水和Transwell 小室均为美国Corning 公司产品;Matrigel 基质胶购自美国BD公司。(2)主要仪器:L500 型小型离心机由中国湘仪公司提供;5417R 型4 ℃高速离心机为中国香港基因有限公司产品;6Box iChemi XT 凝胶成像系统购自美国Syngene 公司;IX81 型光学倒置相差显微镜由日本Olympus 公司提供;PowerPac 电泳仪由美国Bio⁃Rad 公 司 生 产;SN258642 型 酶 标 仪 购 自 美 国BioTek 公司。
二、研究方法
1. 细胞培养 胶质瘤细胞系LN229、U87 和A172 置37 ℃水浴锅复苏5 min,离心半径10 cm、800 r/min 离心5 min,去上层冻存液;加入含体积分数为10%胎牛血清的DMEM 培养基充分混匀,转移至新的细胞培养皿摇匀,置37 ℃、含5%二氧化碳(CO2)恒温箱培养,隔夜更换培养基。细胞达75%~90%融合时消化处理传代,传至第3 代时用于细胞转染实验。
2. 干扰RNA 敲低胶质瘤细胞系A172 细胞PKN1 基因表达实验 实验前24 h 将胶质瘤细胞系A172 细胞铺种于6 孔板,细胞数为200×103个/孔,细胞融合达60%~70%时转染携带siRNA 序列腺病毒,于首次转染验证性实验中加入空白对照组,以排除腺病毒对A172 细胞的影响。敲低实验分为siRNA⁃NC 组(对照组)和siRNA⁃PKN1 组(实验组),两组各有2 支200 μl DEPC 管,每管均加入无血清DMEM 培 养 液50 μ l,其 中 一 管 滴 加 转 染 剂Entranster⁃R4000 5 μl,另一管则滴加siRNA 工作液(1 OD 的siRNA 粉末以125 μl DEPC 水溶解)5 μl,于室温静置5 min,每组两管充分混匀,于室温静置15 min,更换为含10%胎牛血清的DMEM 培养基,然后分别加入转染工作液,摇匀,置于37 ℃、含5%二氧化碳的培养箱中,6~8 h 后更换培养液,培养48 h备用。
3. Western blotting 法检测PKN1 蛋白表达变化 分别检测LN229、U87、A172 胶质瘤细胞和敲低PKN1 基因后A172 细胞PKN1 蛋白表达量。肿瘤细胞去除培养基后以4 ℃预冷PBS 1 ml 洗涤2 次,滴加RIPA 工作液(RIPA 与PMSF 体积之比为100 ∶1)150~200 μl/孔,并充分铺匀培养皿底部,置于冰上裂解30 min,收集细胞裂解液,于4 ℃、离心半径为10 cm、2000 r/min 离心10 min,取上清蛋白质原液,酶标仪测定蛋白质原液光密度(OD)值并计算总蛋白含量(总蛋白含量=1.494×OD-0.283),滴加适量4×蛋白上样缓冲液(缓冲液与蛋白原液体积比为1 ∶3),水浴 煮沸5 min,分装于1.50 ml EP 管中(150 μl/管),置⁃80 ℃保存备用。将备用细胞蛋白液行SDS⁃PAGE,蛋白质移至PVDF 膜,37 ℃、质量分数为5%脱脂牛奶封闭1 h,根据蛋白质相对分子质量剪膜,滴加Ⅰ抗工作液(PKN1 与5%脱脂牛奶体积之比为1 ∶1000),4 ℃过夜,恢复至室温,滴加Ⅱ抗工作液(GAPDH 与PBS 体积比为1 ∶10 000),室温下摇床慢摇1 h,滴加1 ml 增强型化学发光液,于曝光仪上检测目的蛋白印迹,Image J 软件测定电泳条带灰度值,以GAPDH 为内参照物,计算目的蛋白相对表达量。
4.敲低PKN1 基因表达观察胶质瘤细胞生物学行为变化 通过干扰RNA 敲低胶质瘤细胞系A172细胞株PKN1 基因表达,观察肿瘤细胞增殖、凋亡、迁移和侵袭能力。(1)CCK⁃8 实验检测细胞增殖能力:将处于对数生长期的A172 细胞接种于6 孔板并使细胞数达200×103个/孔,隔夜,确保每孔细胞融合达60%~75%再行siRNA 转染,置于37 ℃、含5%二氧化碳培养箱培养48 h。将siRNA⁃NC 组和siRNA⁃PKN1 组A172 细胞接种于96 孔板,细胞数为2×103个/孔,待细胞完全贴壁后行CCK⁃8 实验。肿瘤细胞去培养基,滴加100 μl 无血清DMEM 培养液,再滴加10 μl CCK⁃8 试剂,置37 ℃、含5%二氧化碳的培养箱培养1 h,酶标仪上于450 nm 波长测定OD 值,连续检测6 d。(2)流式细胞术检测细胞凋亡变化:采用胰酶细胞消化液消化处理siRNA⁃NC 组和siRNA⁃PKN1 组A172 细 胞,Binding Buffer 试 剂(凋亡检测试剂盒)使细胞重悬于1.50 ml EP 管,细胞数为50×103个/管,滴加Annexin V⁃FITC 5 μl/管,室温静置10 min,滴加5 μl PI,室温静置5 min,流式细胞仪上检测肿瘤细胞凋亡程度,并计算细胞凋亡率(右上象限和右下象限细胞所占比例)。(3)细胞划痕实验检测细胞迁移能力:将siRNA⁃NC 组和siRNA⁃PKN1 组A172 细胞接种于6 孔板,细胞数为250×103个/孔,37 ℃、含5%二氧化碳培养箱中培养过夜,使细胞融合达75%~80%;再以200 μl 无菌枪头尖部在6 孔板中划“十”字,去培养基,加入无血清DMEM 培养液,以首次划痕拍照计为0 h,此后每12 小时拍照1 次,记录划痕面积并计算划痕愈合率[划痕愈合率(%)=(0 h 划痕面积-测量时划痕面积)/0 h 划痕面积×100%],后者即为肿瘤细胞迁移能力。(4)Transwell 实验检测细胞侵袭能力:将Transwell 小室置于24 孔板,小室中铺Matrigel 基质胶60 μl,使无血清DMEM 培养基与Matrigel 基质胶体积之比达3 ∶1,置于37 ℃、含5%二氧化碳的培养箱中培养30 min,待Matrigel 基质胶凝集,上室滴加无血清DMEM 培养基200 μl,其中包含转染的A172细胞(siRNA⁃NC 组和siRNA⁃PKN1 组细胞数各30×103个),下室滴加含10%胎牛血清DMEM 培养基,置于37 ℃、含5%二氧化碳培养箱培养24 h,取出小室,蒸馏水清洗,以体积分数为4%多聚甲醛溶液固定20 min,蒸馏水清洗,以体积分数为0.4%结晶紫染色20 min,于光学显微镜(×100)下选择任意4 个视野,计数细胞穿膜数目,取平均值,即为肿瘤细胞侵袭能力。
5.统计分析方法 采用GraphPad PRISM 6.0 软件进行数据处理与统计分析。呈正态分布的计量资料以均数±标准差(±s)表示,采用两独立样本的t 检验或单因素方差分析,两两比较行LSD⁃t 检验;siRNA⁃NC 组与siRNA⁃PKN1 组A172 细 胞不同观察时间点划痕愈合率的比较采用重复测量设计的方差分析,两两比较行LSD⁃t 检验。以P ≤0.05为差异具有统计学意义。
结 果
经检索GEPIA 数据库发现,PKN1 mRNA 在多种肿瘤组织中的表达量均高于正常组织,其中,胶质母细胞瘤PKN1 mRNA 表达量高于正常脑组织,详见图1。
Western blotting 法检测显示,不同胶质瘤细胞系PKN1 蛋白相对表达量差异具有统计学意义(P=0.002,表1),其中A172 细胞PKN1 蛋白相对表达量高于U87 细胞(t = 3.096,P = 0.036)和LN229 细胞(t=8.994,P=0.000),而U87 细胞与LN229 细胞之间PKN1 蛋白相对表达量差异无统计学意义(t =2.511,P = 0.066;图2)。敲 低PKN1 基 因 表 达 后,A172 细胞PKN1 蛋白相对表达量低于空白对照组(t = 48.010,P = 0.000)和siRNA⁃NC 组(t = 43.770,P=0.000),而siRNA⁃NC 组与空白对照组之间差异无统计学意义(t=0.888,P=0.425;图3,表2)。
敲低PKN1 表 达第1 和2 天,siRNA⁃PKN1 组 与siRNA⁃NC 组胶质瘤细胞增殖能力差异无统计学意义(均P>0.05);第3~6 天,siRNA⁃PKN1 组胶质瘤细胞增殖能力低于siRNA⁃NC 组且差异具有统计学意义(P=0.031,0.004,0.000,0.003;表3)。
敲低PKN1 基因表达后发现,A172 细胞凋亡率为23.90% ~ 28.20%、平 均 为(26.66 ± 1.39)%,而siRNA⁃NC 组A172 细胞凋亡率为16.33%~19.01%、平均(17.90±0.81)%,组间差异具有统计学意义(t=5.461,P=0.006;图4)。
随着时间推移,siRNA⁃NC 组和siRNA⁃PKN1 组A172 细胞划痕愈合率逐渐增加(P=0.000),其中,12 h(P=0.001,0.000)和36 h(P=0.000,0.000)A172细胞划痕愈合率高于0 h,36 h 划痕愈合率亦高于12 h(P=0.001,0.017);而敲低PKN1 基因表达后,A172 细胞划痕愈合率低于siRNA⁃NC 组(P=0.000;图5;表4~6)。
敲 低PKN1 基因 表 达 后,siRNA⁃PKN1 组A172细胞的穿膜数目为17 ~ 18 个、平均为(17.330 ±0.577)个,而siRNA⁃NC 组A172 细胞的穿膜数目为26~33 个、平均(29.330±3.512)个,组间差异具有统计学意义(t=5.840,P=0.004;图6)。
讨 论
胶质瘤是颅内常见的原发性恶性肿瘤之一,其发生与发展由多基因、多因素所引起,并且肿瘤的侵袭性和相关基因诱发的耐药性使治疗愈发困难,患者生存率较低。PKN1 基因可参与多种肿瘤的发生与发展,例如可以通过PKN1⁃WDR5⁃KAT8 和PKN1⁃H3T11P⁃WDR5⁃H3K4me3 信号转导通路调节前 列 腺 癌 细 胞 的 增 殖[7⁃8],亦 可 以 与GTP 酶Rho 结合从而发挥相应的生物学功能[12⁃13]。
GEPIA 数据库涵盖大量基因数据,可从中寻找到许多基因的差异体和相似体,也可检索到某一基因在正常组织及其相应肿瘤组织中的相对表达量,以及该基因相对表达量与肿瘤级别的相关性,从而预测该基因与肿瘤之间的关系。通过检索GEPIA数据库可以发现,PKN1 mRNA 在胶质瘤、前列腺癌、卵巢癌等多种肿瘤组织中的表达量明显高于其所对应的正常组织,提示PKN1 可能为胶质瘤相关基因,但该基因在胶质瘤恶性进展中的作用目前尚不明确。
对多 个 胶 质 瘤 细 胞系(U87、LN229 和A172)PKN1 蛋白表达量的分析显示,以胶质瘤A172 细胞PKN1 蛋白相对表达量最高,因此,后续研究可采用RNA 干扰(RNAi)技术敲除A172 细胞PKN1 基 因,以观察该基因对A172 细胞生物学行为的影响。
细胞增殖能力可直接反映肿瘤细胞活力,本研究CCK⁃8 实验显示,敲低PKN1 基因表达后第3 天,A172 细胞增殖能力明显受到抑制,并可以持续至第6 天,表明下调胶质瘤细胞PKN1 基因表达可抑制肿瘤细胞增殖。细胞凋亡是基因调控的细胞程序性死亡形式[14],肿瘤细胞凋亡受到抑制,可促进肿瘤生长,也可使肿瘤细胞发生耐药[15]。本研究流式细胞术检测显示,敲低PKN1 基因表达后,A172 细胞凋亡率增加,表明下调胶质瘤细胞PKN1 基因表达可诱导肿瘤细胞凋亡,进而抑制胶质瘤进展。迁移和侵袭能力是肿瘤细胞的另一生物学特性,与肿瘤恶性程度和预后直接相关,本研究采用细胞划痕实验检测肿瘤细胞迁移能力,其结果显示,siRNA⁃PKN1组和siRNA⁃NC 组A172 细胞划痕愈合率随时间推移具有不同程度增加,而敲低PKN1 基因表达后A172细胞划痕愈合率降低且低于siRNA⁃NC 组,表明下调胶质瘤细胞PKN1 基因表达可以抑制胶质瘤细胞迁移;与此同时,Transwell 实验显示,敲低PKN1 基因表达后,A172 细胞穿过Matrigel 基质胶的数目明显减少,表明下调胶质瘤细胞PKN1 基因表达可抑制胶质瘤细胞的侵袭性。
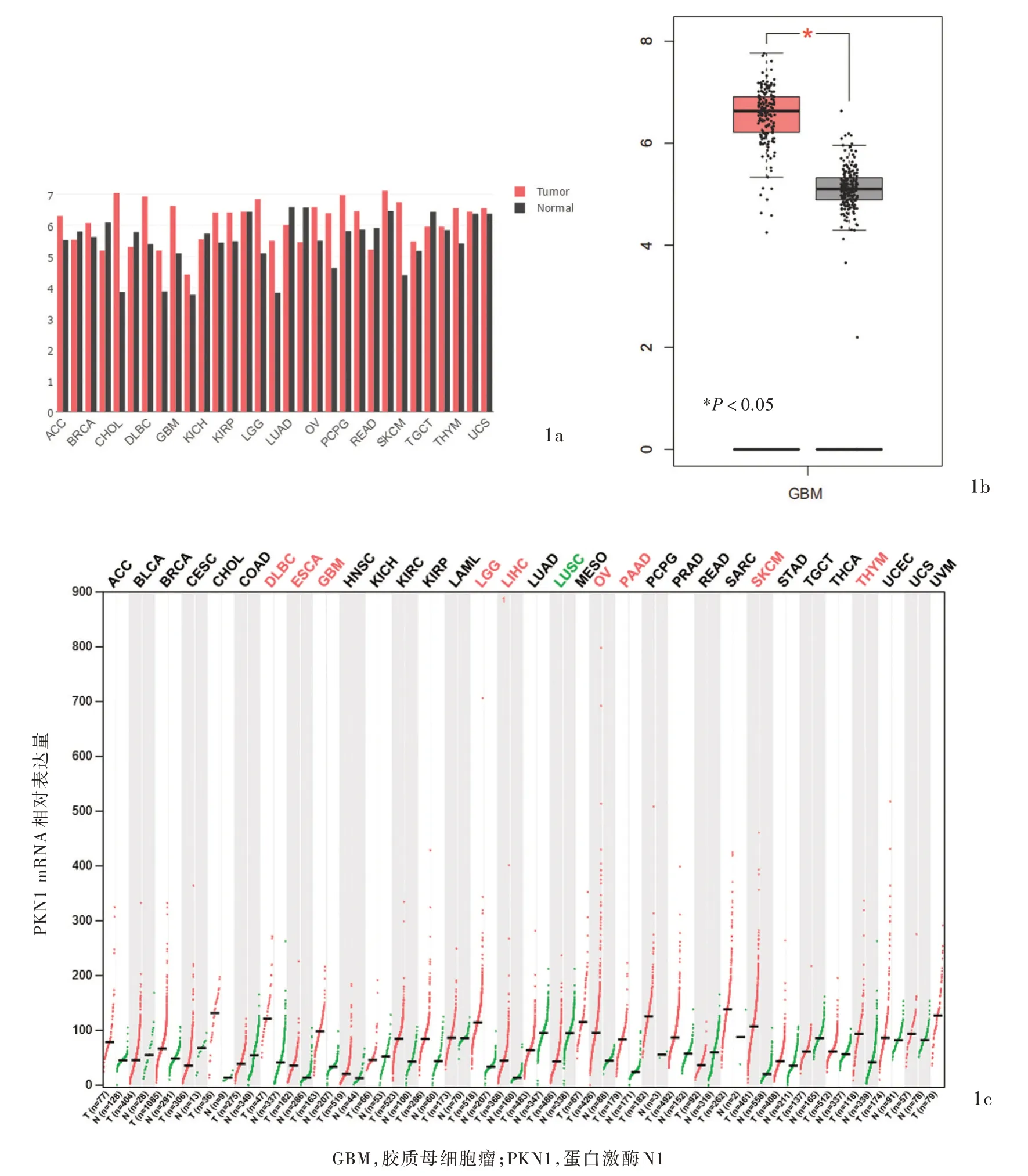
图1 GEPIA 数据库PKN1 mRNA 表达量 1a 多种肿瘤组织及其对应的正常组织PKN1 基因表达谱 1b 胶质母细胞瘤(163 例)PKN1 mRNA 表达量高于正常脑组织(207 例,P<0.05) 1c 所有肿瘤组织及其对应的正常组织PKN1 基因表达谱(每点代表样本表达量)Figure 1 Expression of PKN1 mRNA in the GEPIA database The PKN1 gene expression profile across some tumor samples and paired normal tissues (Panel 1a). The expression of PKN1 mRNA in glioblastoma (163 cases)was higher than that in normal brain tissue (207 cases, P < 0.05; Panel 1b). The PKN1 gene expression profile across some tumor samples and paired normal tissues (Each dot represents expression of samples, Panel 1c).
表1 不同胶质瘤细胞系PKN1 蛋白相对表达量的比较(±s)Table 1. Relative expression of PKN1 in glioma cell lines (±s)
组别A172 细胞U87 细胞LN229 细胞F 值P 值例数3 3 3 PKN1 蛋白相对表达量0.95±0.09 0.69±0.12 0.51±0.01 20.180 0.002
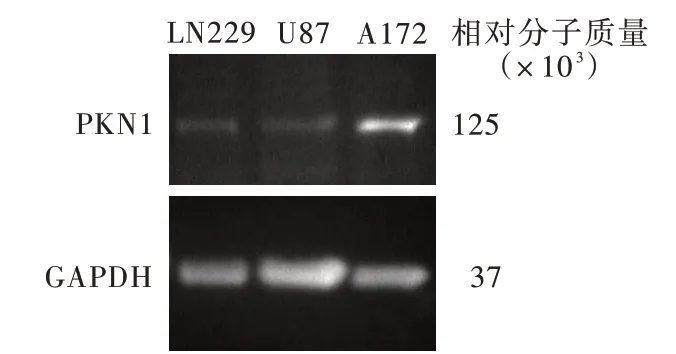
图2 Western blotting 法检测显示,A172 细胞PKN1 蛋白相对表达量高于U87 和LN229 细胞Figure 2 Western blotting showed the PKN1 protein expression in A172 cells was higher than that in U87 and LN229 cells.
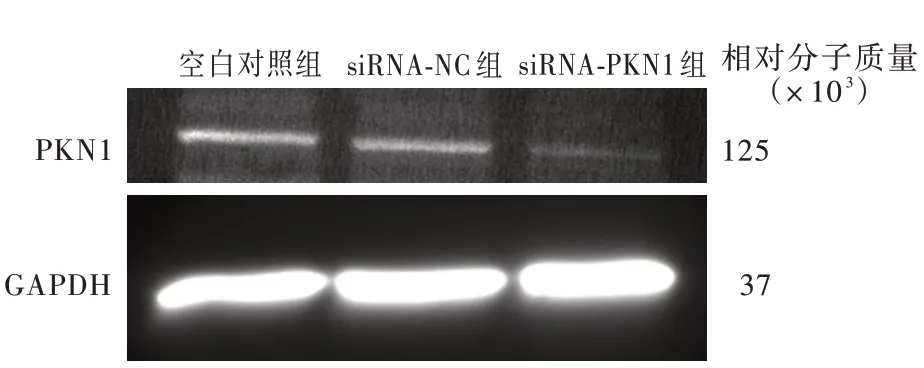
图3 Western blotting 法检测显示,转染siRNA⁃PKN1 后A172细胞PKN1 蛋白相对表达量降低Figure 3 Western blotting showed the expression of PKN1 in A172 cells after siRNA⁃PKN1 transfection was reduced.
表2 不同组别A172 细胞PKN1 蛋白相对表达量的比较(±s)Table 2. Relative expression of PKN1 in blank group,siRNA⁃NC group and siRNA⁃PKN1 group (±s)
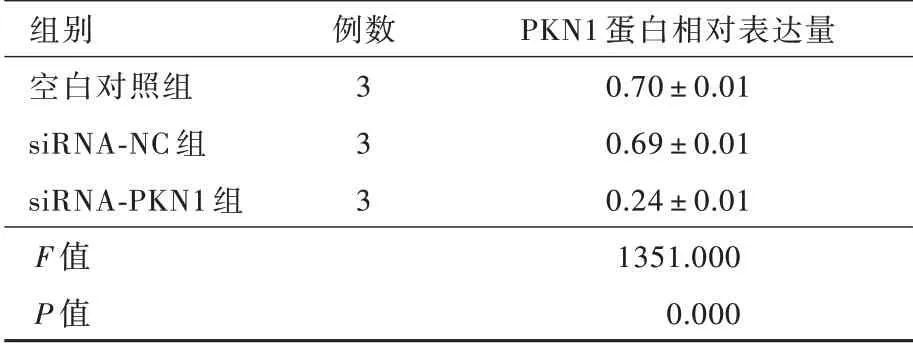
表2 不同组别A172 细胞PKN1 蛋白相对表达量的比较(±s)Table 2. Relative expression of PKN1 in blank group,siRNA⁃NC group and siRNA⁃PKN1 group (±s)
siRNA,small interference RNA,小 干 扰RNA;PKN1,protein kinase N1,蛋白激酶N1。The same for Table 3 and 4
例数组别空白对照组siRNA⁃NC 组siRNA⁃PKN1 组F 值P 值3 3 3 PKN1 蛋白相对表达量0.70±0.01 0.69±0.01 0.24±0.01 1351.000 0.000
表3 siRNA⁃PKN1 组与siRNA⁃NC 组A172 细胞增殖能力的比较(±s,OD450 nm)Table 3. The proliferation ability of A172 cells between siRNA⁃PKN1 group and siRNA⁃NC group (±s, OD450 nm)

表3 siRNA⁃PKN1 组与siRNA⁃NC 组A172 细胞增殖能力的比较(±s,OD450 nm)Table 3. The proliferation ability of A172 cells between siRNA⁃PKN1 group and siRNA⁃NC group (±s, OD450 nm)
组别siRNA⁃NC 组siRNA⁃PKN1 组t 值P 值例数3 3第1 天0.38±0.01 0.37±0.01 0.889 0.424第2 天0.39±0.01 0.37±0.01 1.040 0.357第3 天0.63±0.03 0.51±0.02 3.275 0.031第4 天0.72±0.02 0.53±0.03 5.949 0.004第5 天0.81±0.03 0.48±0.01 10.430 0.000第6 天0.83±0.05 0.46±0.02 6.645 0.003
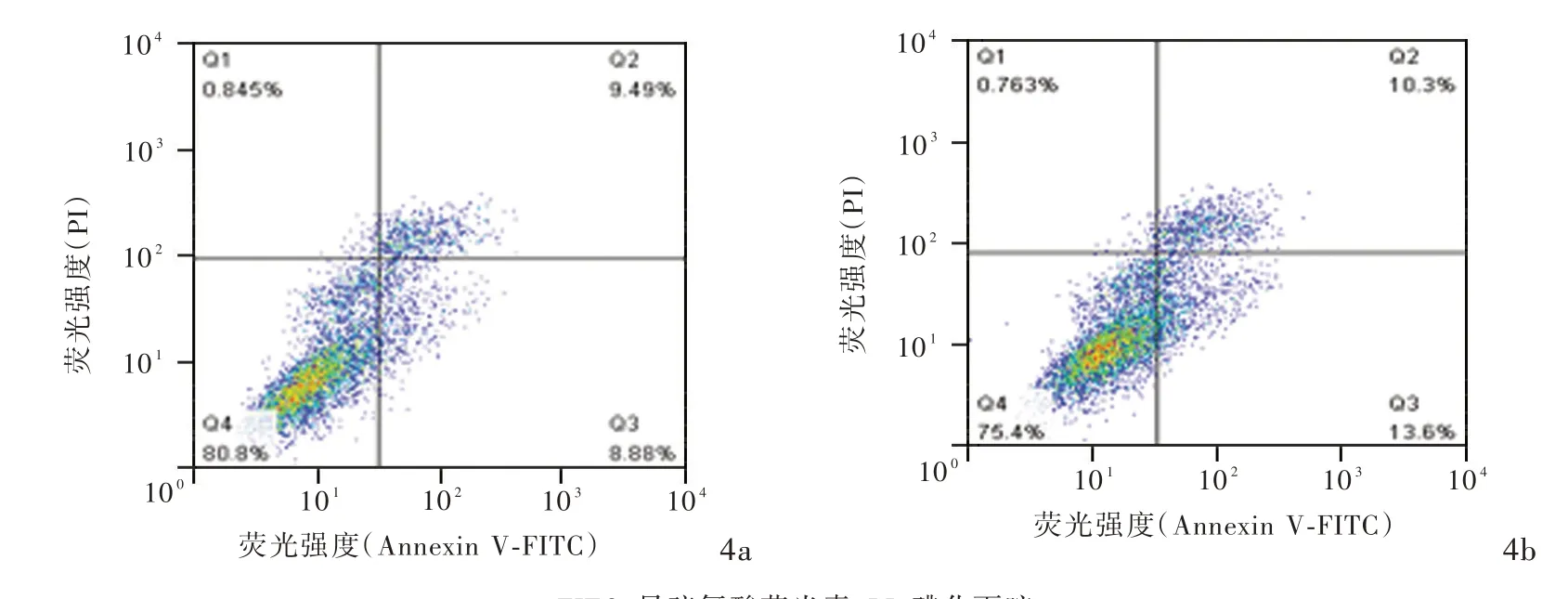
图4 流式细胞术显示,转染siRNA⁃PKN1 后A172 细胞凋亡率增加 4a siRNA⁃NC 组 4b siRNA⁃PKN1 组Figure 4 Flow cytometry showed the cell apoptosis of A172 cells was increased after siRNA⁃PKN1 transfection. siRNA⁃NC group (Panel 4a). siRNA⁃PKN1 group (Panel 4b).

图5 细胞划痕实验结果显示,siRNA⁃PKN1 组A172 细胞划痕的愈合能力明显低于siRNA⁃NC 组 HE染色 ×100Figure 5 Scratch healing test showed the scratch healing ability of siRNA⁃PKN1 group was significantly weaker than that of siRNA⁃NC group. HE staining ×100
综上所述,胶质瘤PKN1 mRNA 表达量高于正常脑组织,敲低PKN1 基因表达可抑制肿瘤细胞增殖、迁移和侵袭,进而抑制胶质瘤细胞的恶性生物学行为,同时诱导肿瘤细胞凋亡,进而抑制胶质瘤进展。本研究仅对PKN1 基因在正常脑组织和胶质瘤组织中的表达变化,以及敲除PKN1 基因对胶质瘤细胞生物学行为的影响进行了初步探讨,PKN1基因影响胶质瘤生物学行为的具体分子机制和相关信号转导通路,以及对患者预后和生存影响尚待进一步深入研究,以期为胶质瘤的诊断与治疗提供新的靶标。
表4 siRNA⁃PKN1 组与siRNA⁃NC 组不同观察时间点A172 细胞划痕愈合率的比较(±s,%)Table 4. The scratch healing rate of A172 cells at different time points between siRNA ⁃ PKN1 group and siRNA⁃NC group (±s, %)

表4 siRNA⁃PKN1 组与siRNA⁃NC 组不同观察时间点A172 细胞划痕愈合率的比较(±s,%)Table 4. The scratch healing rate of A172 cells at different time points between siRNA ⁃ PKN1 group and siRNA⁃NC group (±s, %)
组别siRNA⁃NC 组siRNA⁃PKN1 组例数3 3 0 h(1)0.00±0.00 0.00±0.00 12 h(2)11.42±5.66 11.40±0.36 36 h(3)48.25±1.49 29.24±0.85
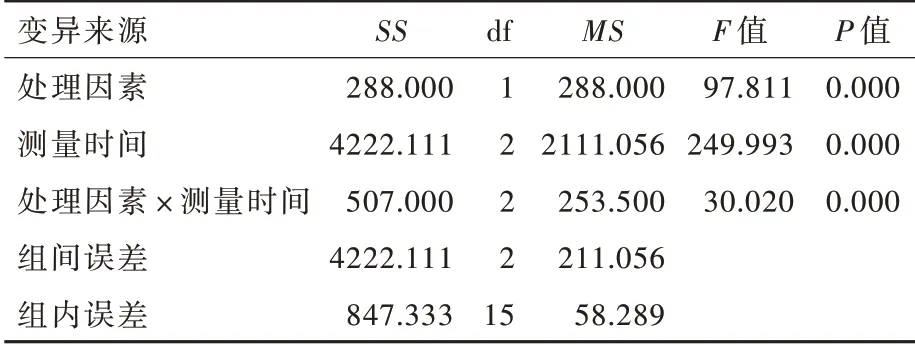
表5 siRNA⁃PKN1 组与siRNA⁃NC 组不同观察时间点A172 细胞划痕愈合率重复测量设计的方差分析Table 5. Repeated measurement design analysis of variance of the scrath healing rate of siRNA⁃PKN1 group and siRNA⁃NC group at different time points in A172 cells

表6 同一处理组不同观察时间点A172 细胞划痕愈合率的两两比较Table 6. Pairwise comparison of the scratch healing rate of A172 cells at the different time points in the same treatment group
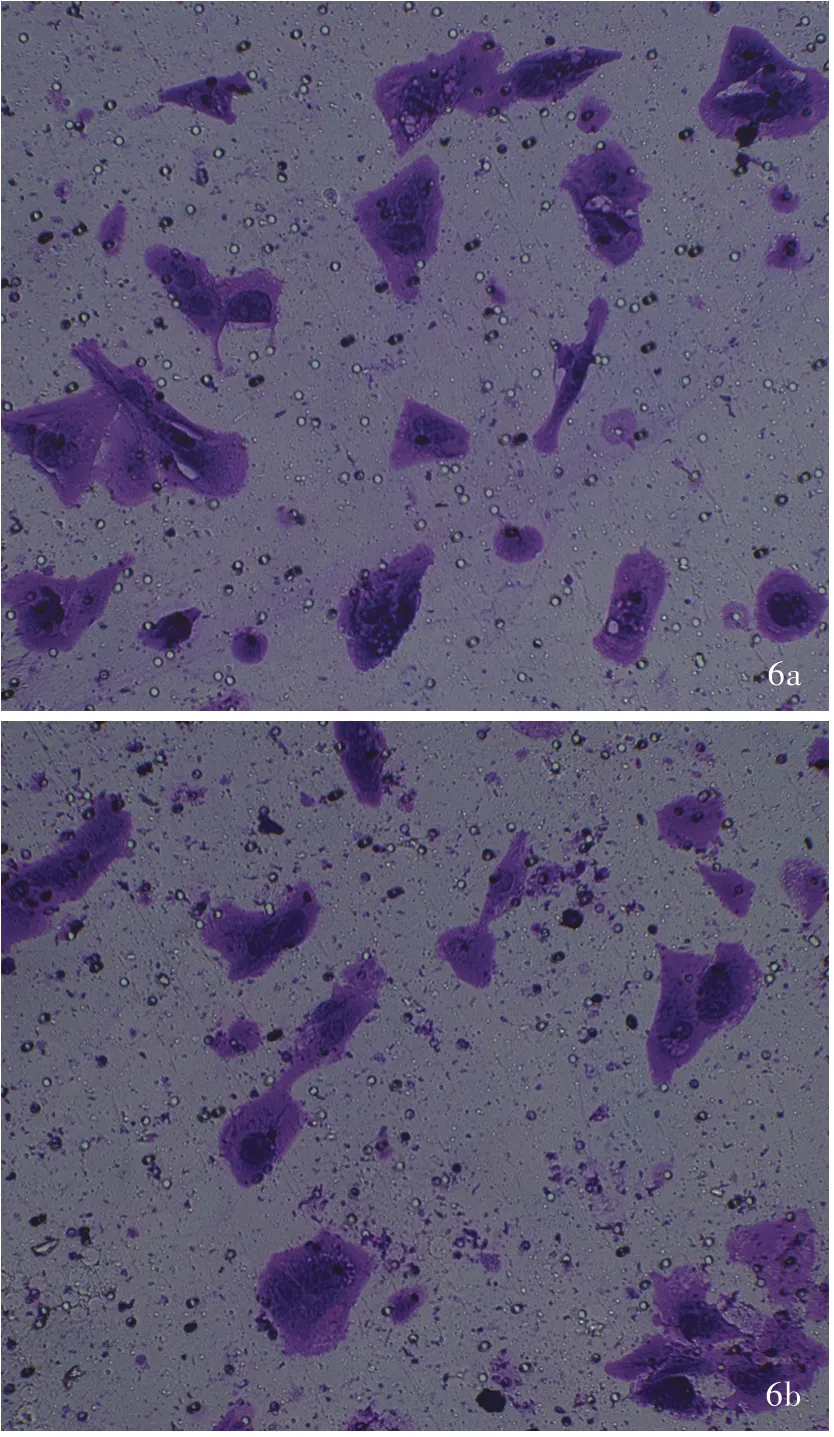
图6 光学显微镜观察显示,敲低PKN1 基因表达后A172 细胞穿膜数目减少 结晶紫染色 × 100 6a siRNA⁃NC 组 6b siRNA⁃PKN1 组Figure 6 Optical microscopy showed the number of A172 cells passing through the membrane decreased after PKN1 gene was knocked down Crystal violet staining ×100 siRNA⁃NC group (Panel 6a). siRNA⁃PKN1 group (Panel 6b).
利益冲突无
