微生物甲硫氨酸合成调控的综合研究进展与展望
2020-12-31赵嫚彭莉成浩应向贤汪钊
赵嫚,彭莉,成浩,应向贤,汪钊
(浙江工业大学 生物工程学院,浙江 杭州, 310014)
甲硫氨酸(methionine,Met),包括L-甲硫氨酸和D-甲硫氨酸两种构型,L-甲硫氨酸是人和动物必需的含硫氨基酸,在生物体内具有重要的生理生化功能。具体功能包括参与DNA、蛋白质的合成和蛋白结构的稳定;是精胺、亚精胺和乙烯等的前体,参与细胞分裂分化、凋亡、稳态和基因表达等生物生长发育的各个方面;并通过其主要代谢产物S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)间接调节各种代谢过程,为脂类、蛋白质、核酸、生物碱类和植物固醇等多种化合物提供甲基[1]。近年来,Met的需求量大幅度增加,预计2022年全球市场份额可达73亿美元,其中饲料添加剂是最大的消费市场。此外,Met在食品添加剂、医药和化妆品等领域的需求也呈长期稳定增长趋势[2-5]。
Met的合成主要包括化学法、酶法和微生物发酵法3种,目前工业上主要采用化学法和化学-酶法。尽管化学法和酶法技术成熟、成本低,但微生物发酵法因其绿色、高效和周期短等优势,受到研究者的广泛关注。Met发酵法合成的研究主要集中在大肠杆菌(Escherichiacoli)和谷氨酸棒状杆菌(Corynebacteriumglutamicum)中,目前已经报道的E.coli和C.glutamicum中Met的最高产量分别约为30 g/L和9.88 g/L[6-15],如表1所示,该水平距离工业化应用还存在一定的差距。随着Met市场需求的逐年增加,对提高Met产量的研究迫在眉睫。代谢物产量的高低与代谢合成过程中关键基因的相互调控密不可分。本文将对近几年Met的合成过程、调控机制和环境因素的研究进展进行全面综述,以期为Met合成产量的提高提供基础。
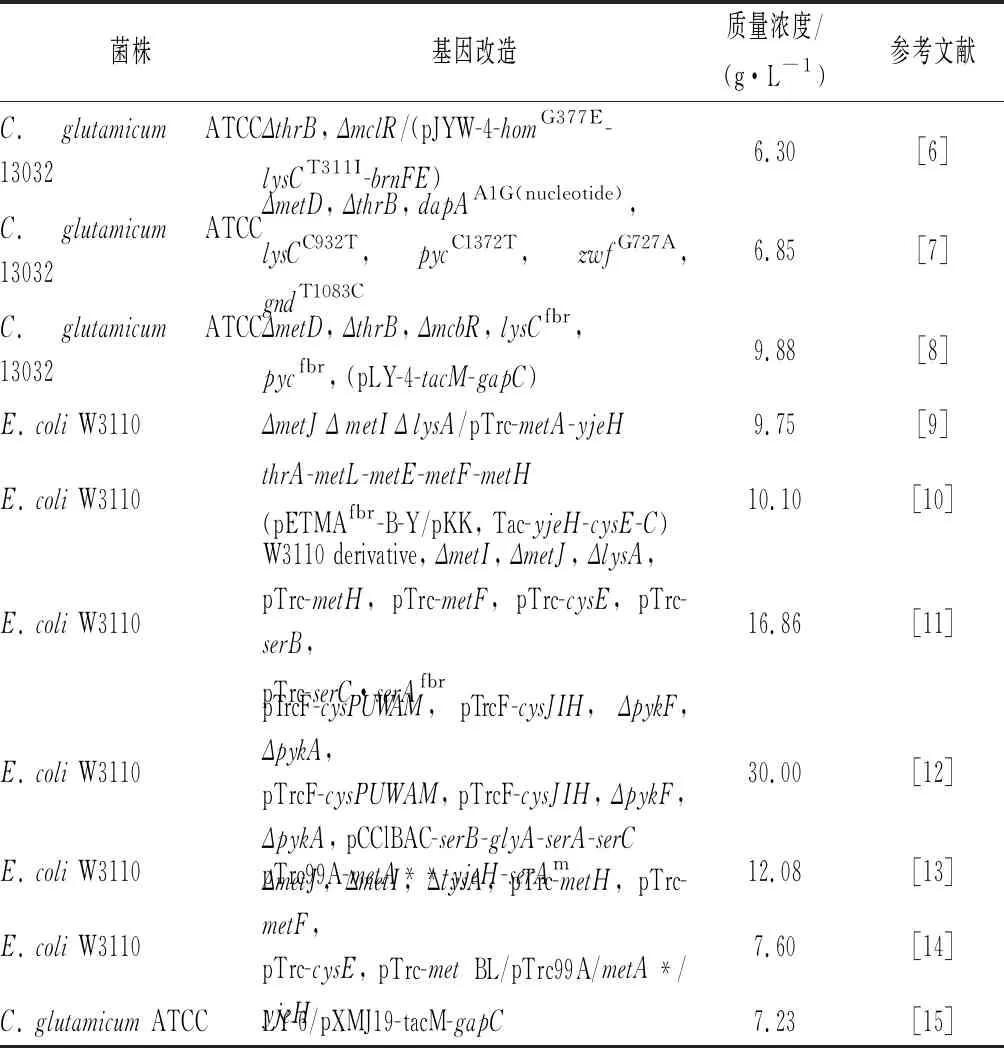
表1 甲硫氨酸产生菌构建的典型实例Table 1 Representative examples of the methionine producing strains
1 Met的生物合成
Met能够在大多数的植物和微生物中合成,其合成途径已经被完全解析,主要涉及两个部分,即从头合成途径-天冬氨酸合成途径和硫同化过程(图1)[16-17]。
1.1 从头合成途径
除Met以外,必需氨基酸异亮氨酸、赖氨酸和苏氨酸也是由该途径的不同分支产生(图1)。以C.glutamicum中从头合成途径为例,Met合成的具体过程是天冬氨酸在天冬氨酸激酶(Aspartate kinase, lysC)的催化下形成天冬氨酰-4-磷酸,然后被天冬氨酸半醛脱氢酶(Aspartaldehyde dehydrogenase, asd)催化形成天冬氨酸-4-半醛,后者被高丝氨酸脱氢酶(Homoserine dehydrogenase, hom)氧化成高丝氨酸;高丝氨酸在高丝氨酸-O-乙酰基转移酶(Homoserine acetyltransderase, metX)的作用下生成O-乙酰-L-高丝氨酸,然后再依次在胱硫醚γ合成酶(Cystathinine γ-synthase, metB)和胱硫醚β裂解酶的作用下分别形成胱硫醚和高半胱氨酸,最后高半胱氨酸在甲硫氨酸合成酶(Methionine synthase, metEH)的作用下,以四氢叶酸(CH3-THF)作为甲基供体合成Met。此外,在C.glutamicum中O-乙酰-L-高丝氨酸还可以在O-乙酰-L-高丝氨酸硫化酶(O-acetylhomoserine sulfhydrylase, metY)的作用下直接合成高半胱氨酸,进而合成Met。
在不同的生物中,合成途径存在一定的差异(图1, 表2),如高丝氨酸在C.glutamicum中经过高丝氨酸乙酰转移酶(Homoserine acetyltransferase, HAT)催化形成O-乙酰-L-高丝氨酸,而在E.coli和植物中则分别被高丝氨酸-O-琥珀酰基转移酶(Homoserine succinyltransderase, metA)和高丝氨酸激酶(Homoserine kinase, HK)催化形成O-琥珀酰-L-高丝氨酸和O-磷酸-L-高丝氨酸[18]。在古细菌中,天冬氨酸-4-半醛可以在硫化酶的作用下,直接合成高半胱氨酸[17]。
1.2 硫同化


图1 甲硫氨酸生物合成途径与调控Fig.1 Biosynthesis pathway and regulation of Methionine
从头合成途径中天冬氨酸直接合成Met需要1个ATP和2个NADPH,无机硫的同化则需要2个ATP和4个NADPH。因此Met的合成除了受到从头合成途径和硫同化内部途径关键酶等合成过程的调控外,还受到能量、辅因子和外界环境等多种不同层次的综合调控。
2 Met合成过程的调控
2.1 Met合成关键酶的调控
甲硫氨酸的合成受到多个关键酶的调控。首先,天冬氨酸激酶(Aspartate kinase,AK)是Met合成途径的第一个限速酶,催化ATP依赖的天冬氨酸磷酸化形成天冬氨酰-4-磷酸。在E.coli中AK由thrA、metL和lysC三个基因编码,这些基因的表达分别受苏氨酸、Met和赖氨酸的反馈阻遏调节[21]。而在C.glutamicum中AK仅有一个编码基因lysC,其表达同时受到苏氨酸和赖氨酸的反馈阻遏[22]。过表达lysC以及不受赖氨酸反馈抑制的突变体可使最终产物的含量显著提高。此外,在酶活水平上,AK还受其终端产物反馈抑制调节。在C.glutamicum中,对基因lysC进行定点突变为A279T和G359D,结果表明,lysC的突变可部分解除AK的活性受苏氨酸和赖氨酸的反馈阻遏抑制[21,23]。高丝氨酸脱氢酶是天冬氨酸合成途径的关键双功能酶,包含天冬氨酸激酶和高丝氨酸脱氢酶两个功能。在E.coli中,高丝氨酸脱氢酶是由thrA和metL两个基因进行编码。thrA的转录受到苏氨酸和异亮氨酸的抑制,具体原因是thrA、thrB(在苏氨酸合成途径中编码高丝氨酸激酶)和thrC(编码苏氨酸合成酶)在染色体上组成thrABC操纵子,苏氨酸和异亮氨酸通过与该操纵子上游的一段前导序列作用,反馈抑制基因的表达;而metL仅受到Met的反馈抑制。而在C.glutamicum中hom受到苏氨酸的抑制,且其G378S定点突变可部分解除hom的活性受苏氨酸和赖氨酸的反馈阻遏抑制[24-25]。在Met的合成过程中,除了Met以外,其下游产物S-腺苷甲硫氨酸(S- adenosylmethionine, SAM)也参与到Met的合成调控,比如metA和metB均受到SAM的反馈抑制,进而影响Met的合成。

表2 L-甲硫氨酸生物合成相关的酶及其编码基因Table 2 Enzymes and their encoding genes related to the methionine synthesis
在E.coli中,metA、metB和metC位于一个操纵子上,高效表达该操纵子基因是提高Met常用的策略。USUDA等[26]在E.coliW3110 中过表达metA,使Met的含量从0.13 g/L提高到0.24 g/L。郭谦等[27]在一株经过紫外诱变筛选选育出的Met高产菌株E.coliYB12的基础上,过表达metA、cysE(丝氨酸合成半胱氨酸途径中丝氨酸乙酰转移酶编码基因)和编码Met转运蛋白的yeaS基因,使E.coliYB12中Met的含量从60 mg/L提高到251 mg/L。另外,在1株生产赖氨酸的C.glutamicum菌株中,对metX和metY基因过表达导致Met的产量提高到16 g/L[28]。因此,Met合成途径的这些关键酶是调控其代谢途径的关键限速酶。WEI等[29]在提高Met重要中间体O-乙酰高丝氨酸的研究中,基于蛋白质工程的进化保守分析和结构指导的工程化提高了关键酶高丝氨酸乙酰转移酶(Homoserine acetyltransferase, metXlm)的活性且减少反馈抑制,使酶的活性增加了12.5倍,并通过守恒优化,最终使产物O-乙酰高丝氨酸产量增加57.14%[29]。
2.2 Met合成竞争途径的阻断
天冬氨酸合成途径中的赖氨酸和苏氨酸合成途径是Met合成的2个关键竞争途径,分别通过天冬氨酸-4-半醛和高丝氨酸实现竞争。研究发现,2个竞争途径的去除会为Met的合成提供更多的天冬氨酸-4-半醛和高丝氨酸底物,从而有效提高Met的产量。研究中常用的是赖氨酸合成途径中dapA(在赖氨酸合成途径编码二氢二吡啶甲酸合酶)和苏氨酸合成途径中thrB的敲除[16]。例如,在C.glutamicum13032中通过thrB的敲除和赖氨酸合成途径的减弱(dapA中用稀有密码子GTG代替起始密码子ATG),Met的产量从0.89 g/L提高到2.99 g/L,增加了3倍[7]。在E.coliW3110中,通过thrBC的敲除获得苏氨酸营养不良菌株,与野生型相比,其Met产量从无法检测提高到0.008 g/L[26]。吴婷婷[30]在E.coliK-12/pKD46菌株中敲除dapA基因后,其Met的含量提高了2.61倍。
2.3 Met转录调节子的转录调控
Met合成的转录调控除了限速酶的表达受到产物的反馈抑制外,还包括各种调控蛋白的调控[31],如MetJ和MetR。MetJ是Met合成的关键阻遏蛋白,在E.coli中阻遏metL、metA、metB、metC和metE基因的表达[32]。研究发现,将MetJ第54位的Ser替换为Asn,可以消除其反馈阻遏作用,提高Met的产量[33]。与E.coli相对应的,在C.glutamicum中Met的合成和摄入则是由McbR阻遏蛋白调控。McbR是C.glutamicum硫代谢的全局调控因子,涉及的基因包括hom、metX、metB、metE和metH等[34]。很多研究已经表明,通过对细菌metJ或mcbR基因的敲除或修饰,可解除其对细胞生产Met能力的禁锢,使菌株产生更多的Met[6,9,26-27,35]。与MetJ相反,MetR是一类转录激活因子,过表达后可大大促进Met的合成,前期研究,通过共表达metE和metR的研究发现,MetR是metE基因表达的反式激活因子,然而在MetJ蛋白和SAM的存在下,metR基因的表达被抑制[36]。
2.4 Met转运体的调控
菌株经过一系列代谢工程改造后,胞内氨基酸的积累会抑制其合成途径关键酶的催化活性,增加其降解途径的前体可利用性,甚至抑制细胞生长。因此,Met的转运也成为其生产的限速步骤[31,37]。在E.coli中,过表达Met输出蛋白YjeH、YeaS和敲除Met摄入蛋白MetD、MetP均显著增加了Met的积累[38-39]。在基因工程菌C.glutamicum中敲除Met的摄取蛋白MetQP或过表达输出蛋白BrnFE或MetT,Met的含量都显著提高[40-41]。
3 硫同化对Met合成的调控
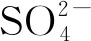

4 NADPH对Met合成的影响
Met的合成从硫同化到从头合成途径共需要6个NADPH和3个ATP。因此能量和还原力的提高是保证Met高效合成的关键。NADPH在C.glutamicum和E.coli中分别是以不同的方式进行提供。在C.glutamicum中,NADPH主要是通过戊糖磷酸途径中的葡萄糖-6-磷酸脱氢酶(G6PDH, zwf)和6-磷酸葡萄糖酸脱氢酶(6PGDH, gnd),而在E.coli中主要是通过膜结合的转氢酶合成[48-49]。此外,前人的研究已经尝试了不同策略来增加NADPH的供应,最常用的是调整糖酵解途径和戊糖磷酸途径之间的代谢流量比。C.glutamicum戊糖磷酸途径中的zwf和gnd进行突变以消除其反馈抑制,构建了zwfA243T和gndS361F突变体后,氨基酸的产量呈现了不同程度的增加[50]。此外,通过过表达果糖-1,6-二磷酸酶基因(fbp),加速碳源从糖酵解转向戊糖磷酸途径,也显著增加了还原力的提供[49,51]。此外,BOMMAREDDY等[52]不依赖于戊糖磷酸途径的想法,仅通过改变天然NAD+依赖的甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, gapA)的辅酶专一性来生成NADP+,在提高甘油醛-3-磷酸脱氢酶对NADP+的催化效率的同时,所有受试突变体的氨基酸产量都得到了显著提高(60%)。因此,糖酵解、戊糖磷酸途径和三羧酸循环等初级代谢途径中能量和辅助因子的通量变化通常会直接影响氨基酸的生物合成,因此,它们为生物工程转化提供了一个潜在的目标,包括与能量和还原力形成相关的反应。
5 环境营养元素对Met合成的影响
5.1 营养元素对Met合成的影响
碳源是微生物生长的物质基础。在工业氨基酸发酵中,葡萄糖、乳糖、可溶性淀粉、甘油和蔗糖是目前最常使用的碳源,其浓度过高或过低均会影响Met的合成。比如,刘俊琦等[53]向培养基中添加高浓度的葡萄糖,导致菌体浓度和Met产量都有所下降。进一步的研究发现,不同的菌株对不同碳源的利用具有显著的顺序作用,如酵母菌、E.coli和枯草芽孢杆菌(Bacillussubtilis)顺序利用较为明显,而C.glutamcum很少表现出对底物碳源的共利用[54]。可见碳源的种类和比例对Met的产量有明显的影响,因此可通过合适的碳源配比来提高Met生产水平。
氮源也是微生物生长的必需营养要素,为生物体合成蛋白质、核酸及其他含氮化合物提供原料。牛肉膏、蛋白胨及尿素是微生物常利用的氮源。不同的氮源对Met产量和菌体浓度均有影响,和其他氮素相比较,尿素的效果最好,适宜的尿素浓度对Met的产量至关重要[53]。
无机盐是维持细胞稳态的重要因子,在Met的合成中不仅提供必需的环境和营养成分,而且还可以合成Met螯合物。Met螯合物因其具有较高的生物价值,增加牲畜的免疫力,现被广泛用于饲料生产[55],如甲硫氨酸硒[56]、甲硫氨酸铜[57-59]、甲硫氨酸锌[60]和甲硫氨酸酪[61]。此外,在培养基中添加半胱氨酸乙硫氨酸等化合物均可使Met的产量显著调高,如KUMAR等[62]在培养基中添加半胱氨酸,可使Met产量从2.34 g/L提高到3.39 g/L。金利群等[63]的研究发现通过控制发酵培养基中Na2S2O3的添加量,可显著提高Met的产量;当Na2S2O3的添加量在3 g/L时,Met产量可提高41.3%。
5.2 培养条件对Met合成的影响
在发酵过程中,除了合理的营养元素外,培养条件也是影响Met产量的关键,包括pH、温度及搅拌速率等。在微生物合成Met的过程中,pH值会直接影响代谢途径中酶的活性。ZHOU等[13]研究发现,pH值为7时,E.coli发酵生产Met产量达到最高,分别比pH值6.5和7.5时提高37.78%和18.10%,表明中性pH值有助于E.coli发酵生产Met。温度影响微生物发酵生长主要涉及两个方面即影响菌体自身生长活力、诱导温度影响代谢途径蛋白质表达水平和相应酶活性[64]。有研究指出,用E.coli作为生产菌株生产Met最适宜温度是28 ℃,此时参与Met生物合成的关键酶活性增强,Met产量为1.24 g/L,较33 ℃和25 ℃时高1.09倍和2.21倍。搅拌速率是影响细胞生长和代谢产物生物合成的重要因素。搅拌速度在200~400 r/min最为适宜,当搅拌速率为300 r/min时Met的产量最高[13]。
6 总结和展望
Met具有重要的工业价值。近几年,随着发酵工程、代谢工程和合成生物学的不断发展和应用,研究者们利用基因工程菌生产Met已经成为Met开发的战略方向,但是基于目前的研究进展,距离工业化生产仍然有待研究。Met合成途径已经被完全解析,合成途径的代谢调控尤其是从头合成途径的调控多数已经被揭示,但是在前体物质H2S和天冬氨酸,以及辅因子NADPH和ATP的提供等方面的调控也是限制Met合成的关键因素,还需要进一步探究。本课题组致力于微生物高产Met的探究,前期的研究发现对各个前体物质合成综合调控的解析和工程化,是提高Met产量的关键。

